 |
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 20(2); 2020 > Article |
|
Abstract
Atrophic gastritis and intestinal metaplasia are well-known to be reliable indicators of gastric cancer risk. They are clinically important in deciding whether to recommend endoscopic surveillance. Herein I review the histopathologic diagnosis of atrophic gastritis and IM. Gastric atrophy is divided into metaplastic atrophy and non-metaplastic atrophy. IM is categorized as complete (type I) and incomplete (type II, III). Systematic interpretation of gastric atrophy and IM using the updated Sydney system or operative link on gastritis assessment is recommended. Furthermore, I suggest using the consensus definition of gastric atrophy and incomplete IM in the gastric biopsy pathology report to support the surveillance of high-risk gastric cancer group.
위암은 전 세계적으로 발생률과 사망률이 높은 암종으로, 우리나라에서는 2016년 암 발생률에서 갑상선암을 제외하면 전체 암의 첫 번째, 2016년 암 사망률에 있어서는 네 번째를 차지하고 있다[1,2]. 일반적으로 위암의 발생을 증가시키는 병변으로 위축성 위염(atrophic gastritis), 장상피화생(intestinal metaplasia, IM)이 알려져 있으며 위암의 유전적 변이와 유사한 양상을 보인다[3]. 특히 장상피화생은 전암성(premalignant) 병변으로 이형성(dysplasia)을 보이는 점막과 그 주위 장상피화생을 보이는 상피가 돌연변이 등의 유전적 변이에서 연관성을 보이며 이를 통하여 장상피화생에서 직접적으로 이형성 상피로 진행한다고 보고하였다[4]. 최근 이들 병변에 대한 임상적인 관심이 커지면서 환자 진단 및 치료를 위한 정확한 조직병리학적 진단의 요구가 증가하고 있으며 이에 따라 updated Sydney system, operative link on gastritis assessment (OLGA), operative link on gastric intestinal metaplasia assessment (OLGIM) 등이 제시되었다[5-7]. 이들 병변들은 상부 내시경 검사를 통한 생검 조직에서 흔히 발견되는 병변으로, 저자는 위의 위축성 위염 및 장상피화생의 조직학적 특징, 분류 및 병리학적 진단에 대하여 알아보고자 한다.
병리학적으로 화생(metaplasia)은 분화된 세포가 다른 형의 분화세포로 바뀌는 것으로, 세포 내외의 환경의 변화에 적응하기 위한 세포의 반응이다. 위에는 세 가지 종류의 화생성 변화가 관찰되는데 1) 장상피화생, 2) 가성유문화생(pseudopyloric metaplasia) 및 3) 췌장소포화생(pancreatic acinar metaplasia)이 있다[8]. 가성유문화생은 위체부의 산과 소화효소를 분비하는 위저샘(gastric oxyntic gland)이 유문샘(pyloric gland)으로 변하는 것으로, spasmolytic polypeptide-expressing metaplasia라고도 알려져 있으며 주로 자가면역성 위염과 연관되어 장상피화생의 전구 단계로 생각된다[9]. 장상피화생은 조직학적으로 위소와(gastric pit)의 표면 또는 저부의 위상피 세포들이 장상피(소장 및 대장)로 형태학적 및 조직화학적으로 변화하는 것으로 정의할 수 있다[8,9]. 장상피화생의 분류는 1981년에 Jass와 Filipe [10]의 조직화학염색(histochemical stain) 특성에 따른 분류가 대표적이다. 이 분류에 의하면 장상피화생을 완전형(complete IM)과 불완전형(incomplete IM)으로 구분하고 점액의 다당류 특성에 따라 incomplete IM을 다시 incomplete without sulfomucin (type II) 및 incomplete with sulfomucin (type III)으로 분류한다(Table 1). Periodic acid Schiff (PAS), Alcian blue (AB), high iron diamine (HID) 염색을 시행하면 PAS 염색에 양성을 보이는 중성점액, AB 염색에 양성을 보이는 sialomucin (산성점액), HID 염색에 양성을 보이는 sulfomucin (산성점액)으로 분류할 수 있다. 1형 완전형 장상피화생(complete type I IM)은 형태학적으로 소장 흡수상피의 특징인 배세포(goblet cell)와 솔가장자리(brush border)를 가지고 있어서 조직화학염색 시 배세포에서 산성점액의 일종인 sialomucin (PAS+/AB+)을 보인다(Fig. 1A). 2형 불완전 장상피화생(incomplete type II IM)은 형태학적으로 대장상피의 특징을 보이므로 sialomucin이 배세포뿐 아니라 원주세포에서도 관찰되며 솔가장자리가 없다(Fig. 1B). 3형 불완전 장상피화생(incomplete type III IM)은 원주세포에서 sulfomucin (PAS+/HID+)이 관찰된다. Jass와 Filipe [10]는 3형 불완전 장상피화생이 장형 위암과 관련 있다고 보고하였고, 다른 여러 저자들도 2, 3형 불완전 장상피화생은 1형 완전형 장상피화생보다 위암의 가능성이 높다고 보고하였으나 현재까지도 논란의 여지가 남아 있다[11-13]. 또한 위상피 조직의 부위에 따른 항체를 이용한 면역조직화학염색을 통하여 장상피화생을 분류할 수 있다. 배세포는 Muc2, 소와상피는 Muc5AC, 유문샘은 Muc6, 솔가장자리는 CD10 항체를 이용하여 확인할 수 있다. 여러 연구자들이 장상피화생을 위장혼합형(Muc5AC [+]/Muc2 [+])과 장형(Muc2 [+]/CD10 [+])으로 분류하였고, 위암 및 위 이형성 병변의 주변 점막에서 위장혼합형의 장상피화생이 많이 발생함이 보고되었다[14,15].
위축성 위염을 이해하기 위해서는 먼저 위점막의 정상 조직학적인 구조를 이해해야 한다. 위점막은 표면 단층 원주상피로 구성된 위소와(gastric foveolae)와 아래쪽의 위샘상피(gastric gland)로 구성되어 있다. 위 부분에 따라 위샘상피는 점액을 분비하는 점액분비세포(위분문부, 유문부)와 위산 및 펩시노젠을 분비하는 세포(위저부, 체부)로 구성되어 있다. 위축(atrophy)이라 함은 위점막을 구성하는 위샘상피의 소실로 정의된다(loss of appropriate gland). 즉, 위분문부와 유문부는 점액분비 세포가 소실되고 위저부 및 체부는 위산 및 펩시노젠을 분비하는 세포가 소실된다. 그러므로 위축성 위염을 진단할 때에는 위의 생검 부위가 필수적인 요소이다. 위축성 위염은 크게 1) 화생성 위축(metaplastic atrophy), 2) 비화생성 위축(non-metaplastic atrophy)으로 구분할 수 있다. 화생성 위축은 고유의 위샘 구조가 장상피화생이나 가성유문화생 샘구조로 바뀌는 것이다(Fig. 2A). 위샘의 수적인 감소는 없지만 상피화생을 통하여 기능적으로 점액 분비 기능이나 위산 및 펩시노젠을 분비하는 기능은 감소하게 된다. 비화생성 위축은 위점막을 구성하는 위샘 구조가 염증이나 섬유화로 대체되고 고유판(lamina propria)이 확대되는 것이다(Fig. 2B).
위축성 위염과 장상피화생은 병리과에서 시행하는 헤마톡실린 에오진(H&E) 염색법을 이용한 광학현미경 검사에서 쉽게 진단이 가능하다. 장상피화생의 조직화학적 분류 중 완전형 및 불완전형 장상피화생도 숙달된 소화기 병리의사이면 비교적 손쉽게 분류할 수 있다(Fig. 1). 상기한 PAS, AB 등의 조직화학염색 및 점액염색을 위한 면역조직화학염색은 일반적인 진단 과정에서는 이루어지지 않는다. 위축성 위염과 장상피화생의 체계적인 조직병리학적 진단의 필요성이 대두되어 updated Sydney system, OLGA, OLGIM 등이 제시되었다[5-7]. 일반적으로 updated Sydney system 및 OLGA staging system에서 권고되는 정확한 진단을 위한 생검 방법은 유문부에서 2~3 cm 내외의 전정부 소만 및 대만(A1, A2), 위각부(IA), 위각부에서 약 4 cm 근위부 체부 소만(B1), 분문부에서 8 cm 원위부 체부대만(B2)에서 검체를 채취하는 것이다. 또한 전정부(A1, A2)와 위각부(IA) 및 체부(B1, B2) 검체는 각각 검체통에 넣어서 병리과로 보내야 한다(Fig. 3) [5-7]. 이렇게 생검 부위를 정하는 이유는 1) 위각부는 위점막에서 가장 먼저 위축 및 장상피화생이 일어나는 부위로 알려져 있으며, 2) 위체부의 가성유문화생을 진단하기 위해서는 위전정부 및 위체부를 분리하여야 하기 때문이다. Updated Sydney system에서는 위 생검의 병리학적인 소견 중 1) 헬리코박터 파일로리의 밀도(Helicobacter pylori density), 2) 중성구의 침윤(polymorphonuclear neutrophil activity), 3) 만성 염증(chronic inflammation), 4) 위축(glandular atrophy), 5) 장상피화생(IM)의 정도를 논문에 제시한 그림(visual analogue scale)을 참고하여 정상(normal), 경도(mild), 중등도(moderate), 심도(marked)로 판독하도록 권고하고 있다. OLGA 및 OLGIM staging system에서는 위축 및 장상피화생 정도를 양을 측정하여 음성(absent), 경도(mild, ≤30%), 중등도(moderate, 31~60%), 심도(marked, ≥61%)의 4등급으로 분류한다. 전정부 및 체부에서 각각의 위축 및 장상피화생의 점수를 부여한 후 각각의 점수를 합산하여 위축 및 장상피화생의 정도를 stage I에서 stage IV까지 표기한다(Fig. 4). 하지만 아직도 여러 병리의사들 사이에서는 위축의 정도 및 장상피화생의 정도에 대한 진단기준이 혼재되어 있으며 일치도가 떨어진다. 특히 위축의 정도에 대한 진단의 일치도가 장상피화생의 정도에 대한 진단의 일치도 보다 훨씬 떨어지는 것으로 보고되어 있다[16-20]. 최근 Kim 등[21]의 연구에서 위축에 대한 정의를 병리의사 간에 일치시키려는 노력(consensus meeting)을 통하여 진단의 일치율이 κ=0.19 (consensus meeting 전)에서 κ=0.43 (consensus meeting 후)으로 개선된다고 보고하였다. 저자들이 사용한 위축의 정의는 다음과 같다. 1) 위축의 정의: 위축은 위점막의 샘 부위가 소실(비화생성 위축)되거나 또는 다른 형의 세포(장상피화생, 가성유문화생)로 대치되는 것으로, 2) 위체부인 경우 위샘/위소와의 비율(ratio of the glandular part to the foveolar part)이 1:1보다 작을 때, 위전정부의 경우 위샘 간의 공간(interglandular space)이 10%보다 많을 때로 정의한다(Fig. 2) [21]. 위축의 정의를 병리의사 간에 consensus meeting을 통하여 일치시키는 노력을 통하여 위축성 위염의 진단에 대한 신뢰도가 증가할 것으로 생각된다.
일반적으로 장상피화생의 분포가 넓을수록 위암의 발생이 증가한다고 보고되어 있다. 특히 2, 3형 불완전 장상피화생은 1형 완전형 장상피화생보다 위암의 가능성이 높다고 알려져 있으며[11-13], Correa 등[22]은 불완전 장상피화생의 경우 병리보고서에 기재하고 추적 관찰을 하는 것으로 권고하였다. 또한 광범위한 장상피화생(extensive IM)의 정의를 1) 위의 두 부분 이상에서 장상피화생이 발견되는 경우, 2) 위의 두 부분 이상의 생검에서 중등도 이상의 장상피화생이 보이는 경우로 정하고, 조직검사에서 광범위 장상피화생이나 불완전 장상피화생이 나오게 되면 첫 1년에 내시경 검사 및 혈청 펩시노겐 검사를 시행하고 매 3년마다 시행할 것을 권고하였다[22]. 또한 OLGA system에서 위축의 정도에 따라 stage 0~II를 저위험군, stage III~IV를 고위험군으로 나누고, 고위험군인 경우 위암에 대한 선별검사를 추천하였다[23]. 특히 Rugge 등[24]은 OLGA system에 따른 고위험군 stage III~IV 환자에서 전향적 연구를 통하여 위상피성 병변이 저위험군보다 많이 발생함을 보고하였다.
저자는 위의 위축과 장상피화생의 조직학적 특징, 조직학적 분류 및 병리학적 진단에 대하여 알아보았다. 위축 및 장상피화생은 위암의 전구 병변으로 내시경 검사를 통한 병리조직 검사에서 쉽게 찾을 수 있다. 앞으로 병리의사 간에 상피화생(장상피화생, 가성유문화생) 및 위축의 진단 일치도 향상을 위한 노력이 있어야 할 것으로 생각되며, updated Sydney system, OLGA system, OLGIM system이 좋은 예가 될 수 있을 것으로 생각된다. 또한, 심한 위축 및 불완전 장상피화생을 보이는 경우 위암의 위험도에 대한 추후 관찰 및 검사가 이루어져야 할 것으로 생각된다.
Fig. 1.
(A) Complete type intestinal metaplasia (IM) shows small intestinal, absorptive enterocytes with brush borders (large arrow) and goblet cells (small arrow) (H&E, ×400). (B) Incomplete IM shows large intestinal, nonabsorptive columnar cells with goblet cells (H&E, ×400).
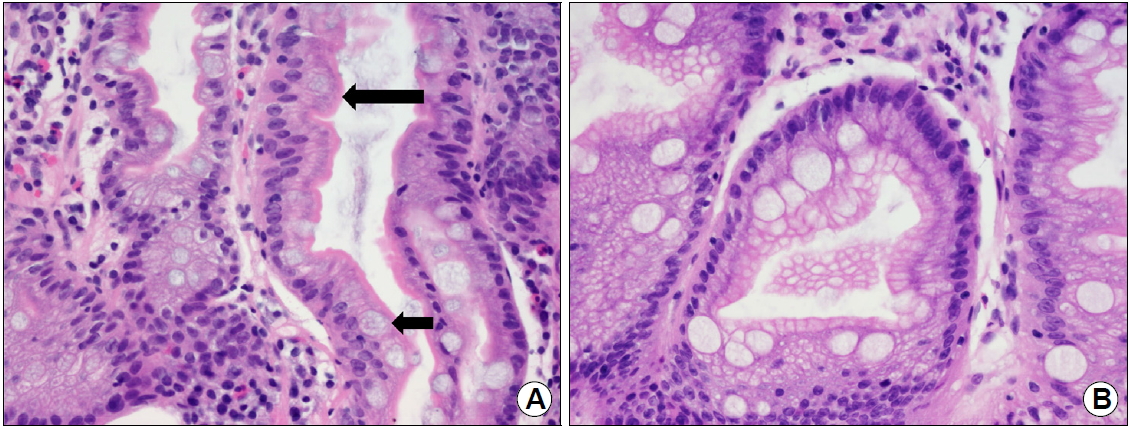
Fig. 2.
Gastric mucosa showing gastric foveolar epithelium (f) and gastric glands (g). (A) Metaplastic gastric atrophy. Gastric mucosa showing corpus glands replaced by complete intestinal metaplasia (arrow; H&E, ×100). (B) Non-metaplastic gastric atrophy. Gastric mucosa showing loss of gastric antral glands with the expansion of interglandular spaces by inflammatory infiltrates and fibrosis (arrow; H&E, ×100).

Fig. 3.
Protocols of biopsy sampling for the operative link on gastritis assessment staging system for chronic gastritis. Biopsy from the antrum (A1, A2) and gastric angle (IA), two biopsies from the corpus (B1, B2) are separately submitted. Adapted from the article of Dixon et al. Am J Surg Pathol 1996;20:1161-1181 [5].

Fig. 4.
(A) The operative link on gastritis assessment staging system for chronic gastritis. (B) The operative link on gastric intestinal metaplasia assessment staging system.

Table 1.
Type of Intestinal Metaplasia and Histochemical Stain
REFERENCES
1. Greenlee RT, Murray T, Bolden S, Wingo PA. Cancer statistics, 2000. CA Cancer J Clin 2000;50:7–33.


2. Ministry of Health and Welfare.; Korea Central Cancer Registry.; National Cancer Center. Annual report of cancer statistics in Korea in 2016. Goyang: National Cancer Center, 2018.
3. Padmanabhan N, Ushijima T, Tan P. How to stomach an epigenetic insult: the gastric cancer epigenome. Nat Rev Gastroenterol Hepatol 2017;14:467–478.



4. Gutierrez-Gonzalez L, Graham TA, Rodriguez-Justo M, et al. The clonal origins of dysplasia from intestinal metaplasia in the human stomach. Gastroenterology 2011;140:1251–1260; e6.


5. Dixon MF, Genta RM, Yardley JH, Correa P. Classification and grading of gastritis. The updated Sydney system. International workshop on the histopathology of gastritis, Houston 1994. Am J Surg Pathol 1996;20:1161–1181.


6. Rugge M, Genta RM.; OLGA Group. Staging gastritis: an international proposal. Gastroenterology 2005;129:1807–1808.


7. Capelle LG, de Vries AC, Haringsma J, et al. The staging of gastritis with the OLGA system by using intestinal metaplasia as an accurate alternative for atrophic gastritis. Gastrointest Endosc 2010;71:1150–1158.


8. El-Zumanity H, Riddel RH. Histology for pathologist. 4th ed. Philadelphia: Lippincott Williams & Williams, 2012.
9. Tan D, Lauwers GY. Advances in surgical pathology: gastric cancer. Philadelphia: Lippincott Williams & Williams, 2011.
10. Jass JR, Filipe MI. The mucin profiles of normal gastric mucosa, intestinal metaplasia and its variants and gastric carcinoma. Histochem J 1981;13:931–939.



11. Filipe MI, Muñoz N, Matko I, et al. Intestinal metaplasia types and the risk of gastric cancer: a cohort study in Slovenia. Int J Cancer 1994;57:324–329.


12. Rokkas T, Filipe MI, Sladen GE. Detection of an increased incidence of early gastric cancer in patients with intestinal metaplasia type III who are closely followed up. Gut 1991;32:1110–1113.



13. Kang KP, Lee HS, Kim N, et al. Role of intestinal metaplasia subtyping in the risk of gastric cancer in Korea. J Gastroenterol Hepatol 2009;24:140–148.


14. Park DY, Srivastava A, Kim GH, et al. Adenomatous and foveolar gastric dysplasia: distinct patterns of mucin expression and background intestinal metaplasia. Am J Surg Pathol 2008;32:524–533.


15. Inada K, Nakanishi H, Fujimitsu Y, et al. Gastric and intestinal mixed and solely intestinal types of intestinal metaplasia in the human stomach. Pathol Int 1997;47:831–841.


16. el-Zimaity HM, Graham DY, al-Assi MT, et al. Interobserver variation in the histopathological assessment of Helicobacter pylori gastritis. Hum Pathol 1996;27:35–41.


17. Offerhaus GJ, Price AB, Haot J, et al. Observer agreement on the grading of gastric atrophy. Histopathology 1999;34:320–325.


18. Chen XY, van der Hulst RW, Bruno MJ, et al. Interobserver variation in the histopathological scoring of Helicobacter pylori related gastritis. J Clin Pathol 1999;52:612–615.



19. Aydin O, Egilmez R, Karabacak T, Kanik A. Interobserver variation in histopathological assessment of Helicobacter pylori gastritis. World J Gastroenterol 2003;9:2232–2235.



20. Leja M, Funka K, Janciauskas D, et al. Interobserver variation in assessment of gastric premalignant lesions: higher agreement for intestinal metaplasia than for atrophy. Eur J Gastroenterol Hepatol 2013;25:694–699.


21. Kim SS, Kook MC, Shin OR, et al. Factors to improve the interobserver agreement for gastric atrophy and intestinal metaplasia: consensus of definition and criteria. Histopathology 2018;72:838–845.


22. Correa P, Piazuelo MB, Wilson KT. Pathology of gastric intestinal metaplasia: clinical implications. Am J Gastroenterol 2010;105:493–498.




-
METRICS

-
- 1 Crossref
- 9,923 View
- 252 Download
- Related articles in Korean J Helicobacter Up Gastrointest Res
-
Parasitic Diseases of Upper Gastrointestinal Tract2024 June;24(2)
Histopathology of Gastric Cancer2023 June;23(2)
Natural Course of Atrophic Gastritis and Intestinal Metaplasia2020 June;20(2)






