 |
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 23(2); 2023 > Article |
|
위암은 세계에서 다섯 번째로 가장 흔하게 진단되면서 네 번째로 높은 사망률을 보이는 암종이다[1]. 지난 반세기 동안 발생률과 사망률은 현저히 감소하였지만, 위암은 한국과 일본, 중국 등 특히 동아시아 국가에서 여전히 발생 빈도가 높다. 위암의 정확한 조직학적 분류는 적절한 치료법을 결정하고 예후를 예측하는 데 중요하다. 따라서 위암의 다양한 조직학적 아형들과 그 임상적 의미에 대해 논의해보고자 한다.
위암의 조직학적 분류는 기본적으로 World Health Organization (WHO) 5판의 분류를 따른다(Table 1) [2]. 이와 함께 WHO 분류에 따른 대표적인 조직병리 아형들을 Fig. 1에 소개하였다. 위암의 조직학적 진단은 종양의 대부분을 차지하는 아형에 따라 이루어지지만, 특수한 조직학적 아형의 진단은 각 아형의 진단 기준에 따라 이루어진다.
관샘암종(tubular adenocarcinoma)은 위암에서 가장 흔한 조직학적 아형으로, 내강을 만드는 것이 특징적인 종양이다. 내강이 늘어나거나 비틀어진 형태, 복잡한 형태를 보일 수 있고, 틈새 형태의 내강도 보일 수 있다[2]. 고분화(well differentiated), 중분화(moderately differentiated), 저분화(poorly differentiated)로 등급을 분류하며, 고분화 및 중분화형에서는 종양세포들이 원주형이나 입방형, 납작한 세포 형태를 보일 수 있지만, 많은 부분에서 내강이 관찰되고, 내강 내부에 점액이나 세포 부스러기가 있을 수 있다. 일본 위암 분류에서는 “Tubular 1: tub1”과 “Tubular 2: tub2”가 각각 관샘암종 고분화와 중분화에 해당하고, Nakamura 분류로는 분화형에 속한다[2]. 저분화형은 내강을 만들지 않는 고형의 종양 부위가 대부분을 차지하는 종양이지만, 일부에서는 내강 혹은 틈새 형태의 구조가 관찰된다. 일본 위암 분류에서는 “poorly 1 (solid type): por1”에 해당하고, Nakamura 분류로는 미분화형으로 분류된다[2].
유두모양샘암종(papillary adenocarcinoma)은 유두상 구조를 형성하는 것이 특징적인 종양이다. 유두상 구조는 유두 중심부에 섬유혈관핵이 있어야 하며, 유두를 둘러싸는 세포들은 원주형 혹은 입방형의 형태를 보인다[2]. WHO 분류에서는 유두모양샘암종의 진단 기준이 명확히 규정되어 있지 않지만, 일반적으로 전체 종양의 50% 이상이 유두상 구조를 보일 때 이 아형으로 진단할 수 있다[3]. 유두모양샘암종은 세포의 이형성이나 구조의 복잡성에 따라서 고분화, 중분화, 저분화로 나눌 수 있으며, 많은 수에서 고분화를 보인다. 일부 보고에서는 유두모양샘암종의 림프혈관 침윤, 림프절 전이 및 간 전이가 관샘암종보다 흔하며 더 나쁜 예후를 보인다고 보고하고 있다[3,4]. Nakamura 분류로는 분화형에 해당하나, 유두모양샘암종의 빈도가 높지 않기 때문에 분화도를 나누는 기준이 잘 정립되어 있지 않아, 저분화형인 경우 어떻게 해야 할지는 좀 더 연구가 필요하다. 일본 위암 분류에서는 “Papillary: pap”으로 분류된다[2].
저응집암종(poorly cohesive carcinoma, PCC)은 관샘암종에 이어 흔하게 관찰되는 아형이며, 샘구조를 형성하지 않으면서 고립되거나 작은 세포군을 형성하는 응집력이 떨어지는 종양세포로 구성된다[2]. 저응집암종은 반지세포암종(signet ring cell carcinoma, SRC)과 비반지세포 저응집암종(PCC not otherwise specified, PCC-NOS)으로 나뉠 수 있다. WHO 5판 분류에서 반지세포암종은 주된 혹은 대부분의 종양세포가 반지세포인 경우로 정의된다[2]. 현재까지 비반지세포 저응집암종과 반지세포암종을 가를 수 있는 확실한 진단 기준은 없으나, Mariette 등[5]은 반지세포성분의 비율에 따라 반지세포암종(>90%), 반지세포성분을 가지는 저응집암종(PCCs with SRC component, 10~90%), 비반지세포 저응집암종(<10%)의 분류 정의를 제시하였다. 최근 비반지세포 저응집암종이 반지세포암종에 비해 예후가 더 나쁘고, 서로 다른 분자 프로필을 보인다는 연구들이 발표되고 있는 바[6,7], 두 군의 확실한 분류를 위해서는 앞으로 추가적인 연구들이 더 필요하다. 일본 위암 분류에서의 “Signet-ring cell: sig”과 “Poorly 2 (non-solid type): por2”가 각각 반지세포암종과 비반지세포 저응집암종에 해당하고, Nakamura 분류로는 미분화형으로 분류된다[2].
점액샘암종(mucinous adenocarcinoma)은 세포바깥 점액이 전체 종양 면적의 50%를 넘게 차지하는 샘암종으로 정의된다[2]. 점액샘암종의 종양 세포들은 샘구조를 이루거나 반지세포암종과 같이 특별한 구조를 만들지 않는 흩어진 세포의 형태를 보일 수 있다. 최근 연구에 의하면 흩어진 세포의 형태를 보이는 점액샘암종의 돌연변이 양상이 장형(intestinal-type)이나 미만형(diffuse-type) 위암과는 다르다는 것이 보고되어 있다[2]. Nakamura 분류로는 구성하는 종양세포의 성분에 따라 분화형 혹은 미분화형으로 분류될 수 있다[2].
혼합샘암종(mixed adenocarcinoma)은 WHO 제5판의 정의에 따르면 샘구조를 생성하는 종양(관샘암종/유두모양샘암종)과 반지세포암종을 포함하는 응집암종이 한 종양에서 동시에 관찰될 때 진단할 수 있다[2]. 많은 조기위암의 연구에서 혼합샘암종이 한 가지 아형으로 구성된 암종에 비해 나쁜 예후를 보인다고 보고하고 있다[2,8]. 한편, 문헌에 따라서는 저응집암종을 비롯해 분화가 나쁜 샘암종 성분이 샘구조를 만드는 종양 성분과 섞여 있는 증례도 혼합샘암종으로 분류하고 있으나, 이 경우 역시 순수아형의 암종에 비해 나쁜 예후를 가지는 것으로 제시되어 있다[9]. 현재까지 혼합샘암종의 진단을 위한 샘구조 종양과 저응집암 성분 각각의 최소 비율에 대한 진단 기준은 없다. 그렇지만, 앞의 기술한 내용을 종합하면 샘구조의 종양 성분과 샘 구조를 만들지 않는 종양 성분이 같이 있는 조기위암은 일반적으로 나쁜 예후를 가지는 것으로 판단되므로, 종양 내에서 다양한 조직학적 아형이 관찰될 경우 모든 종양 구성 성분을 언급해 주는 것이 좋다. 이 경우 각 구성 성분의 양적 우위성을 나 타낼 수 있도록 기술해야 한다[10].
상기 암종 이외에 아래에 기술하는 암종들은 상대적으로 저빈도로 관찰되는 아형들로, Nakamura 분류법으로는 분류되지 않는다[2]. 림프구버팀질동반샘암종(adenocarcinoma with lymphoid stroma)은 림프구버팀질동반수질암종(medullary carcinoma with lymphoid stroma)이라고도 불리며, 전체 위암의 1~4%를 차지하는 드문 조직형으로 많은 림프구 침윤이 특징적인 암종이다. 종양세포는 불규칙한 판상 구조, 뚜렷하지 않은 형태를 보이는 군집이나 세관, 혹은 융합세포 형태 등 다양한 배열을 보일 수 있고 일부에서는 명확한 샘구조를 형성하는 경우도 있는데, 이 종양세포들 사이로 많은 림프구 및 형질세포가 미만성으로 침윤되어 있다. 2 이와 함께 종양 경계부는 섬유조직 형성이나 침윤성 성장이 거의 관찰되지 않는 특징을 가진다. 림프구버팀질동반샘암종은 대다수가 Epstein-Barr virus (EBV) 양성을 보이는 것으로 알려져 있고, 일부는 현미부수체불안정성을 나타낸다[2]. 이 아형은 종양의 침윤 정도 및 림프절 전이 빈도가 낮아 일반적으로 예후가 좋은 것으로 보고되어 있다[11].
간세포모양샘암종(hepatoid adenocarcinoma)은 판상 혹은 기둥 모양으로 배열된 간세포암종과 유사한 형태를 보이는 암종으로, 풍부한 호산성 세포질을 가지는 다각형의 종양세포들의 집합으로 구성되어 있다[2]. 알파태아단백(alpha-fetoprotein)의 발현을 면역조직화학염색방법으로 확인할 수 있으며, 수술 전 이미 간으로의 전이나 림프절 전이가 있는 경우가 많아 예후가 나쁘다[12].
미세유두모양샘암종(micropapillary adenocarcinoma)은 작은 유두성 세포 군집들이 투명한 공간에 둘러싸인 형태의 암종으로, 유두모양샘암종과 달리 중심부에서 섬유혈관핵은 관찰되지 않는다[2]. 이런 형태가 전체 종양의 10% 이상을 차지할 때 미세유두모양샘암종으로 진단할 수 있다[13]. 이 아형은 림프절 전이가 흔하고, 불량한 예후와 관련이 있다[2].
위바닥샘형샘암종(adenocarcinoma of fundic-gland type)은 위의 주세포와 벽세포의 분화를 보이는 세포로 구성되어 있는 고분화형 선암으로 WHO 5판에 처음 등재되었다. 이 종양은 핵의 이형성이 뚜렷하게 관찰되지 않고 구조적 이상이 명확하지 않은 경우가 많기 때문에, 내시경 생검 시 이형성 정도가 낮은 병변으로 오인될 수 있다. 일반적으로 만성위염이나 장상피화생이 없는 위바닥샘의 심부 위점막에서 발생하여, 병변의 크기가 작더라도 점막하층으로 침윤하는 경우가 드물지 않은 것으로 보고되고 있다[14]. 하지만 이 아형은 세포의 증식 활성도가 낮고 림프절 전이 및 재발이 매우 드물어서, 양호한 예후를 가지는 저등급의 악성 종양으로 간주된다[15,16].
위에서 기원한 편평세포암종(squamous cell carcinoma)은 아주 드문 종양으로 100개 이내의 증례만 보고되어 있다[2]. 형태적으로는 식도 등의 다른 장기에서 관찰되는 편평세포암종과 유사하다. 샘편평세포암종(adenosquamous carcinoma)은 샘암종과 편평세포암종 성분이 섞여 있는 종양으로, 편평세포암종 성분이 종양의 25% 이상일 경우로 정의된다[2]. 림프절 전이와 간 또는 복막 전이가 흔하여 대개 나쁜 예후를 보인다[2].
미분화암종(undifferentiated carcinoma)은 세포구조학적으로 상피세포 기원이라는 근거 이외에는 특정한 분화를 보이지 않는 역형성 세포로 구성된 암종이다[2]. 횡문근육종모양 세포가 흔히 관찰되며 파골세포양(osteoclast-like) 거대세포나 방추형 종양세포도 관찰될 수 있다. 진단 당시 국소적인 병변을 가지는 환자의 많은 경우에 진단과 수술 직후 광범위한 원격전이가 발생하여 예후가 매우 나쁘다.
포복형샘암종(crawling-type adenocarcinomas)은 종양세포의 핵이 저등급의 이형성을 보이고 불규칙하게 분지 혹은 융합되는 구조가 조직학적 특징인 종양으로 WHO 5판 분류에서 정식 아형으로 분류되어 있지는 않다[2]. 이 암종은 핵의 이형성이 심하지 않고 내강 혹은 틈새 형태를 이루는 구조적 특성으로 인해 예전에는 고분화 샘암종으로 간주되었으나, 크기가 큰 포복형샘암종은 분화가 점막하층 이상으로 침윤을 보이는 경우 저응집암종 성분이 동반되는 경우가 많으며, 림프절 전이가 흔하여 다른 아형에 비해 예후가 안 좋을 수 있다는 것이 밝혀지고 있다[17].
WHO 분류 이외에 내시경 점막하 박리술 검체를 포함한 절제 검체의 경우에는 Lauren 분류를 추가한다. Lauren 분류는 전세계적으로 가장 많이 사용되는 위암의 분류 방법들 중 하나로 샘구조 형성 양상에 따라 장형 위암(intestinal type)과 미만형 위암(diffuse type)으로 나눈다[18]. WHO 제5판 분류에 따르면, 고분화 및 중등도 분화의 관샘암종/유두모양샘암종은 장형으로 분류되며, 반지세포암종을 포함하는 저응집암종은 미만형으로 분류된다(Table 1). Lauren 분류에서 혼합형은 한 종양에서 장형과 미만형의 비율이 비슷할 경우를 의미하며, WHO 조직학적 분류에서 언급한 혼합샘암종과는 정의가 동일하지 않다. WHO 제5판에서 제시된 Lauren 분류 비교 표에서는 저분화 샘암종을 일본 분류법의 por1, Lauren 분류의 불확정형에 해당하는 것으로 표시하고 있지만, 저분화 샘암종이 고형 종양 덩어리 이외에 다양한 형태를 보일 수 있기 때문에 일본 분류의 por2, Lauren 분류의 미만형에 해당하는 유형을 저분화 샘암종으로 분류하는 병리의사도 상당하여 병리의사들 간에 진단 기준에 대해서는 아직 합의가 완전히 이루어져 있지 않다. 이 밖에 특정 아형의 위암들을 Lauren 분류에서 제외하여 ‘정의되지 않음’ (Not defined)으로 진단해야 할 지, 아니면 이들 중 일부는 형태에 따라 장형, 미만형, 또는 불확정형(indeterminate)으로 분류해야 할 지는 추가적인 논의와 연구가 필요하다.
위암에서 내시경 점막하 박리술 치료 적합성 여부를 평가하기 위해, 많은 임상 진료 지침과 연구에서 일본 가이드라인의 분화형(고분화/중등도분화 관샘암종과 유두모양샘암종)과 미분화형(저분화 관샘암종, 저응집암종, 반지세포암종)의 분류 기준을 사용해오고 있다[19]. 하지만 2023년 출간된 위암 병리보고서 기재사항 표준화 2판에서는 WHO 분류상 미분화암종과의 혼동을 방지하기 위해, 병리 진단 보고서에 이러한 ‘분화형/미분화형’ 용어의 사용은 권고하지 않는다[10]. 대신 WHO 5판의 조직학적 분류와 Lauren 분류를 사용하면 내시경 점막하 박리술 치료의 유무 판단에 있어서 임상의사와 연구자들에게 해당 정보를 충분히 제공할 수 있을 것으로 판단한다.
샘암종의 분화도는 주로 관샘암종과 유두모양샘암종에 적용된다[2]. 뚜렷한 샘 구조를 만드는 종양으로 주로 원주형 세포로 구성된 경우 고분화(well differentiated)로, 샘구조가 뚜렷하지만 샘들의 크기가 작고 입방형이나 납작한 세포가 주 구성세포인 경우 중등도 분화(moderately differentiated)로 분류되고, 내강 구조를 거의 형성하지 않을 때는 저분화(poorly differentiated)로 분류된다[20]. 한 종양 내에서 두 가지 혹은 그 이상의 분화가 혼합되어 관찰될 경우, 일반적으로 가장 많은 부위에서 관찰되는 분화도에 따라 등급을 결정한다. WHO 5판 분류에서는 위암을 비롯해 대부분의 소화기암에 대해 저등급(고분화 및 중등도 분화)과 고등급(저분화)의 두 단계의 등급 분류체계를 권장하지만, 대부분의 병리의사와 임상의사들이 세 등급의 분화도 분류체계에 더 익숙하고, 세 등급의 분류체계는 두 등급의 분류체계로 쉽게 전환이 가능한 점을 고려하여, 2023년 출간된 위암 병리보고서 기재사항 표준화 2판에서는 고분화, 중등도 분화, 저분화의 세 등급 분류체계를 사용하는 것을 권장하고 있다[10].
WHO 분류상 위암 조직형의 병리학적 진단 기준은 비교적 잘 정립되어 있어 대부분의 경우 병리진단에서 위암 조직형을 결정하는 데에 큰 문제점은 없는 것으로 생각된다. 그러나 내시경 생검 검체에서 위암의 특정 아형을 진단하는 것은 검체의 특성상 어려울 수 있다. 생검은 전체 종양을 대표할 수 없고, 생검 조직상에서는 일부에 불과하더라도 절제 조직에서는 우세한 조직형이 될 수 있기 때문에, 위암 생검 진단에서는 가급적이면 관찰되는 모든 아형을 기재해 주는 것이 바람직하겠다.
특히 앞서 기술한 바와 같이 위암의 조직학적 아형과 분화도는 환자의 예후를 예측하고 치료방법을 선택하는 데 있어서 중요한 지표가 되기 때문에, 저분화 성분이 생검 조직 내에 포함되어 있거나 저응집암종, 저분화 관샘암종, 미세유두모양 샘암종, 혼합샘암종 등 나쁜 예후와 관련이 있는 것으로 알려진 아형이 포함되어 있는 경우에는 비록 그 비율이 적더라도 나쁜 예후와 관련된 부분을 병리 진단 보고서에 기재하기를 권장한다. 마찬가지로 위바닥샘형샘암종이나 림프구버팀질동반샘암종 등은 유사한 병기의 다른 아형의 위암들과 비교하여 림프절 전이 빈도가 낮은 것으로 알려져 있기 때문에 이런 아형이 의심되는 경우 병리 진단 보고서에 기술하는 것이 환자 치료방침 결정에 도움이 될 수 있겠다.
Fig. 1.
Representative photographs of histological subtypes of gastric carcinoma showing papillary adenocarcinoma (A), poorly cohesive carcinoma, signet-ring cell type (B), poorly cohesive carcinoma, not otherwise specified (C), adenocarcinoma with lymphoid stroma (D) accompanied by EBV-positive cells observed using the in situ hybridization technique (E), hepatoid adenocarcinoma (F) with immunoreactivity for alpha-fetoprotein (G), fundic-gland type adenocarcinoma (H), and undifferentiated carcinoma (I) (H&E, ×200). EBV, Epstein-Barr virus.
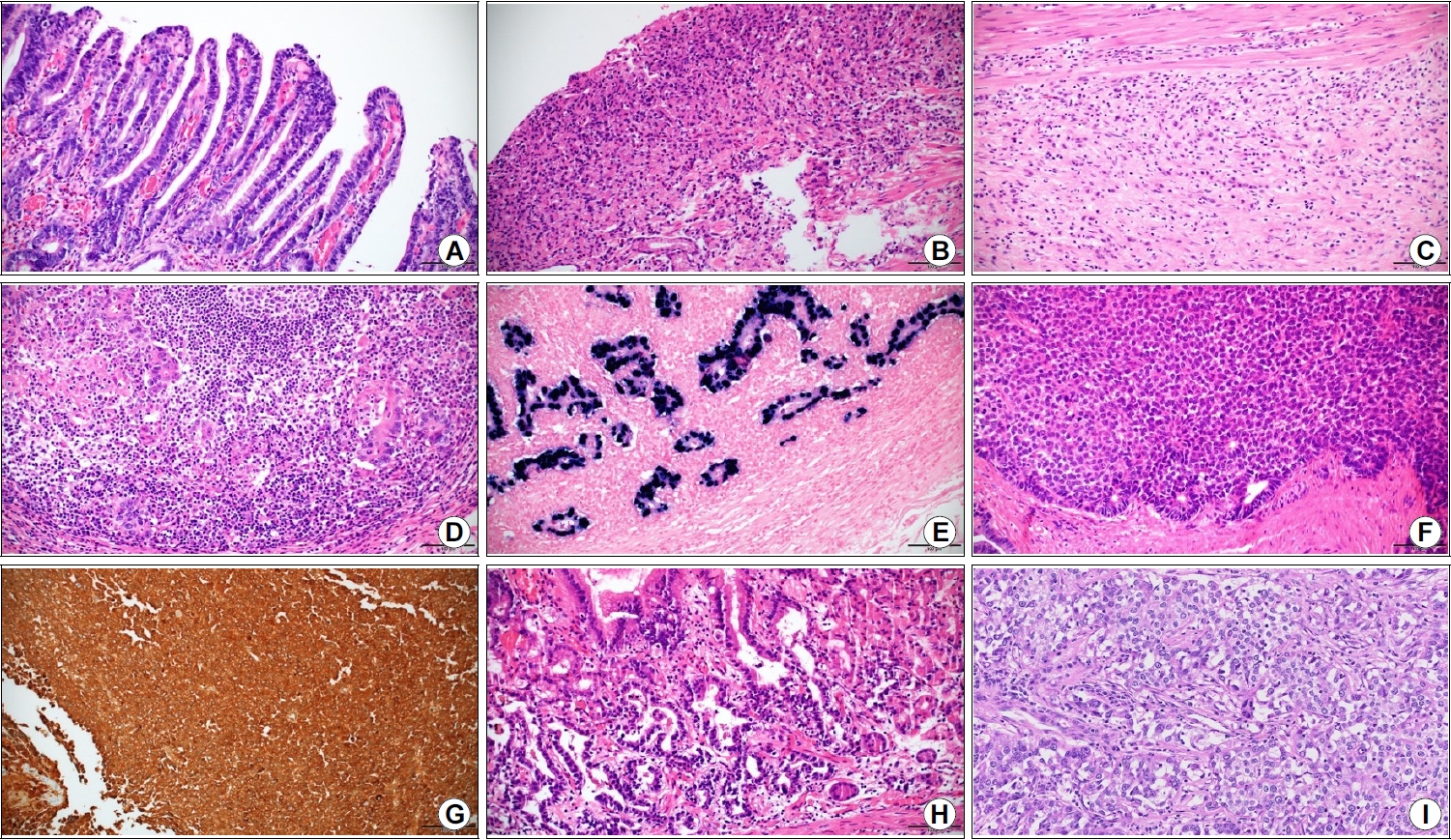
Table 1.
Comparison between the World Health Organization and Lauren Classification of Gastric Cancer
WD, well differentiated; MD, moderately differentiated; PD, poorly differentiated; SRC, signet-ring cell.
Data from World Health Organization (WHO classification of tumours: digestive system tumours; 2019) [2].
REFERENCES
1. Sung H, Ferlay J, Siegel RL, Laversanne M, Soerjomataram I, Jemal A, Bray F. Global cancer statistics 2020: GLOBOCAN estimates of incidence and mortality worldwide for 36 cancers in 185 countries. CA Cancer J Clin 2021;71:209–249.



2. World Health Organization. WHO classification of tumours: digestive system tumours. Geneva: World Health Organization, 2019.
3. Min BH, Byeon SJ, Lee JH, et al. Lymphovascular invasion and lymph node metastasis rates in papillary adenocarcinoma of the stomach: implications for endoscopic resection. Gastric Cancer 2018;21:680–688.



4. Yu H, Fang C, Chen L, et al. Worse prognosis in papillary, compared to tubular, early gastric carcinoma. J Cancer 2017;8:117–123.



5. Mariette C, Carneiro F, Grabsch HI, van der Post RS, Allum W, de Manzoni G.; European Chapter of International Gastric Cancer Association. Consensus on the pathological definition and classification of poorly cohesive gastric carcinoma. Gastric Cancer 2019;22:1–9.



6. Nakamura K, Eto K, Iwagami S, et al. Clinicopathological characteristics and prognosis of poorly cohesive cell subtype of gastric cancer. Int J Clin Oncol 2022;27:512–519.



7. Kwon CH, Kim YK, Lee S, et al. Gastric poorly cohesive carcinoma: a correlative study of mutational signatures and prognostic significance based on histopathological subtypes. Histopathology 2018;72:556–568.



8. Park HK, Lee KY, Yoo MW, Hwang TS, Han HS. Mixed carcinoma as an independent prognostic factor in submucosal invasive gastric carcinoma. J Korean Med Sci 2016;31:866–872.




9. Horiuchi Y, Fujisaki J, Yamamoto N, et al. Undifferentiated-type predominant mixed-type early gastric cancer is a significant risk factor for requiring additional surgeries after endoscopic submucosal dissection. Sci Rep 2020;10:6748.




10. Park YS, Kook MC, Kim BH, et al. A standardized pathology report for gastric cancer: 2nd edition. J Pathol Transl Med 2023;57:1–27.




11. Iwasaki K, Suda T, Takano Y, et al. Postoperative outcomes of gastric carcinoma with lymphoid stroma. World J Surg Oncol 2020;18:102.




12. Xia R, Zhou Y, Wang Y, Yuan J, Ma X. Hepatoid adenocarcinoma of the stomach: current perspectives and new developments. Front Oncol 2021;11:633916.



13. Fujita T, Gotohda N, Kato Y, et al. Clinicopathological features of stomach cancer with invasive micropapillary component. Gastric Cancer 2012;15:179–187.



14. Miyazawa M, Matsuda M, Yano M, et al. Gastric adenocarcinoma of the fundic gland (chief cell-predominant type): a review of endoscopic and clinicopathological features. World J Gastroenterol 2016;22:10523–10531.



15. Ueyama H, Yao T, Nakashima Y, et al. Gastric adenocarcinoma of fundic gland type (chief cell predominant type): proposal for a new entity of gastric adenocarcinoma. Am J Surg Pathol 2010;34:609–619.


16. Benedict MA, Lauwers GY, Jain D. Gastric adenocarcinoma of the fundic gland type: update and literature review. Am J Clin Pathol 2018;149:461–473.

17. Woo HY, Bae YS, Kim JH, et al. Distinct expression profile of key molecules in crawling-type early gastric carcinoma. Gastric Cancer 2017;20:612–619.



18. Lauren P. The two histological main types of gastric carcinoma: diffuse and so-called intestinal-type carcinoma. An attempt at a histo-clinical classification. Acta Pathol Microbiol Scand 1965;64:31–49.

19. Japanese Gastric Cancer Association. Japanese gastric cancer treatment guidelines 2018 (5th edition). Gastric Cancer 2021;24:1–21.




20. Kim WH, Park CK, Kim YB, et al. A standardized pathology report for gastric cancer. Korean J Pathol 2005;39:106–113.
-
METRICS

-
- 0 Crossref
- 1,234 View
- 58 Download
- Related articles in Korean J Helicobacter Up Gastrointest Res
-
History and Pharmacological Mechanism of Gastric Acid-suppressive Drugs2023 September;23(3)
Diffuse-type Gastric Cancer2022 March;22(1)
Proton Pump Inhibitors and Gastric Cancer2021 September;21(3)






