|
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 22(1); 2022 > Article |
|
Abstract
Gastric subepithelial tumors (SETs) are often discovered incidentally and are usually benign. Their subepithelial location complicates accurate diagnosis; however, most lesions can be differentiated using either endoscopy or endoscopic ultrasonography. Gastric SETs location, color, surface change, size, consistency, and movability are evaluated during endoscopy. Endoscopic ultrasound assesses their originating layer, echogenicity, and homogeneity. Common gastric SETs in Koreans include ectopic pancreas, lipoma, leiomyoma, other benign lesions, neuroendocrine tumors, and gastrointestinal stromal tumors with malignant potential. Furthermore, extraluminal compression by normal organs or benign lesions as well as other malignant tumors may have a similar appearance to gastric SET. Understanding the endoscopic and endoscopic ultrasound characteristics of common gastric subepithelial lesions can reduce the rate of unnecessary examinations and excessive treatment. In this article, these characteristics are reviewed through various images that are common in the Korean population.
ņ£äņØś ņāüĒö╝ĒĢś ļ│æļ│Ć(subepithelial lesion)ņØĆ ļ│æļ│ĆņØ┤ ņāüĒö╝(epithelium)ļ│┤ļŗż ĒĢśļČĆņŚÉ ņ£äņ╣śĒĢśĻ│Ā ņŻ╝ņ£äņÖĆ ļÅÖņØ╝ĒĢ£ ņāüĒö╝ļĪ£ ļŹ«ņŚ¼ ņ׳ņ£╝ļ®┤ņä£ ļé┤Ļ░Ģņ£╝ļĪ£ ņ£ĄĻĖ░ļÉ£ ļ│æļ│ĆņØä ņ┤Øņ╣ŁĒĢ£ļŗż. ņāüĒö╝ĒĢś ļ│æļ│Ć ņżæņŚÉ ņ£ä ņĢĢļ░ĢņØä ņĀ£ņÖĖĒĢ£ ļ│æļ│ĆļōżņØä ņ£ä ņāüĒö╝ĒĢś ņóģņ¢æ(subepithelial tumors, SETs)ņØ┤ļØ╝ Ēæ£ĒśäĒĢĀ ņłś ņ׳ļŗż. ņāüĒö╝ĒĢś ņóģņ¢æņØĆ ņĀÉļ¦ēĻĘ╝ņĖĄ(muscularis mucosa)ņŚÉņä£ļČĆĒä░ ĻĘĖ ņĢäļלņ¬ĮņŚÉņä£ ļ░£ņāØĒĢśļŖö ņóģņ¢æņØä ņØ┤ļź┤ļŖöļŹ░, ņĀÉļ¦ēĒĢś ņóģņ¢æ(submucosal tumor)ņ£╝ļĪ£ ļČłļ”¼ĻĖ░ļÅä Ē¢łņ¦Ćļ¦ī ņĀÉļ¦ēĒĢśņĖĄ ņÖĖņŚÉņä£ ļ░£ņāØĒĢśļŖö ņóģņ¢æļōżņØ┤ ļŹö ļ¦ÄņĢä ņāüĒö╝ĒĢś ņóģņ¢æņØ┤ļØ╝ļŖö ņÜ®ņ¢┤Ļ░Ć ļ│┤ļŗż ņĀüņĀłĒĢśļŗż. ĻĄŁļé┤ ņŚ░ĻĄ¼ņŚÉņä£ļŖö 8ļ¦īņŚ¼ ļ¬ģņØś Ļ▓Ćņ¦ä ļé┤ņŗ£Ļ▓Į ĒÖśņ×ÉļōżņØä ļīĆņāüņ£╝ļĪ£ ņĪ░ņé¼ĒĢśņśĆņØä ļĢī ņāüļČĆ ņ£äņןĻ┤Ć ņĀäņ▓┤ņŚÉņä£ ņāüĒö╝ĒĢś ņóģņ¢æņØĆ 1.94%, ņ£ä ņāüĒö╝ĒĢś ņóģņ¢æņØĆ 0.74%ļĪ£ ļ│┤Ļ│ĀĒĢśņśĆļŗż[1]. ņ£ä ņāüĒö╝ĒĢś ņóģņ¢æņØĆ ļ¼┤ņ”ØņāüņØĖ ņāüĒā£ļĪ£ Ļ▓Ćņ¦ä ļé┤ņŗ£Ļ▓Į Ēś╣ņØĆ ļŗżļźĖ ļ¬®ņĀüņ£╝ļĪ£ ņŗ£Ē¢ēĒĢśļŖö Ļ▓Ćņé¼ ņżæņŚÉ ļ░£Ļ▓¼ļÉśļŖö Ļ▓ĮņÜ░Ļ░Ć ļīĆļČĆļČäņØ┤ļ®░, ņØ┤ļĀćĻ▓ī ļ░£Ļ▓¼ļÉ£ ņāüĒö╝ĒĢś ņóģņ¢æņØĆ ļīĆļČĆļČä ņ¢æņä▒ ļ│æļ│ĆņØ┤Ļ│Ā ņØ╝ļČĆņŚÉņä£ ņ£äņןĻ┤ĆĻ░äņ¦ł ņóģņ¢æ(gastrointestinal stromal tumor, GIST), ņŗĀĻ▓Įļé┤ļČäļ╣ä ņóģņ¢æ(neuroendocrine tumor, NET), ļ”╝Ēöäņóģ(lymphoma), ņĀÉļ¦ēĒĢś ņóģņ¢æ ņ£Āņé¼ ņ£äņĢö(SET like adenocarcinoma)Ļ│╝ Ļ░ÖņØĆ ņĢģņä▒ ļ│æļ│ĆņØ┤ ļ░£Ļ▓¼ļÉĀ ņłś ņ׳ļŗż[2]. ņ£ä ņāüĒö╝ĒĢś ņóģņ¢æņØś ņ×ÉņŚ░Ļ▓ĮĻ│╝ļŖö ļ¬ģĒÖĢĒĢśĻ▓ī ņĢīļĀżņĀĖ ņ׳ņ¦Ć ņĢŖņ¦Ćļ¦ī, ĻĄŁļé┤ ņŚ░ĻĄ¼ņŚÉ ņØśĒĢśļ®┤ ļīĆļČĆļČä 10 mm ļ»Ėļ¦īņØś Ēü¼ĻĖ░ņØ┤Ļ│Ā ņØ┤ņżæņŚÉņä£ 3.6~8.5%ņØś ĒÖśņ×ÉņŚÉņä£ Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ ņżæņŚÉ Ēü¼ĻĖ░ ļ│ĆĒÖöļź╝ ļ│┤ņśĆļŗż[1,3,4]. ĒĢśņ¦Ćļ¦ī ņ£ä ņāüĒö╝ĒĢś ņóģņ¢æņØĆ ņĀĢņāü ņāüĒö╝ ņĢäļלņŚÉ ņ£äņ╣śĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ņĀĢņāüņĀÉļ¦ēņ£╝ļĪ£ ļŹ«ņØĖ ņ£ĄĻĖ░ņä▒ ļ│æļ│Ćņ£╝ļĪ£ ļīĆļČĆļČä ļ░£Ļ▓¼ļÉśĻ│Ā, ņāüĒö╝ ņĢäļלņŚÉ ņ£äņ╣śĒĢ©ņ£╝ļĪ£ ĒĢ┤ņä£ ļé┤ņŗ£Ļ▓Į Ļ▓Ėņ×É ņāØĻ▓Ćļ¦īņ£╝ļĪ£ļŖö ņĪ░ņ¦üņØś ņ¦äļŗ©ņØ┤ ņ¢┤ļĀżņøī ņ¦äļŗ© ļé┤ņŗ£Ļ▓Įļ¦īņ£╝ļĪ£ļŖö Ļ░Éļ│äņ¦äļŗ©ņŚÉ ņ¢┤ļĀżņøĆņØ┤ ņ׳ļŗż. ļ│Ė ņóģņäżņŚÉņä£ļŖö ĒĢ£ĻĄŁņØĖņŚÉņä£ ĒØöĒĢ£ ņ£ä ņāüĒö╝ĒĢś ņóģņ¢æņØś ņ¦äļŗ©ņØä ļŗżņ¢æĒĢ£ ļé┤ņŗ£Ļ▓Į ņé¼ņ¦äļōżĻ│╝ ĒĢ©Ļ╗ś Ļ▓ĆĒåĀĒĢ┤ ļ│┤Ļ▓Āļŗż.
ņ£ä ņāüĒö╝ĒĢś ņóģņ¢æņØĆ ņŻ╝ņ£ä ņĀÉļ¦ēĻ│╝ ļÅÖņØ╝ĒĢ£ ņĀÉļ¦ēņ£╝ļĪ£ ļŹ«ņŚ¼ ņ£ĄĻĖ░ļź╝ ņØ┤ļŻ©ļŖö ĒśĢĒā£ļĪ£ ņØ╝ļ░śņĀüņ£╝ļĪ£ ļé┤ņŗ£Ļ▓Į ņ£ĪņĢł ņé¼ņ¦äļ¦īņ£╝ļĪ£ļŖö Ļ░Éļ│ä ņ¦äļŗ©ņØ┤ ņ¢┤ļĀżņÜ░ļéś ņŚ¼ļ¤¼ ļé┤ņŗ£Ļ▓Į ņåīĻ▓¼ņØä ĻĖ░ņ┤łļĪ£ ĒÖśņ×ÉņØś Ē¢źĒøä ņ▓śņ╣ś Ļ│äĒÜŹņØä ņĀĢĒĢśļŖö ļŹ░ ļÅäņøĆņØä ļ░øņØä ņłś ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ļ®┤ļ░ĆĒĢ£ Ļ┤Ćņ░░ņØ┤ ĒĢäņÜöĒĢśļŗż. ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ņŚÉņä£ ņāüĒö╝ĒĢś ņóģņ¢æņØä Ļ┤Ćņ░░ĒĢĀ ļĢīļŖö ĻĖ░ļ│ĖņĀüņ£╝ļĪ£ ņ£äņ╣ś, ņāēņĪ░, Ēü¼ĻĖ░, Ēæ£ļ®┤ņØś ļ│ĆĒÖö, ļŗ©ļŗ©ĒĢ£ ņĀĢļÅä, ņØ┤ļÅÖņä▒ņØä ĒÅēĻ░ĆĒĢ£ļŗż.
ņāüĒö╝ĒĢś ņóģņ¢æņØĆ ņ£äņØś ņ¢┤ļööņŚÉņä£ļōĀ ļ░£ņāØĒĢĀ ņłś ņ׳ņ£╝ļéś ņāüĒö╝ĒĢś ņóģņ¢æņØś ņóģļźśņŚÉ ļö░ļØ╝ ĒśĖļ░£ĒĢśļŖö ļČĆņ£äĻ░Ć ņ׳ļŗż. ņ£äņןĻ┤ĆĻ░äņ¦ł ņóģņ¢æ, ĒÅēĒÖ£ĻĘ╝ņóģņØĆ ĻČüļźŁļČĆ, ļČäļ¼ĖļČĆļź╝ ĒżĒĢ©ĒĢ£ ņāüļČĆ ņ▓┤ļČĆņŚÉ ņŻ╝ļĪ£ ļ░£ņāØĒĢśļ®░, ĻĘĖņżæņŚÉņä£ļÅä ĒÅēĒÖ£ĻĘ╝ņóģņØĆ ļČäļ¼ĖļČĆņŚÉ Ļ░Ćņן ĒśĖļ░£ĒĢ£ļŗż. ņĀäņĀĢļČĆņŚÉņä£ļŖö ņØ┤ņåīņä▒ ņĘīņן, ņ¦Ćļ░®ņóģ, ņŚ╝ņ”Øņä▒ ņä¼ņ£Āņ¢æ ņÜ®ņóģ(inflammatory fibrinoid polyp)ņØ┤ ĒśĖļ░£ĒĢ£ļŗż[5]. ņŗĀĻ▓Įļé┤ļČäļ╣ä ņóģņ¢æņØś Ļ▓ĮņÜ░ 1ĒśĢņØĆ ņ£äņČĢņä▒ ņ£äņŚ╝ņØś ļČäĒżņÖĆ ļ╣äņŖĘĒĢśĻ▓ī ņ▓┤ļČĆ ņåīļ¦īņŚÉ ĒśĖļ░£ĒĢśļ®░ 3ĒśĢņØĆ ņ£äņØś ņ¢┤ļŖÉ ļČĆņ£äņŚÉņä£ļéś ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż[6]. ņÖĖļČĆ ņĢĢļ░Ģ ņŚŁņŗ£ ņןĻĖ░ņØś ņ£äņ╣śņŚÉ ļö░ļØ╝ ņČöņĀĢĒĢĀ ņłś ņ׳ļŖöļŹ░ Ļ░äņ£╝ļĪ£ ņØĖĒĢ£ ņĢĢļ░ĢņØĆ ņ▓┤ļČĆ ņĀäļ▓ĮĻ│╝ ņåīļ¦īņ£╝ļĪ£, ņĘīņןĻ│╝ ļ╣äņןņØś ņĢĢļ░ĢņØĆ ņ▓┤ļČĆ Ēøäļ▓ĮĻ│╝ ļīĆļ¦īņ£╝ļĪ£ Ļ┤Ćņ░░ļÉśļ®░ ļŗ┤ļéŁņØĆ ĒÖĢņןļÉśļ®┤ ņĀäņĀĢļČĆ ņĀäļ▓Įņ£╝ļĪ£ ņĢĢļ░ĢņØ┤ Ļ┤Ćņ░░ļÉ£ļŗż(Fig. 1).
ņāüĒö╝ĒĢś ņóģņ¢æņØĆ ņŻ╝ļ│ĆĻ│╝ ļÅÖņØ╝ĒĢ£ ņāüĒö╝ļĪ£ ļŹ«ņŚ¼ ņ׳ņ¢┤ ļīĆļČĆļČä ņāēņĪ░ņØś ņ░©ņØ┤Ļ░Ć ņŚåļŗż(Fig. 2A). ĒĢśņ¦Ćļ¦ī ņØ╝ļČĆ ņāüĒö╝ĒĢś ņóģņ¢æņØĆ ņāēņĪ░ņØś ņ░©ņØ┤ļź╝ ļ│┤ņŚ¼ Ļ░Éļ│ä ņ¦äļŗ©ņŚÉ ļÅäņøĆņØ┤ ļÉĀ ņłś ņ׳ļŗż. ļīĆĒæ£ņĀüņ£╝ļĪ£ ņ¦Ćļ░®ņóģņØ┤ ĒÖ®ņāēņĪ░ļź╝ ļ│┤ņØ┤ļ®░(Fig. 2B) ņ¦Ćļ░®ņóģ ņÖĖņŚÉļÅä Ļ│╝ļ”ĮņäĖĒżņóģ(granular cell tumor)ņØ┤ļéś ņŗĀĻ▓Įļé┤ļČäļ╣ä ņóģņ¢æļÅä ĒÖ®ņāēņĪ░ļź╝ ļ│┤ņØ╝ ņłś ņ׳ļŗż. ļŗ©ņł£ļéŁņóģ(cyst), ņżæļ│ĄļéŁņóģ(duplication cyst), ļ”╝ĒöäĻ┤Ćņóģ(lymphangioma), ņŗ¼ņ×¼ņä▒ ļéŁņóģņä▒ ņ£äņŚ╝(gastritis cystica profunda) Ļ░ÖņØĆ ļéŁņä▒ ļ│æļ│ĆļōżņØĆ Ēł¼ļ¬ģĒĢśĻ▓ī ļ│┤ņØ┤ļ®░(Fig. 2C) ņĀĢļ¦źļźśļéś ĒśłĻ┤ĆņóģņØĆ Ēł¼ļ¬ģĒĢ£ ņ▓Łņāēņ£╝ļĪ£ Ļ┤Ćņ░░ļÉĀ ņłś ņ׳ļŗż(Fig. 2D).
ņāüĒö╝ĒĢś ņóģņ¢æņØĆ ņāüĒö╝ļ│┤ļŗż ņĢäļלņŚÉņä£ ļ░£ņāØĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ Ļ░æņ×æņŖżļ¤¼ņÜ┤ Ēü¼ĻĖ░ ņ”ØĻ░Ćļéś ņāüĒö╝ ļ░öļĪ£ ņĢäļלņØś ņĀÉļ¦ē ĻĘ╝ņĖĄņŚÉņä£ ļ░£ņāØĒĢśņŚ¼ ņāüĒö╝ņŚÉ ņśüĒ¢źņØä ņŻ╝ļŖö Ļ▓ĮņÜ░Ļ░Ć ņĢäļŗłļ®┤ Ēæ£ļ®┤ņØś ļ│ĆĒÖöĻ░Ć ņŚåļŗż. ĒĢśņ¦Ćļ¦ī ņØ╝ļČĆņŚÉņä£ Ēæ£ļ®┤ņØś ļ│ĆĒÖöļź╝ ļ│┤ņØ╝ ņłś ņ׳Ļ│Ā ņØ┤ļŖö ņāüĒö╝ĒĢś ņóģņ¢æņØś Ļ░Éļ│ä ņ¦äļŗ©ņŚÉ ļÅäņøĆņØ┤ ļÉĀ ņłś ņ׳ļŗż. ļīĆĒæ£ņĀüņ£╝ļĪ£ ņØ┤ņåīņä▒ ņĘīņןņØś Ļ▓ĮņÜ░ Ēæ£ļ®┤ņŚÉ Ļ░£ĻĄ¼ļČĆ(opening)ļéś ĒĢ©ļ¬░(umbilication, dimpling)ņØ┤ ļÅÖļ░śļÉśņ¢┤ ņ¦äļŗ©ņŚÉ Ēü░ ļÅäņøĆņØ┤ ļÉ£ļŗż(Fig. 2E, F). ņŚ╝ņ”Øņä▒ ņä¼ņ£Āņ¢æ ņÜ®ņóģņØ┤ļéś ņŗ¼ņ×¼ņä▒ ļéŁņóģņä▒ ņ£äņŚ╝ņØś Ļ▓ĮņÜ░ ļ░£ņāØ ĻĖ░ņĀäņØ┤ ļ¦īņä▒ ņ×ÉĻĘ╣Ļ│╝ Ļ┤ĆļĀ©ņØ┤ ņ׳ņ¢┤ Ēæ£ļ®┤ņØś ļ│ĆĒÖöĻ░Ć ļÅÖļ░śļÉ£ Ļ▓ĮņÜ░Ļ░Ć ĒØöĒĢśļŗż(Fig. 2G, H) [7,8]. Ēæ£ļ®┤ņŚÉ ļ░£ņĀüņØ┤ļéś ĻČżņ¢æ Ļ░ÖņØĆ Ļ╣ŖņØĆ ļ│ĆĒÖöĻ░Ć ļ│┤ņØ┤ļŖö Ļ▓ĮņÜ░ ņŗĀĻ▓Įļé┤ļČäļ╣ä ņóģņ¢æ(Fig. 2I)ņØ┤ļéś ņ£äņןĻ┤ĆĻ░äņ¦ł ņóģņ¢æ(Fig. 2J) Ļ░ÖņØĆ ņĢģņä▒ņØś Ļ░ĆļŖźņä▒ņØä Ļ░Ćņ¦ĆļŖö ņāüĒö╝ĒĢś ņóģņ¢æņØś Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŗż. ņāüĒö╝ĒĢś ņóģņ¢æņŚÉņä£ Ēæ£ļ®┤ņØś ļ│ĆĒÖöĻ░Ć ļ│┤ņØ┤ļŖö Ļ▓ĮņÜ░ ņĢģņä▒ņØś Ļ░ĆļŖźņä▒ļÅä ņ׳Ļ│Ā ļé┤ņŗ£Ļ▓Į Ļ▓Ėņ×É ņāØĻ▓ĆņŚÉņä£ ņĪ░ņ¦üĒĢÖņĀüņØĖ ņ¦äļŗ©ņØ┤ ļÉĀ Ļ░ĆļŖźņä▒ņØ┤ ņ׳ņ¢┤ ļéŁņóģņØ┤ļéś ĒśłĻ┤ĆņØ┤ ņØśņŗ¼ļÉśņ¦Ć ņĢŖņ£╝ļ®┤ ļŗ©ņł£ ļé┤ņŗ£Ļ▓Į ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢ£ļŗż.
ņāüĒö╝ĒĢś ņóģņ¢æņØś Ēü¼ĻĖ░ļŖö ņ╣śļŻī ļ░®ņ╣© Ļ▓░ņĀĢņØ┤ļéś ņČöĻ░Ć Ļ▓Ćņé¼ļéś ņČöņĀü ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ ņŗ£ĻĖ░ļź╝ Ļ▓░ņĀĢĒĢśļŖö ļŹ░ ļ¦żņÜ░ ņżæņÜöĒĢ£ ņÜöņåīņØ┤ļŗż. ņāüĒö╝ĒĢś ņóģņ¢æņØĆ ņāüĒö╝ ņåŹņŚÉ ļ¦żļ¬░ļÉśņ¢┤ ņ׳Ļ│Ā ļ│æļ│ĆĻ│╝ ļé┤ņŗ£Ļ▓ĮņØś Ļ▒░ļ”¼ņÖĆ Ļ░üļÅäņŚÉ ļö░ļØ╝ Ēü¼ĻĖ░Ļ░Ć ļŗżļź┤Ļ▓ī ļ│┤ņŚ¼ ņ£ĪņĢłņĀü Ēü¼ĻĖ░ ņĖĪņĀĢņØĆ ļČĆņĀĢĒÖĢĒĢśļŗż. ĒĢśņ¦Ćļ¦ī ņāØĻ▓Ć Ļ▓Ėņ×Éļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ Ēü¼ĻĖ░ļź╝ ņ£ĀņČöĒĢĀ ņłś ņ׳ļŗż. ņĀ£ĒÆłņŚÉ ļö░ļØ╝ ļŗżļź┤Ļ▓Āņ¦Ćļ¦ī ņāØĻ▓Ć Ļ▓Ėņ×ÉļŖö ļŗ½ņĢśņØä ļĢīļŖö ļīĆļץ 2 mm, ņĄ£ļīĆĒĢ£ ņŚ┤ņŚłņØä ļĢīļŖö ņĀ£ĒÆłļ¦łļŗż ļŗżļź┤ļéś 5~7 mm ņĀĢļÅäņØś Ēü¼ĻĖ░ņØ┤ļŗż(Fig. 3A, B). ĒĢ£ ņĀäĒ¢źņĀü ņŚ░ĻĄ¼ņŚÉņä£ ņāØĻ▓Ć Ļ▓Ėņ×Éļź╝ ļ▓īļĀĖņØä ļĢī Ēü¼ĻĖ░ņÖĆ ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīļĪ£ ņĖĪņĀĢĒĢ£ Ēü¼ĻĖ░ļź╝ ļ╣äĻĄÉĒĢśņśĆņØä ļĢī Ļ░ĢĒĢ£ ņāüĻ┤ĆĻ┤ĆĻ│ä(r=0.88)ļź╝ ļ│┤ņśĆļŗż[9]. ņāüĒö╝ĒĢś ņóģņ¢æņØ┤ ļČäļ¼ĖļČĆļéś ņ▓┤ļČĆ ņåīļ¦īņŚÉ ņ£äņ╣śĒĢĀ Ļ▓ĮņÜ░ ļé┤ņŗ£Ļ▓ĮņØä ļ░śņĀäĒĢśņŚ¼ ļé┤ņŗ£Ļ▓ĮņØś ņ¦üĻ▓ĮņØ┤ļéś ļé┤ņŗ£Ļ▓Į ņ×Éņ▓┤ņŚÉ Ēæ£ņŗ£ļÉśņ¢┤ ņ׳ļŖö ļłłĻĖłņ£╝ļĪ£ Ēü¼ĻĖ░ļź╝ Ļ░ĆļŖĀĒĢ┤ ļ│╝ ņłś ņ׳Ļ▓Āļŗż(Fig. 3C, D). ĒĢśņ¦Ćļ¦ī Ēü¼ĻĖ░Ļ░Ć 20 mm ņØ┤ņāüņØ┤Ļ▒░ļéś ņ£äņןĻ┤ĆĻ░äņ¦ł ņóģņ¢æņØ┤ļéś ņŗĀĻ▓Įļé┤ļČäļ╣ä ņóģņ¢æ Ļ░ÖņØĆ ņĢģņä▒ņØś Ļ░ĆļŖźņä▒ņØ┤ ņ׳ļŖö ļ│æļ│ĆņØ┤ ņØśņŗ¼ļÉĀ ļĢīļŖö ļ│ĄļČĆ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśüņØ┤ļéś ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīļź╝ ņØ┤ņÜ®ĒĢ£ ņĀĢĒÖĢĒĢ£ Ēü¼ĻĖ░ ņĖĪņĀĢņØ┤ ĒĢäņÜöĒĢśļŗż. 20 mm ļ»Ėļ¦īņØś ņĀĢņāüņĀÉļ¦ēņ£╝ļĪ£ ļŹ«ĒśĆ ņ׳ļŖö ņ£ä ņāüĒö╝ĒĢś ņóģņ¢æņØĆ ņŻ╝ĻĖ░ņĀüņØĖ ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ ļśÉļŖö ņ┤łņØīĒīīļé┤ņŗ£Ļ▓ĮņØä Ļ▓Ćņé¼ļź╝ ĒåĄĒĢ┤ņä£ ņ╣śļŻī ļ░®Ē¢źņØä Ļ▓░ņĀĢĒĢĀ ņłś ņ׳ņ£╝ļéś, Ēü¼ĻĖ░Ļ░Ć 20 mm ņØ┤ņāüņØ┤Ļ▒░ļéś Ēü¼ĻĖ░Ļ░Ć ņ×æļŹöļØ╝ļÅä ņĢģņä▒ņØ┤ ņØśņŗ¼ļÉśļŖö ļ│ĆĒÖöĻ░Ć ņ׳ļŖö Ļ▓ĮņÜ░(Ēü¼ĻĖ░ ņ”ØĻ░Ć, Ēæ£ļ®┤ņØś ļ░£ņĀü, Ēæ£ļ®┤ņØś ĻČżņ¢æ)ņŚÉļŖö ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīī ņ£ĀļÅäĒĢś ņäĖņ╣© ņāØĻ▓ĆņØ┤ļéś ņĀÉļ¦ē ņĀłĻ░£ņłĀ Ļ░ÖņØĆ ļ░®ļ▓ĢņØä ņØ┤ņÜ®ĒĢśņŚ¼ ņĀüĻĘ╣ņĀüņØĖ ņĪ░ņ¦ü Ļ▓Ćņé¼Ļ░Ć ĻČīĻ│ĀļÉ£ļŗż[10,11]. ņĢģņä▒ņØś Ļ░ĆļŖźņä▒ņØ┤ ļåÆĻ▒░ļéś ņČöņĀü Ļ▓Ćņé¼ ņżæņŚÉ Ēü¼ĻĖ░ ņ”ØĻ░ĆĻ░Ć ļ│┤ņØ┤ļ®┤ ņĀüĻĘ╣ņĀüņØĖ ņĀłņĀ£ņłĀņØä Ļ│ĀļĀżĒĢ£ļŗż.
ņāØĻ▓Ć Ļ▓Ėņ×Éļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņāüĒö╝ĒĢś ņóģņ¢æņØä ļłīļ¤¼ ļö▒ļö▒ĒĢ£ ņĀĢļÅä ļ░Å ņØ┤ļÅÖņä▒ņØä ĒÅēĻ░ĆĒĢĀ ņłś ņ׳ļŗż. ļīĆĒæ£ņĀüņ£╝ļĪ£ ņāüĒö╝ĒĢś ņóģņ¢æņØä ļłīļĀĆņØä ļĢī ļ¬©ņ¢æņØ┤ ņēĮĻ▓ī ļ│ĆĒśĢļÉśņ¢┤ ĒĢ©ļ¬░ļÉśļŖö Ļ▓ĮņÜ░(pillow sign Ēś╣ņØĆ cushion sign)ņŚÉļŖö ņ¦Ćļ░®, ņĢĪņ▓┤, ļ”╝ĒöäņĢĪĻ│╝ Ļ░ÖņØĆ ļČĆļō£ļ¤¼ņÜ┤ ņä▒ņāüņØś ļ¼╝ņ¦łļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ļŗżĻ│Ā ĒīÉļŗ©ĒĢĀ ņłś ņ׳ņ£╝ļ®░ ņ¦Ćļ░®ņóģ, ņżæļ│Ą ļéŁņóģ, ņŗ¼ņ×¼ņä▒ ļéŁņóģņä▒ ņ£äņŚ╝, ļ”╝ĒöäĻ┤Ćņóģ ļō▒ņŚÉņä£ Ļ┤Ćņ░░ļÉ£ļŗż(Fig. 3E). ļ░śļ®┤ ņāØĻ▓Ć Ļ▓Ėņ×ÉļĪ£ ļłīļĀĆņØä ļĢī ļŗ©ļŗ©ĒĢśņŚ¼ ĒĢ©ļ¬░ļÉśņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░ņŚÉļŖö ļīĆņŗĀ ļ░ĆņŚłņØä ļĢī ņøĆņ¦üņØ┤ļŖö ņåīĻ▓¼(rolling sign)ņ£╝ļĪ£ Ļ░ĆļÅÖņä▒ņØä ĒÅēĻ░ĆĒĢĀ ņłś ņ׳Ļ│Ā rolling signņØ┤ ņ¢æņä▒ņØ┤ļ®┤ ņóģņ¢æņØ┤ ņĀÉļ¦ēĻĘ╝ņĖĄņØ┤ļéś ņĀÉļ¦ēĒĢśņĖĄņŚÉ ņ£äņ╣śĒĢ©ņØä ņØśļ»ĖĒĢ£ļŗż(Fig. 3F). ĒĢśņ¦Ćļ¦ī rolling signņØĆ ņāüĒö╝ĒĢś ņóģņ¢æņØĆ Ļ│ĀņĀĢļÉśņ¢┤ ņ׳Ļ│Ā Ēæ£ļ®┤ņØś ņĀÉļ¦ēļ¦ī ņøĆņ¦üņØ┤ļŖö Ļ▓ĮņÜ░ņÖĆ Ēś╝ļÅÖļÉśĻĖ░ ņēĮĻ│Ā ņóģņ¢æņØ┤ Ļ│Āņ£ĀĻĘ╝ņĖĄņŚÉ ļäōĻ▓ī ļČĆņ░®ļÉ£ Ļ▓ĮņÜ░ņŚÉļÅä ņØīņä▒ņØ┤ļŗż. ņāØĻ▓Ć Ļ▓Ėņ×ÉļĪ£ ņāüĒö╝ ļČĆļČäņØä ņ×ĪņĢä ņś¼ļĀĖņØä ļĢī ņāüĒö╝ļ¦ī ļōżņ¢┤ ņś¼ļĀżņ¦Ćļ®░ ņóģņ¢æĻ│╝ ļČäļ”¼ļÉśļŖö ņåīĻ▓¼(tenting sing)ļÅä ņāüĒö╝ĒĢś ņóģņ¢æņØ┤ ņĀÉļ¦ēĻĘ╝ņĖĄņØ┤ļéś ĻĘĖ ņĢäļלņĖĄņŚÉ ņ£äņ╣śĒĢ©ņØä ņØśļ»ĖĒĢ£ļŗż(Fig. 3G). ĒĢśņ¦Ćļ¦ī tenting signņØĆ ņāüĒö╝ĒĢś ņóģņ¢æņŚÉ ņä¼ņ£ĀĒÖöĻ░Ć ņ׳Ļ▒░ļéś Ēü¼ĻĖ░Ļ░Ć ņ”ØĻ░ĆĒĢśņŚ¼ ņāüĒö╝Ļ╣īņ¦Ć ņ╣©ļ▓öĒĢśļŖö Ļ▓ĮņÜ░ņŚÉļŖö ņØīņä▒ņØ┤ļŗż.
ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīī Ļ▓Ćņé¼ļŖö ņÖĖļČĆ ņĢĢļ░Ģ ļ│æļ│ĆĻ│╝ ņāüĒö╝ĒĢś ņóģņ¢æņØś Ļ░Éļ│äņØś ņĀĢĒÖĢļÅäĻ░Ć 90% ņØ┤ņāüņØ┤Ļ│Ā ļ░£ņāØ ņĖĄĻ│╝ ņŚÉņĮö ņ¢æņāüņØś Ļ░Éļ│äņØś ņĀĢĒÖĢļÅäļŖö 80% ņĀĢļÅäļĪ£ ļ╣äĻĄÉņĀü ļåÆļŗż[9,12]. ĻĘĖļ¤¼ļéś ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīļŖö Ļ┤Ćņ░░ņ×É Ļ░äņØś ņ¦äļŗ© ņØ╝ņ╣śļÅäĻ░Ć ļé«Ļ│Ā, ĒŖ╣Ē׳ ņĀÉļ¦ēĒĢśņĖĄĻ│╝ Ļ│Āņ£ĀĻĘ╝ņĖĄņŚÉ ņ£äņ╣śĒĢśļŖö ņĀĆņŚÉņĮöņä▒ ļ│æļ│ĆņŚÉņä£ļŖö ļ│æļ”¼ĒĢÖņĀü ņ¦äļŗ©Ļ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ņĀĢĒÖĢļÅäĻ░Ć 43% ņĀĢļÅäļĪ£ ļŹöņÜ▒ ļé«ņØĆ Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[9,13].
ņ£ä ļ▓ĮņØś ņĖĄņŚÉ ļö░ļØ╝ ļ╣łļ░£ĒĢśļŖö ņāüĒö╝ĒĢś ņóģņ¢æņØ┤ ļŗ¼ļØ╝ ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīļź╝ ņØ┤ņÜ®ĒĢśņŚ¼ ņ¢┤ļŖÉ ņĖĄņŚÉņä£ ņóģņ¢æņØ┤ ļ░£ņāØĒĢśņśĆļŖöņ¦Ćļź╝ ĒÖĢņØĖĒĢśļ®┤ Ļ░Éļ│ä ņ¦äļŗ©ņØś ļ▓öņ£äļź╝ ņóüĒ×É ņłś ņ׳ļŗż. ĒĢśņ¦Ćļ¦ī ĒśĖļ░£ĒĢśļŖö ņĖĄņØ┤ņ¦Ć ņĀłļīĆņĀüņ£╝ļĪ£ ļ░£ņāØĒĢśļŖö ņĖĄņØĆ ņĢäļŗłļ®░ ņóģņ¢æņØś ņä▒ņןņŚÉ ļö░ļØ╝ ņŚ¼ļ¤¼ ņĖĄņØä ĒĢ©Ļ╗ś ņ╣©ļ▓öĒĢśļŖö Ļ▓ĮņÜ░ļÅä ņ׳ņ¢┤ ņŻ╝ņØśĒĢ┤ņĢ╝ ĒĢ£ļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīņŚÉņä£ ņ£äļ▓ĮņØĆ 5Ļ░£ ņĖĄņ£╝ļĪ£ Ļ┤Ćņ░░ļÉśļŖöļŹ░ ļæÉ ļ▓łņ¦Ė ņĖĄņØĖ ņĀĆņŚÉņĮöņØś ņĀÉļ¦ēĻĘ╝ņĖĄņŚÉ ņ£äņ╣śĒĢśļŖö ņāüĒö╝ĒĢś ņóģņ¢æņŚÉļŖö ņŗĀĻ▓Įļé┤ļČäļ╣ä ņóģņ¢æ, ņŚ╝ņ”Øņä▒ ņä¼ņ£Āņ¢æ ņÜ®ņóģ, ļ”╝ĒöäĻ┤Ćņóģ, ļéŁņóģņä▒ ļ│æļ│ĆļōżņØ┤ ņ׳ļŗż. ņäĖ ļ▓łņ¦Ė ņĖĄņØĖ Ļ│ĀņŚÉņĮöņØś ņĀÉļ¦ēĒĢśņĖĄņŚÉ ņŻ╝ļĪ£ ņ£äņ╣śĒĢśļŖö ņāüĒö╝ĒĢś ņóģņ¢æņŚÉļŖö ņ¦Ćļ░®ņóģ, ņØ┤ņåīņä▒ ņĘīņןņØ┤ ļīĆĒæ£ņĀüņØ┤ļ®░ ņŗĀĻ▓Įļé┤ļČäļ╣ä ņóģņ¢æ, ņŚ╝ņ”Øņä▒ ņä¼ņ£Āņ¢æ ņÜ®ņóģ, ļéŁņóģņä▒ ļ│æļ│ĆļōżņØĆ 2ņĖĄĻ│╝ 3ņĖĄ ļæś ļŗżņŚÉ ņ£äņ╣śĒĢĀ ņłś ņ׳ļŗż. ņŗĀĻ▓Įļé┤ļČäļ╣ä ņóģņ¢æņØĆ ņŻ╝ļĪ£ ņĀÉļ¦ēĒĢśņĖĄņŚÉņä£ ĻĖ░ņøÉĒĢśņŚ¼ ņĀÉļ¦ēĻĘ╝ņĖĄņ£╝ļĪ£ ņ╣©ļ▓öĒĢśļŖö ĒśĢĒā£ņØ┤ļŗż. ļäż ļ▓łņ¦Ė ņĖĄņØĖ ņĀĆņŚÉņĮöņØś Ļ│Āņ£Ā ĻĘ╝ņĖĄņŚÉ ņ£äņ╣śĒĢśļŖö ņāüĒö╝ĒĢś ņóģņ¢æņŚÉļŖö ĒÅēĒÖ£ĻĘ╝ņóģ, ņ£äņןĻ┤ĆĻ░äņ¦ł ņóģņ¢æ, ņŗĀĻ▓Įņ┤łņóģ(schwanomma) ļō▒ņØś Ļ░Éļ│äņØ┤ ĒĢäņÜöĒĢśļŗż. ņØ┤ņåīņä▒ ņĘīņןņØĆ ņĀÉļ¦ēĒĢśņĖĄņŚÉ ņŻ╝ļĪ£ ņ£äņ╣śĒĢśņ¦Ćļ¦ī 2, 3, 4ņĖĄ ļ¬©ļæÉņŚÉ ņ£äņ╣śĒĢĀ ņłś ņ׳ļŗż(Table 1).
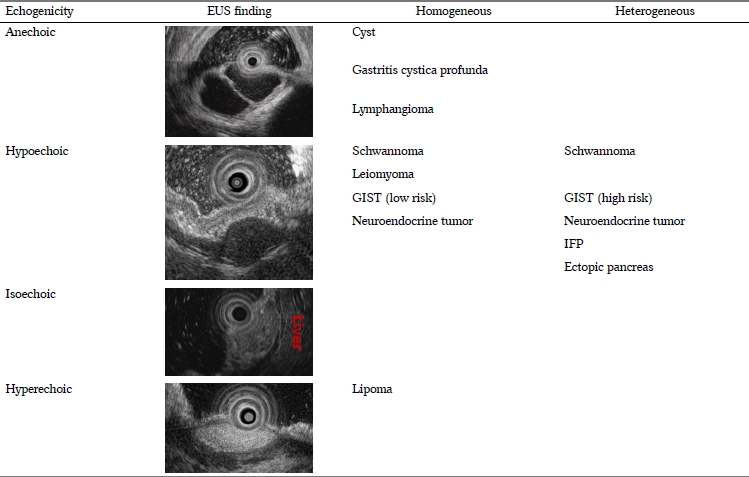
ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīņŚÉņä£ ņŚÉņĮöņØś ļ░śĒ¢ź ņĀĢļÅäļŖö ļ¼┤ņŚÉņĮö(anechoic), ņĀĆņŚÉņĮö(hypoechoic), ļÅÖļō▒ņŚÉņĮö(isoechoic), Ļ│ĀņŚÉņĮö(hyperechoic)ļĪ£ ļéśļłäņ¢┤ ĒÅēĻ░ĆĒĢĀ ņłś ņ׳ļŗż. ļ¼╝ ņä▒ļČäņØ┤ ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīņŚÉņä£ ļ¼┤ņŚÉņĮöļĪ£ Ļ┤Ćņ░░ļÉśļ®░, ņĀĆņŚÉņĮöļŖö Ļ│Āņ£ĀĻĘ╝ņĖĄ, ļÅÖļō▒ņŚÉņĮöļŖö ņĀĢņāü Ļ░ä ĻĘĖļ”¼Ļ│Ā Ļ│ĀņŚÉņĮöļŖö ņĀÉļ¦ēĒĢśņĖĄ ņĀĢļÅäņØś ņŚÉņĮöļĪ£ ļ╣äĻĄÉĒĢĀ ņłś ņ׳Ļ▓Āļŗż. ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīņŚÉņä£ ļ¼┤ņŚÉņĮöļź╝ ļ│┤ņØ┤ļŖö ņāüĒö╝ĒĢś ņóģņ¢æņŚÉļŖö ļéŁņóģņä▒ ļ│æļ│ĆļōżĻ│╝ ļ”╝ĒöäĻ┤ĆņóģņØ┤ ņ׳Ļ▓Āņ£╝ļ®░ Ļ│ĀņŚÉņĮöļź╝ ļ│┤ņØ┤ļŖö ņāüĒö╝ĒĢś ņóģņ¢æņŚÉļŖö ņ¦Ćļ░®ņóģņØ┤ ņ׳Ļ▓Āļŗż. ĻĘĖ ņÖĖ ļéśļ©Ėņ¦Ć ļīĆļČĆļČäņØś ņāüĒö╝ĒĢś ņóģņ¢æļōżņØĆ ņĀĆņŚÉņĮöļź╝ ļ│┤ņØĖļŗż(Table 2).
ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīņŚÉņä£ ņŚÉņĮöņØś ĻĘĀņ¦łņä▒ņØĆ ņāüĒö╝ĒĢś ņóģņ¢æņØś ĻĄ¼ņä▒ ņä▒ļČäļōżņŚÉ ļö░ļØ╝ ļÅÖņØ╝ĒĢ£ ņä▒ļČäņ£╝ļĪ£ ĻĄ¼ņä▒ļÉśņ¢┤ ņ׳ņ£╝ļ®┤ ĻĘĀņ¦łĒĢ£(homogeneous) ņŚÉņĮöļź╝ ļ│┤ņØ┤ļ®░ ļéŁņóģņä▒ ļ│æļ│Ćļōż, ļ”╝ĒöäĻ┤Ćņóģ, ĒÅēĒÖ£ĻĘ╝ņóģ, ņ¦Ćļ░®ņóģņØ┤ ĻĘĀņ¦łĒĢśĻ▓ī Ļ┤Ćņ░░ļÉ£ļŗż. ĻĄ¼ņä▒ ņä▒ļČäņØ┤ ļŗżņ¢æĒĢ£ ņä▒ļČäņ£╝ļĪ£ ļÉśņ¢┤ ņ׳ņ£╝ļ®┤ ļČłĻĘĀņ¦łĒĢ£(heterogeneous) ņŚÉņĮöļź╝ ļ│┤ņØ┤ļ®░ ņØ┤ņåīņä▒ ņĘīņן, ņŚ╝ņ”Øņä▒ ņä¼ņ£Āņ¢æ ņÜ®ņóģ ļō▒ņØ┤ ļīĆĒæ£ņĀüņØ┤ļŗż. ņ£äņןĻ┤ĆĻ░äņ¦ł ņóģņ¢æņØś Ļ▓ĮņÜ░ ņĀĆņ£äĒŚśļÅä(low risk) ņóģņ¢æņØĆ ĻĘĀņ¦łĒĢśĻ▓ī, Ļ│Āņ£äĒŚśļÅä(high risk) ņóģņ¢æņØĆ ļČłĻĘĀņ¦łĒĢśĻ▓ī Ļ┤Ćņ░░ļÉ£ļŗż(Table 2).
ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīļĪ£ ņāüĒö╝ĒĢś ņóģņ¢æņØś ņ¦äļŗ©ņŚÉ ņ׳ņ¢┤ Ļ░Ćņן ņ¢┤ļĀżņÜ░ļ®┤ņä£ ņżæņÜöĒĢ£ ņĀÉņØĆ Ļ│Āņ£ĀĻĘ╝ņĖĄņØś ņĀĆņŚÉņĮö ņóģņ¢æļōżņØś Ļ░Éļ│äņØ┤ļŗż. ņØ┤ ļ│æļ│ĆļōżņØĆ ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīī ņ¦äļŗ©ņØś ņĀĢĒÖĢļÅäĻ░Ć ļé«ņ£╝ļ®░ ņĢģņä▒ņØĖ ņ£äņןĻ┤ĆĻ░äņ¦ł ņóģņ¢æņØ┤ ĒżĒĢ©ļÉśņ¢┤ ņ׳ņ¢┤ Ļ░Éļ│äņØ┤ ņżæņÜöĒĢśļŗż. Ļ│Āņ£ĀĻĘ╝ņĖĄņØś ņĀĆņŚÉņĮö ļ│æļ│ĆņØĆ ļīĆĒæ£ņĀüņ£╝ļĪ£ ĒÅēĒÖ£ĻĘ╝ņóģ, ņŗĀĻ▓Įņ┤łņóģ(schwannoma), ņ£äņןĻ┤ĆĻ░äņ¦ł ņóģņ¢æ ņ׳ļŗż. ļ©╝ņĀĆ ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīņŚÉņä£ ļäż ļ▓łņ¦Ė ņĖĄņØĖ Ļ│Āņ£ĀĻĘ╝ņĖĄņØä ļ╣äĻĄÉĒĢĀ ņłś ņ׳ļŖöļŹ░ ĒÅēĒÖ£ĻĘ╝ņóģņØĆ Ļ│Āņ£ĀĻĘ╝ņĖĄĻ│╝ Ļ░ÖņØĆ ņŚÉņĮöļĪ£ ņ×ÉņŚ░ņŖżļ¤ĮĻ▓ī ņŚ░Ļ▓░ļÉśļŖö ņåīĻ▓¼ņØ┤ļ®░ ņŗĀĻ▓Įņ┤łņóģņØĆ Ļ│Āņ£ĀĻĘ╝ņĖĄļ│┤ļŗż ļŹö ņĀĆņŚÉņĮöļĪ£, ņ£äņןĻ┤ĆĻ░äņ¦ł ņóģņ¢æņØĆ ļ│┤ļŗż ļŹö Ļ│ĀņŚÉņĮöļĪ£ Ļ┤Ćņ░░ļÉ£ļŗż. ĻĘĖļ”¼Ļ│Ā ĒÅēĒÖ£ĻĘ╝ņóģĻ│╝ ņŗĀĻ▓Įņ┤łņóģņØĆ ĻĘĀņ¦łĒĢ£ ņŚÉņĮöļĪ£ Ļ┤Ćņ░░ļÉśļéś ņ£äņןĻ┤ĆĻ░äņ¦ł ņóģņ¢æņØĆ Ēü¼ĻĖ░Ļ░Ć Ēü¼Ļ▒░ļéś ņĢģņä▒ļÅäĻ░Ć ļåÆņØäņłśļĪØ ļČłĻĘĀņ¦łĒĢśĻ▓ī Ļ┤Ćņ░░ļÉ£ļŗż. ĻĘĖ ņÖĖņŚÉļÅä ņŗĀĻ▓Įņ┤łņóģņØĆ ņóģņ¢æņØś Ļ▓ĮĻ│äĻ░Ć ļ╣äņ╣śļŖö ļō»ĒĢ£ ņåīĻ▓¼(marginal halo), ĒÅēĒÖ£ĻĘ╝ņóģņØĆ ļé┤ļČĆņŚÉ ņäØĒÜīĒÖö(calcification), ņ£äņןĻ┤ĆĻ░äņ¦ł ņóģņ¢æņØĆ ņĢģņä▒ļÅäĻ░Ć ļåÆņĢä ņ¦łņłśļĪØ ļ¼┤ņŚÉņĮö ņśüņŚŁ(anechoic area)ņØ┤ļéś Ļ│ĀņŚÉņĮö ņĀÉ(hyperechoic foci)ņØ┤ Ļ┤Ćņ░░ļÉĀ ņłś ņ׳ļŗż(Table 3).
Ļ░üĻ░ü ņóģņ¢æļōżņØś ļ░£ņāØ ļ╣łļÅäņŚÉ ļīĆĒĢ£ ņĀĢĒÖĢĒĢ£ ņŚ░ĻĄ¼ļŖö ņŚåņ£╝ļéś ĻĄŁļé┤ ņ×äņāüņŚÉņä£ ĒØöĒĢśĻ▓ī Ļ┤Ćņ░░ļÉśļŖö ņāüĒö╝ĒĢś ņóģņ¢æļōżļĪ£ļŖö ņ¢æņä▒ ļ│æļ│ĆņØĖ ņØ┤ņåīņä▒ ņĘīņן, ņ¦Ćļ░®ņóģ, ĒÅēĒÖ£ĻĘ╝ņóģĻ│╝ ņĢģņä▒ņØś Ļ░ĆļŖźņä▒ņØ┤ ņ׳ņ£╝ļ®┤ņä£ ļ╣äĻĄÉņĀü ĒØöĒĢśĻ▓ī ņĀæĒĢĀ ņłś ņ׳ļŖö ņŗĀĻ▓Įļé┤ļČäļ╣ä ņóģņ¢æ, ņ£äņןĻ┤ĆĻ░äņ¦ł ņóģņ¢æņØä Ļ╝ĮņØä ņłś ņ׳Ļ▓Āļŗż.
ņ£äņØś ņØ┤ņåīņä▒ ņĘīņןņØĆ ņĀäņĀĢļČĆņÖĆ ĒĢśļČĆ ņ▓┤ļČĆņŚÉ ņŻ╝ļĪ£ ļ░£ņāØĒĢśĻ│Ā Ēü¼ĻĖ░ļŖö ļŗżņ¢æĒĢśļ®░ Ēæ£ļ®┤ņŚÉ Ļ░£ĻĄ¼ļČĆĻ░Ć Ļ┤Ćņ░░ļÉśļŖö Ļ▓ĮņÜ░Ļ░Ć ņóģņóģ ņ׳ļŖöļŹ░(Fig. 4A) ņāØĻ▓Ć Ļ▓Ėņ×ÉļĪ£ ļłäļź╝ ļĢī ļČĆļō£ļ¤ĮĻ▓ī ļŖÉĻ╗┤ņ¦Ćļéś ņ¦Ćļ░®ņóģ ņĀĢļÅäļĪ£ ņēĮĻ▓ī ļłīļ¤¼ņ¦Ćņ¦ĆļŖö ņĢŖļŖöļŗż. ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīņŚÉņä£ ņŻ╝ļĪ£ 3ņĖĄņŚÉņä£ ĻĖ░ņøÉĒĢśļŖö ļČłĻĘĀņ¦łĒĢ£ ņĀĆņŚÉņĮöļĪ£ Ļ┤Ćņ░░ļÉśļ®░ Ļ▓ĮĻ│äĻ░Ć ļČłļ¬ģĒÖĢĒĢśņŚ¼ ņ╣©ņŖĄņĀüņØĖ ņĢģņä▒ ņóģņ¢æņ▓śļ¤╝ Ļ┤Ćņ░░ļÉĀ ņłśļÅä ņ׳ņ£╝ļéś Ļ┤ĆņØ┤ļéś ļéŁņä▒ ĒśĢĒā£ņØś ļ¼┤ņŚÉņĮöļĪ£ Ļ┤Ćņ░░ļÉśļŖö ņĘīĻ┤Ć ĻĄ¼ņĪ░Ļ░Ć ĒŖ╣ņ¦ĢņĀüņØ┤ļŗż(Fig. 4B). ļ│┤ĒåĄ ĒŖ╣ļ│äĒĢ£ ņ╣śļŻīņŚåņØ┤ ļé┤ņŗ£Ļ▓Į ņČöņĀü Ļ┤Ćņ░░ņØä ĒĢśļéś ļō£ļ¼╝Ļ▓ī ņŚ╝ņ”Ø, ņČ£ĒśłņØ┤ ļ░£ņāØĒĢśĻ▒░ļéś ņĢäņŻ╝ ļō£ļ¼╝Ļ▓ī ņĢģņä▒ņØś ļ│┤Ļ│ĀĻ░Ć ņ׳ņ¢┤ ņĀłņĀ£Ļ░Ć ĒĢäņÜöĒĢ£ Ļ▓ĮņÜ░ļÅä ņ׳ļŗż.
ņ£ä ņ¦Ćļ░®ņóģņØĆ ņØ┤ņåīņä▒ ņĘīņןĻ│╝ ĒĢ©Ļ╗ś ņĀäņĀĢļČĆņŚÉ ņŻ╝ļĪ£ ļ░£ņāØĒĢśļ®░ Ēü¼ĻĖ░ļŖö ļŗżņ¢æĒĢśļ®░ ĒÖ®ņāēņĪ░ļź╝ ļØäļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦Äļŗż(Fig. 4C). ņāØĻ▓Ć Ļ▓Ėņ×ÉļĪ£ ļłäļź╝ ļĢī ņēĮĻ▓ī ļłīļ¤¼ņ¦ĆļŖö ņåīĻ▓¼ņØ┤ ĒŖ╣ņ¦ĢņĀüņØ┤ļ®░ ļŗ©ņł£ ņāØĻ▓Ć ĒøäņŚÉ ņ¦Ćļ░®ņĪ░ņ¦üņØ┤ ļģĖņČ£ļÉśļŖö Ļ▓ĮņÜ░Ļ░Ć ņ׳ņ¢┤ ņ¦äļŗ©ņŚÉ ļÅäņøĆņØ┤ ļÉ£ļŗż. ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīņŚÉņä£ 3ņĖĄņŚÉ ņ£äņ╣śĒĢśĻ│Ā ĻĘĀņ¦łĒĢ£ Ļ│ĀņŚÉņĮöļĪ£ Ļ┤Ćņ░░ļÉśņ¢┤ ĒŖ╣ņ¦ĢņĀüņØ┤ļŗż(Fig. 4D). ĒŖ╣ļ│äĒĢ£ ņČöĻ░Ć Ļ▓Ćņé¼ļéś ņĪ░ņ╣ś ņŚåņØ┤ Ļ▓ĮĻ│╝ Ļ┤Ćņ░░ĒĢśļ®┤ ļÉśļéś ļō£ļ¼╝Ļ▓ī ņ”ØņāüņØä ņØ╝ņ£╝Ēé¼ ņĀĢļÅäļĪ£ ļ¦żņÜ░ Ēü░ Ēü¼ĻĖ░ļéś ņČ£ĒśłņØ┤ ļÅÖļ░śļÉ£ ļ│┤Ļ│ĀļōżņØ┤ ņ׳ļŗż.
ņ£äņØś ĒÅēĒÖ£ĻĘ╝ņóģņØĆ ļČäļ¼ĖļČĆļź╝ ĒżĒĢ©ĒĢ£ ņāüņ▓┤ļČĆņŚÉ ĒśĖļ░£ĒĢśļ®░ ļīĆļČĆļČä 2 cm ļ»Ėļ¦īņØś ņ×æņØĆ Ēü¼ĻĖ░ņØ┤ļ®░ Ēæ£ļ®┤ņØ┤ ļ¦żļüłĒĢśĻ│Ā ĒŖ╣ļ│äĒĢ£ ļ│ĆĒÖöĻ░Ć ņŚåņ£╝ļ®░(Fig. 4E) ņāØĻ▓Ć Ļ▓Ėņ×ÉļĪ£ ļłäļź╝ ļĢī ļŗ©ļŗ©ĒĢśĻ▓ī ļŖÉĻ╗┤ņ¦äļŗż. ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīņŚÉņä£ Ļ▒░ņØś ļīĆļČĆļČä 4ņĖĄņŚÉ Ļ│Āņ£ĀĻĘ╝ņĖĄĻ│╝ ļÅÖņØ╝ĒĢśĻ▓ī ņŚ░Ļ▓░ļÉśļŖö ļō»ĒĢ£ ĻĘĀņ¦łĒĢ£ ņĀĆņŚÉņĮöļĪ£ Ļ▓ĮĻ│äĻ░Ć ļ¬ģĒÖĢĒĢśĻ▓ī Ļ┤Ćņ░░ļÉśņ¢┤ ņ¦äļŗ©ņØ┤ ņ¢┤ļĀĄņ¦Ć ņĢŖņ£╝ļéś ņĀĆņ£äĒŚśļÅä ņ£äņןĻ┤ĆĻ░äņ¦ł ņóģņ¢æĻ│╝ ĻĄ¼ļ│äņØ┤ ņ¢┤ļĀĄļŗż(Fig. 4F).
ņ£äņØś ņ£äņןĻ┤ĆĻ░äņ¦ł ņóģņ¢æņØĆ ĻČüļźŁļČĆļź╝ ĒżĒĢ©ĒĢ£ ņāüņ▓┤ļČĆņŚÉ ņŻ╝ļĪ£ ļ░£ņāØĒĢśļ®░ Ēü¼ĻĖ░ļŖö ļŗżņ¢æĒĢśļ®░ Ēü¼ĻĖ░Ļ░Ć ņ╗żņ¦łņłśļĪØ ņĢģņä▒ņØś ņ£äĒŚśļÅäĻ░Ć ļåÆņĢäņ¦äļŗż. ļīĆļČĆļČä ņĀĢņāüņĀÉļ¦ēņ£╝ļĪ£ ļŹ«ņŚ¼ ņ׳ņ£╝ļéś(Fig. 4G) Ēü¼ĻĖ░Ļ░Ć ņ╗żņ¦ĆĻ▒░ļéś ņ¦äĒ¢ēĒĢśļ®┤ Ēæ£ļ®┤ņŚÉ ļ»Ėļ×ĆņØ┤ļéś ĻČżņ¢æņØ┤ ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż. ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīņŚÉņä£ ļīĆļČĆļČä 4ņĖĄņŚÉņä£ ĻĖ░ņøÉĒĢśļ®░ ņĀĆņ£äĒŚśļÅä ņ£äņןĻ┤ĆĻ░äņ¦ł ņóģņ¢æņØĆ ļ╣äĻĄÉņĀü ĻĘĀņ¦łĒĢ£ ņĀĆņŚÉņĮöļĪ£ Ļ┤Ćņ░░ļÉśņ¢┤ ĒÅēĒÖ£ĻĘ╝ņóģĻ│╝ Ļ░Éļ│äņØ┤ ņ¢┤ļĀżņÜ░ļéś Ļ│Āņ£äĒŚśļÅä ņ£äņןĻ┤ĆĻ░äņ¦ł ņóģņ¢æņØĆ ļČłĻĘĀņ¦łĒĢ£ ņŚÉņĮöņÖĆ ļ¼┤ņŚÉņĮö ņśüņŚŁņØ┤ Ļ┤Ćņ░░ļÉśļ®░ ļČłĻĘ£ņ╣ÖĒĢ£ ļ│ĆņŚ░ ņåīĻ▓¼ņØ┤ Ļ┤Ćņ░░ļÉ£ļŗż(Fig. 4H). ņ£äņןĻ┤ĆĻ░äņ¦ł ņóģņ¢æņØś ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīņŚÉņä£ 3 cm ņØ┤ņāüņØś Ēü¼ĻĖ░, ļČłĻĘĀņ¦łĒĢ£ ņŚÉņĮö, ļé┤ļČĆņŚÉ ļ¼┤ņŚÉņĮö Ēś╣ņØĆ Ļ│ĀņŚÉņĮö ņśüņŚŁņØś ĒżĒĢ©, ļ│ĆņŚ░ņØś ļČłĻĘ£ņ╣Öņä▒ņØĆ ņĢģņä▒ Ļ│Āņ£äĒŚś ņåīĻ▓¼ļōżņØ┤ļŗż[14,15].
ņ£ä ņŗĀĻ▓Įļé┤ļČäļ╣ä ņóģņ¢æņØĆ 1ĒśĢņØĆ ņ£äņČĢņä▒ ņ£äņŚ╝ņØś ļČäĒżņÖĆ ļ╣äņŖĘĒĢśĻ▓ī ņ▓┤ļČĆ ņåīļ¦īņŚÉ ĒśĖļ░£ĒĢśļ®░ 3ĒśĢņØĆ ņ£äņØś ņ¢┤ļŖÉ ļČĆņ£äņŚÉņä£ļéś ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż[6]. 1ĒśĢņØĆ 1 cm ļ»Ėļ¦īņ£╝ļĪ£ ļŗżļ░£ņä▒ņ£╝ļĪ£ Ļ┤Ćņ░░ļÉĀ ņłś ņ׳ņ£╝ļ®░ 3ĒśĢņØĆ 2 cm ņØ┤ņāüņØś Ēü░ ļŗ©ņØ╝ ļ│æļ│Ćņ£╝ļĪ£ Ļ┤Ćņ░░ļÉĀ ņłś ņ׳ļŗż[16]. ņĀÉļ¦ēĒĢśņĖĄņØ┤ļéś ņĀÉļ¦ēĻĘ╝ņĖĄņŚÉņä£ ĻĖ░ņøÉĒĢ┤ņä£ ņĀÉļ¦ēņ£╝ļĪ£ ņ╣©ļ▓öĒĢśļŖö Ļ▓ĮņÜ░ņŚÉ Ēæ£ļ®┤ņŚÉ ļ░£ņĀüņØ┤ļéś ļ»Ėļ×ĆņØä ļÅÖļ░śĒĢĀ ņłś ņ׳ļŗż(Fig. 4I). ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīņŚÉņä£ 2ņĖĄĻ│╝ 3ņĖĄņŚÉ ņ£äņ╣śĒĢ£ ĻĘĀņ¦łĒĢ£ ņĀĆņŚÉņĮöļĪ£ Ļ┤Ćņ░░ļÉśļ®░ Ļ▓ĮĻ│äļŖö ļ╣äĻĄÉņĀü ļ¬ģĒÖĢĒĢ£ ĒÄĖņØ┤ļŗż(Fig. 4J). ņ£ä ņŗĀĻ▓Įļé┤ļČäļ╣ä ņóģņ¢æņŚÉņä£ ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīļŖö ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ ņĀäņŚÉ ņ╣©ņ£ż Ļ╣ŖņØ┤ļź╝ ĒīīņĢģĒĢśļŖö ļŹ░ ĒĢäņÜöĒĢśļŗż. 1ĒśĢ Ēś╣ņØĆ 2ĒśĢ ņ£ä ņŗĀĻ▓Įļé┤ļČäļ╣ä ņóģņ¢æņØ┤ ļ”╝ĒöäņĀł ņĀäņØ┤ ņåīĻ▓¼ņØ┤ ņŚåĻ│Ā 2 cm ņØ┤ĒĢśņØ┤ļ®┤ņä£ ņĀÉļ¦ēĒĢśņĖĄņŚÉ ĻĄŁĒĢ£ļÉśņ¢┤ ņ׳ņØä ļĢī ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ļź╝ ĻČīĻ│ĀĒĢśĻ│Ā ņ׳ļŗż[17].
ņÖĖļČĆ ņĢĢļ░ĢļōżņØĆ ņāüĒö╝ĒĢś ņóģņ¢æņØĆ ņĢäļŗłļéś ņ×äņāüņŚÉņä£ ĒØöĒ׳ Ļ┤Ćņ░░ļÉĀ ņłś ņ׳ļŗż. ņÖĖļČĆ ņĢĢļ░ĢņØĆ ņāüĒö╝ĒĢś ņóģņ¢æņŚÉ ļ╣äĒĢ┤ Ļ▓ĮĻ│äĻ░Ć ļ¬©ĒśĖĒĢ£ ņÖäļ¦īĒĢ£ Ļ▓ĮĻ│äņØś ņ£ĄĻĖ░ņä▒ ļ│æļ│Ćņ£╝ļĪ£ Ļ┤Ćņ░░ļÉśļ®░ ņāüĒö╝ĒĢś ņóģņ¢æļōżņŚÉ ļ╣äĒĢ┤ Ēü¼ĻĖ░Ļ░Ć Ēü¼Ļ│Ā ļäōņØĆ ĒÄĖņØ┤ļŗż. ĒÖśņ×ÉņØś ņ×ÉņäĖ ļ│ĆĻ▓Į, ĒśĖĒØĪ, Ļ│ĄĻĖ░ņŻ╝ņ×ģņŚÉ ļö░ļØ╝ ļ│æļ│ĆņØ┤ ņåīņŗżļÉśĻ▒░ļéś ņ£äņ╣śĻ░Ć ļ│ĆĒĢĀ ņłś ņ׳ņ£╝ļ®░ ĒśłĻ┤Ćņä▒ ĻĄ¼ņĪ░ļ¼╝ņØĖ Ļ▓ĮņÜ░ ļ░ĢļÅÖņä▒ņØ┤ Ļ┤Ćņ░░ļÉ£ļŗż. Ļ░Ćņן ĒØöĒĢśĻ▓ī Ļ┤Ćņ░░ļÉĀ ņłś ņ׳ļŖö ņ£äļź╝ ņĢĢļ░ĢĒĢśļŖö ņĀĢņāü ņןĻĖ░ļŖö Ļ░äĻ│╝ ļ╣äņןņ£╝ļĪ£ Ļ░äņØś ņĢĢļ░ĢņØĆ ļ│┤ĒåĄ ņ▓┤ļČĆ ņĀäļ▓ĮĻ│╝ ņåīļ¦īņ£╝ļĪ£(Fig. 5A, B), ļ╣äņןņØś ņĢĢļ░ĢņØĆ ņ▓┤ļČĆ Ēøäļ▓ĮĻ│╝ ļīĆļ¦īņ£╝ļĪ£ Ļ┤Ćņ░░ļÉ£ļŗż(Fig. 5C, D). ļŗ┤ļéŁņØĆ ņĀĢņāüņĀüņ£╝ļĪ£ ņ£äļź╝ ņĢĢļ░ĢĒĢśņ¦Ć ņĢŖņ£╝ļéś ĒÖĢņןņØ┤ ļÉśļ®┤ ņĀäņĀĢļČĆ Ēś╣ņØĆ ĒĢśņ▓┤ļČĆ ņĀäļ▓Įņ£╝ļĪ£ ņĢĢļ░ĢĒĢĀ ņłś ņ׳ļŗż. ĻĘĖ ņÖĖ ĒØöĒĢśĻ▓ī ņ¢æņä▒ņØ┤ļ®┤ņä£ ņ£äļź╝ ņĢĢļ░ĢĒĢśļŖö ļ│æļ│ĆļōżņŚÉļŖö Ļ░äņóīņŚĮņØś ļéŁņóģņØ┤ ĻČüļźŁļČĆļéś ņāüņ▓┤ļČĆļź╝ ņĢĢļ░ĢĒĢĀ ņłś ņ׳Ļ│Ā(Fig. 5E, F) ļ╣äņן ĒśłĻ┤ĆņØ┤ ņāüņ▓┤ļČĆ ļīĆļ¦īņŚÉņä£ Ļ┤Ćņ░░ļÉĀ ņłś ņ׳ņ£╝ļ®░(Fig. 5G, H) ņĘīņן Ļ░Ćņä▒ ļéŁņóģņØ┤ ņ▓┤ļČĆ Ēøäļ▓ĮņØä ņĢĢļ░ĢĒĢĀ ņłś ņ׳ļŗż(Fig 5I, J).
ņāüĒö╝ĒĢś ņóģņ¢æņØĆ ņĢäļŗłņ¦Ćļ¦ī ņĢģņä▒ ņóģņ¢æņØ┤ ņāüĒö╝ĒĢś ņóģņ¢æņØś ĒśĢĒā£ļĪ£ Ļ┤Ćņ░░ļÉśļŖö Ļ▓ĮņÜ░ļÅä ņóģņóģ ļ¦łņŻ╝ņ╣śĻ▓ī ļÉ£ļŗż. ņāüĒö╝ĒĢś ņóģņ¢æ ĒśĢĒā£ņØś ņĪ░ĻĖ░ ņ£äņĢöņØ┤ļéś ņ¦äĒ¢ēņä▒ ņ£äņĢöņØ┤ ņ׳Ļ│Ā(Fig. 6A, B) ņØ┤ļĢīļŖö ņĪ░ņ¦ü Ļ▓Ćņé¼ņŚÉņä£ ņØīņä▒ņ£╝ļĪ£ ļéśņśżĻĖ░ļÅä ĒĢśļ®░ ņ£äņןĻ┤ĆĻ░äņ¦ł ņóģņ¢æņØ┤ļéś ņŗĀĻ▓Įļé┤ļČäļ╣ä ņóģņ¢æĻ│╝ Ļ░ÖņØĆ ņĢģņä▒ ņāüĒö╝ĒĢś ņóģņ¢æĻ│╝ Ļ░Éļ│äņØ┤ ņ¢┤ļĀĄĻĖ░ļÅä ĒĢśļŗż. ņāüĒö╝ĒĢś ņóģņ¢æ ĒśĢĒā£ņØś ņ£ä ļ¦ÉĒŖĖļ”╝Ēöäņóģ(gastric MALT lymphoma)ņØ┤ ņ׳ņ£╝ļ®░(Fig. 6C) ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīņŚÉņä£ ĒŖ╣ņ¦ĢņĀüņØĖ Ļ▓®ņ×É ļ¬©ņ¢æņØś ļ¦Ø ĒśĢĒā£Ļ░Ć Ļ┤Ćņ░░ļÉĀ ņłś ņ׳ļŗż(Fig. 6D). ĻĘĖ ņÖĖ Ļ░äņĢö, ņĘīņןņĢö Ļ░ÖņØ┤ ņ£äņŚÉ ņØĖņĀæĒĢ£ ņןĻĖ░ņØś ņĢöņØ┤ ņ£äņŚÉņä£ ņāüĒö╝ĒĢś ņóģņ¢æņØś ĒśĢĒā£ļĪ£ Ļ┤Ćņ░░ļÉĀ ņłś ņ׳Ļ│Ā(Fig. 6E, F) ļŗżļźĖ ņןĻĖ░ņØś ņĢöņØ┤ ņ£ä ļé┤ļČĆļéś ņ£äņŚÉ ņØĖņĀæĒĢ£ ļČĆņ£äļĪ£ ņøÉĻ▓® ņĀäņØ┤ļź╝ ĒĢśļ®┤ ņāüĒö╝ĒĢś ņóģņ¢æ ĒśĢĒā£ļĪ£ Ļ┤Ćņ░░ļÉśĻĖ░ļÅä ĒĢ£ļŗż(Fig. 6G, H).
ņ£ä ņāüĒö╝ĒĢś ņóģņ¢æņØĆ Ļ▒░ņØś ļīĆļČĆļČäņØ┤ ņ”ØņāüņŚåņØ┤ ņÜ░ņŚ░Ē׳ ļ░£Ļ▓¼ļÉśļ®░ ļ░£Ļ▓¼ļÉ£ ņāüĒö╝ĒĢś ņóģņ¢æļÅä ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ĒåĄĒĢ£ ĒÖĢņ¦äņØ┤ļéś ņĀ£Ļ▒░ņŚåņØ┤ ņČöņĀü Ļ┤Ćņ░░ļ¦ī ņÜöĒĢśļŖö ņ¢æņä▒ ļ│æļ│ĆļōżņØ┤ ļ¦Äļŗż. ņØ┤ļ¤░ ņ¢æņä▒ ļ│æļ│Ćņ×äņØä ĒīÉļŗ©ĒĢĀ ņłś ņ׳ļÅäļĪØ Ļ░üĻ░ü ņ£ä ņāüĒö╝ĒĢś ņóģņ¢æļōżņØś ĒŖ╣ņ¦ĢļōżņØä ņłÖņ¦ĆĒĢśĻ│Ā ļŗżņłśņØś ņ£ä ņāüĒīīĒĢś ņóģņ¢æļōżņØä ļé┤ņŗ£Ļ▓ĮņØ┤ļéś ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīļĪ£ Ļ┤Ćņ░░ĒĢśļŖö Ļ▓ĮĒŚśņØ┤ ĒĢäņÜöĒĢśļŗż. ļé┤ņŗ£Ļ▓ĮņŚÉņä£ ņ£äņ╣ś, ņāēņĪ░, Ēü¼ĻĖ░, Ēæ£ļ®┤ņØś ļ│ĆĒÖö, Ļ▓ĮļÅä ļ░Å Ļ░ĆļÅÖņä▒ņØä ĒÅēĻ░ĆĒĢśĻ│Ā ļé┤ņŗ£Ļ▓Į ņ┤łņØīĒīīļź╝ ĒĢĀ ņłś ņ׳ļŗżļ®┤ ļ░£ņāØņĖĄ, ņŚÉņĮöņØś ļ░śĒ¢ź ņĀĢļÅä, ņŚÉņĮöņØś ĻĘĀņ¦łņä▒ņØä ĒÅēĻ░ĆĒĢśņŚ¼ ņĄ£ļīĆĒĢ£ Ļ░Éļ│ä ņ¦äļŗ©ņØä ĒĢĀ ņłś ņ׳ļÅäļĪØ ļģĖļĀźĒĢśļ®┤ Ļ│╝ļÅäĒĢ£ Ļ▓Ćņé¼ļź╝ ņżäņØ╝ ņłś ņ׳Ļ│Ā ņ╣©ņŖĄņĀüņØĖ ņĪ░ņ¦ü Ļ▓Ćņé¼ļéś ļČłĒĢäņÜöĒĢ£ ņłśņłĀņØä Ēö╝ĒĢĀ ņłś ņ׳ļŗż. ņāüĒö╝ĒĢś ņóģņ¢æņ▓śļ¤╝ ļ│┤ņØ╝ ņłś ņ׳ļŖö ņĀĢņāü ņןĻĖ░ļéś ņ¢æņä▒ ļ│æļ│ĆļōżļĪ£ ņØĖĒĢ£ ņÖĖļČĆ ņĢĢļ░ĢņŚÉ ņØśĒĢ£ ņåīĻ▓¼ņØä ņĢīĻ│Ā ņ׳ļŗżļ®┤ ļČłĒĢäņÜöĒĢ£ Ļ▓Ćņé¼ļōżņØä ņżäņØ╝ ņłś ņ׳Ļ│Ā ļō£ļ¼╝ņ¦Ćļ¦ī ņāüĒö╝ĒĢś ņóģņ¢æņ▓śļ¤╝ ļ│┤ņØ╝ ņłś ņ׳ļŖö ņĢģņä▒ ņóģņ¢æņØä ņØĖņ¦ĆĒĢśĻ│Ā ņ׳ļŗżļ®┤ ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ļ¦īņ£╝ļĪ£ļÅä ņČöņĀĢĒĢĀ ņłś ņ׳ļŗż. ņ¦äļŗ©ņØ┤ ņ¢┤ļĀżņÜĖ ļĢīļŖö ņĪ░ņ¦ü Ļ▓Ćņé¼ļź╝ ĒåĄĒĢ┤ņä£ ņ¦äļŗ© ļ░Å Ē¢źĒøä ņĀłņĀ£ņØś ĒĢäņÜöņä▒ņØä Ļ▓░ņĀĢĒĢĀ ņłśļÅä ņ׳ļŗż.
Fig.┬Ā2.
Colors and surface changes of gastric subepithelial tumors. (A) Normal color; leiomyoma, (B) yellowish color; lipoma, (C) translucent; cyst, (D) bluish color; hemangioma, (E) opening; ectopic pancreas, (F) dimpling; ectopic pancreas, (G) erosion; inflammatory fibroid polyp, (H) nipple like projection; gastritis cystica profunda, (I) erythema; neuroendocrine tumor, (J) ulcer; gastrointestinal stromal tumor.
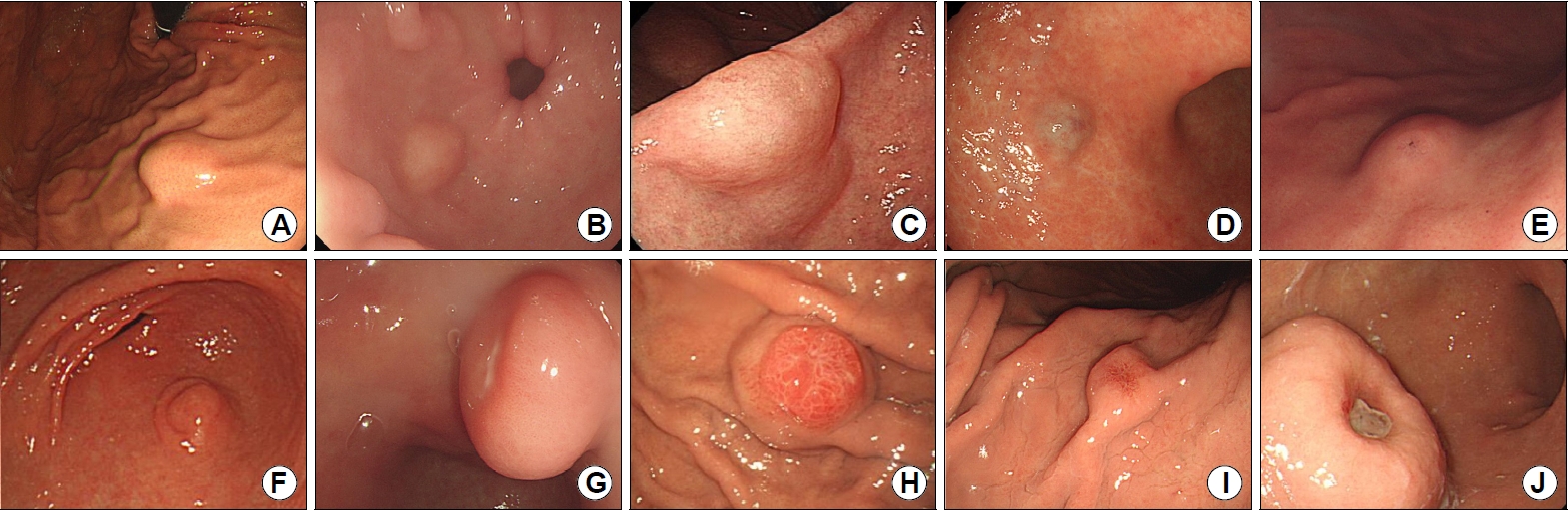
Fig.┬Ā3.
Size, consistency, and movability of gastric subepithelial tumors. (A, B) Size measurement of a subepithelial tumor using biopsy forceps. It is about 5 mm in size when the forceps is opened. (C, D) Size measurement of a subepithelial tumor using endoscopic shaft. A line is displayed every 5 cm in the endoscope. (E) The subepithelial tumor is easily pressed when compressed using biopsy forceps (pillow sign). (F) The subepithelial tumor moves easily when pushed using biopsy forceps (rolling sign). (G) When the tip of the subepithelial tumor is grasped using biopsy forceps, the epithelium is easily separated from the tumor (tenting sign).
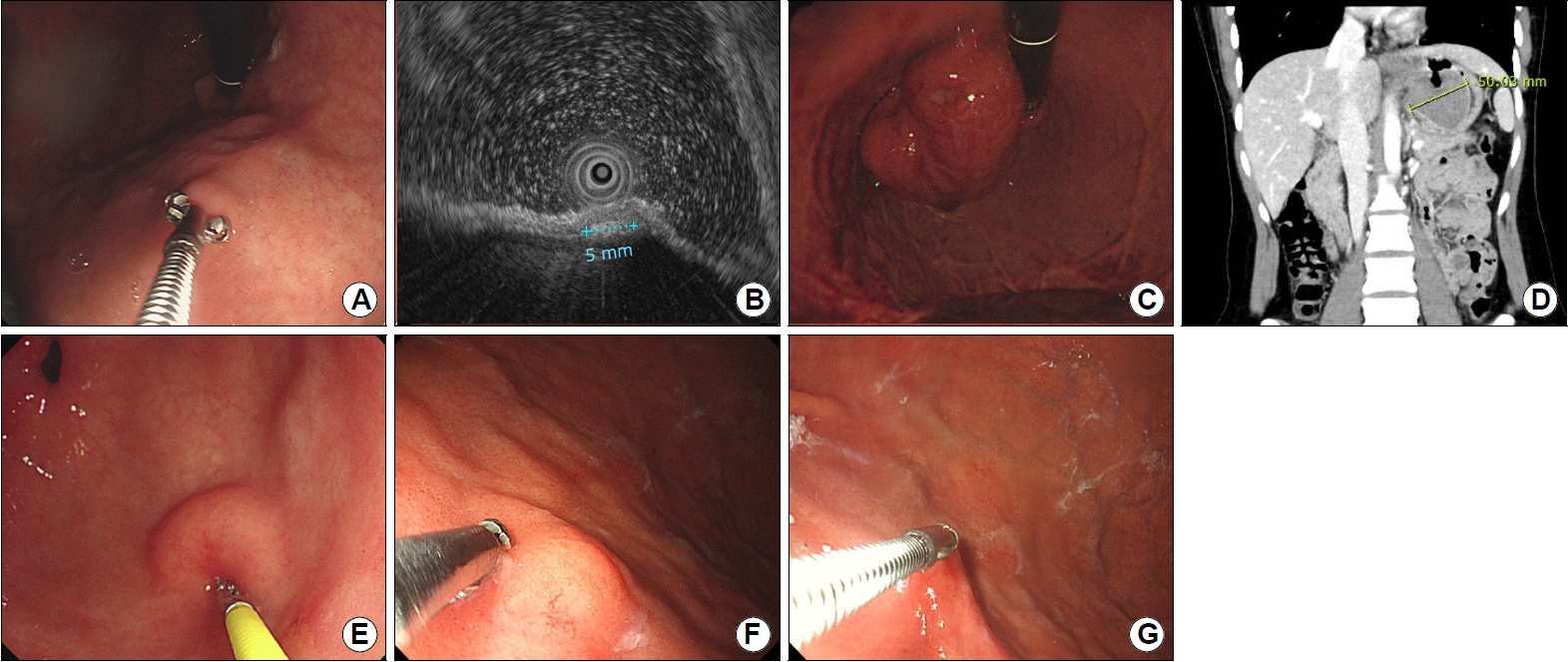
Fig.┬Ā4.
Common subepithelial tumors in Koreans. (A) A soft subepithelial tumor 20 mm (yellow arrow) in size is observed on the greater curvature of the antrum. A depression is observed in the center of the lesion. (B) On endoscopic ultrasound, a heterogeneous, mixed-echoic lesion is located in the third submucosal layer. Anechoic dots and lines (green arrow) considered ducts are observed within the tumor. (C) A soft subepithelial tumor 9 mm (white arrow) in size is observed on the greater curvature of antrum. (D) On endoscopic ultrasound, a homogeneous, intensive hyperechoic lesion with distinct border is located in the third submucosal layer. (E) A hard subepithelial tumor 8 mm (black arrow) in size is observed on the posterior wall of the upper body. (F) On endoscopic ultrasound, a homogeneous, hypoechoic, oval lesion that seems thickened by connecting the fourth proper muscle layers is observed. (G) A hard mass with a size of 70 mm (blue arrow) is observed on the greater curvature of the upper body. (H) On endoscopic ultrasound, a heterogeneous, hypoechoic lesion is observed originating from the fourth layer. The tumor has irregular borders and contains anechoic lesions. (I) A hard subepithelial tumor with a size of 7 mm (red arrow) is observed on the greater curvature of the mid-body. Erythema is observed on the surface of the lesion. (J) On endoscopic ultrasound, a heterogeneous, hypoechoic lesion is seen located in the second and third layer.
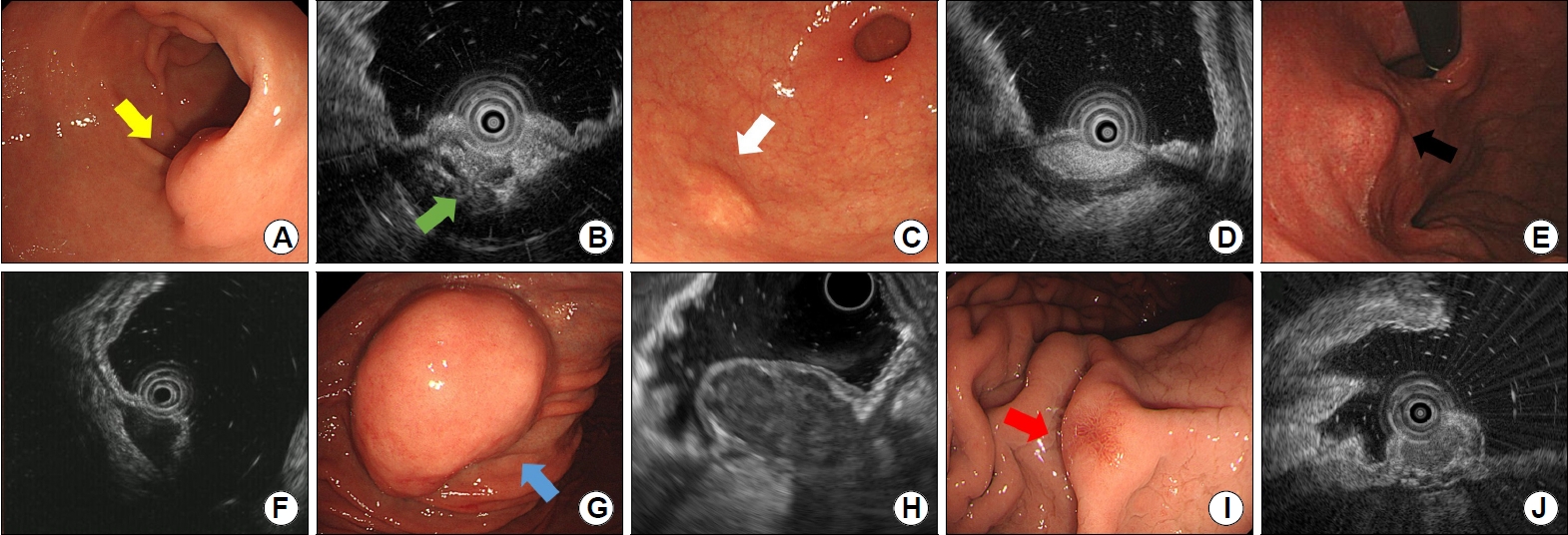
Fig.┬Ā5.
Extraluminal compressions of normal organs and benign lesions. (A, B) Liver, (C, D) spleen (purple arrow), (E, F) hepatic cyst, (G, H) splenic artery (red arrow), (I, J) pancreatic pseudocyst (green arrow).
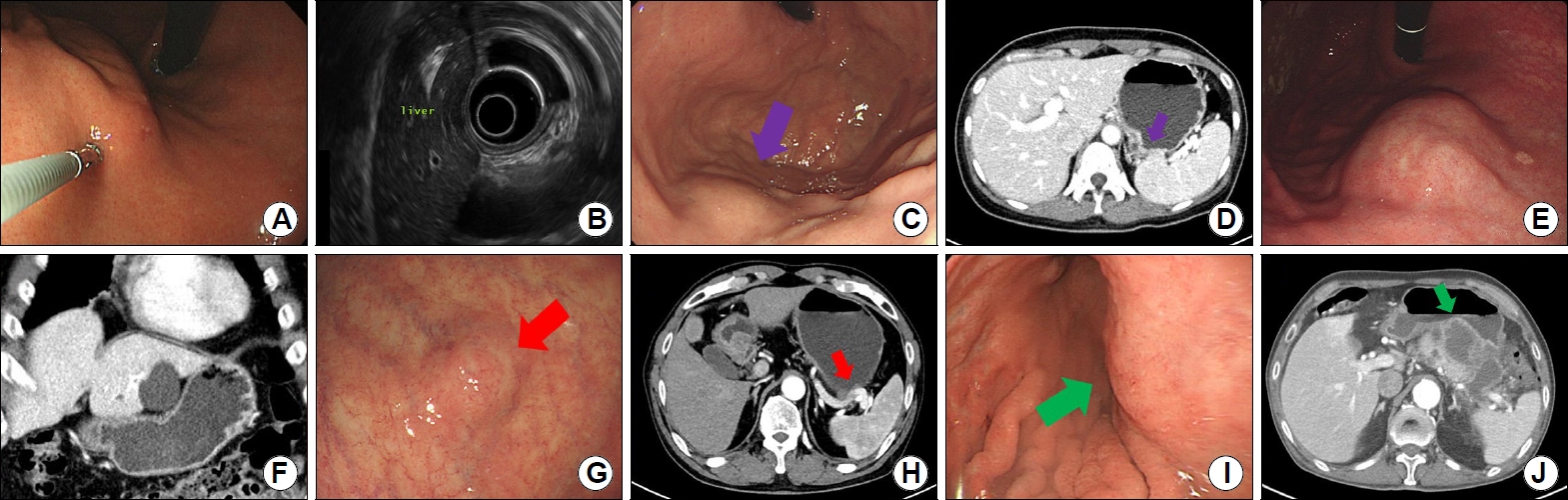
Fig.┬Ā6.
Gastric subepithelial tumor-like cancers. (A, B) A 3 cm-sized SET-like mass with a central depression was observed on the posterior wall of the antrum (arrow). After subtotal gastrectomy with lymph node dissection, a poorly differentiated adenocarcinoma with deep submucosal invasion and lymph node metastasis was confirmed. (C) A 2 cm-sized SET-like mass was observed on the posterior wall of the lower body. The biopsy in the central depression was diagnosed as gastric MALT lymphoma. (D) Latticework structure is observed inside the tumor in endoscopic ultrasound. (E) A mass was observed, and the boundary is unclear as it seemed to be pressed outside in the antrum. (F) Stomach invasion of the pancreatic cancer was confirmed in abdominal CT (arrow). (G, H) Peritoneal metastasis was observed in the form of SET-like mass in the antrum (arrow) in a patient after ovarian cancer surgery. SET, subepithelial tumor; MALT, mucosa-associated lymphoid tissue; CT, computed tomography.

REFERENCES
1. Song JH, Kim SG, Chung SJ, Kang HY, Yang SY, Kim YS. Risk of progression for incidental small subepithelial tumors in the upper gastrointestinal tract. Endoscopy 2015;47:675ŌĆō679.



2. Polkowski M. Endoscopic ultrasound and endoscopic ultrasound-guided fine-needle biopsy for the diagnosis of malignant submucosal tumors. Endoscopy 2005;37:635ŌĆō645.


3. Kim MY, Jung HY, Choi KD, et al. Natural history of asymptomatic small gastric subepithelial tumors. J Clin Gastroenterol 2011;45:330ŌĆō336.


4. Lim YJ, Son HJ, Lee JS, et al. Clinical course of subepithelial lesions detected on upper gastrointestinal endoscopy. World J Gastroenterol 2010;16:439ŌĆō444.



5. Kim GH. Systematic endoscopic approach for diagnosing gastric subepithelial tumors. Gut Liver 2022;16:19ŌĆō27.



6. Kl├Čppel G, Clemens A. The biological relevance of gastric neuroendocrine tumors. Yale J Biol Med 1996;69:69ŌĆō74.


8. Tada S, Iida M, Yao T, et al. Endoscopic removal of inflammatory fibroid polyps of the stomach. Am J Gastroenterol 1991;86:1247ŌĆō1250.

9. Hwang JH, Saunders MD, Rulyak SJ, Shaw S, Nietsch H, Kimmey MB. A prospective study comparing endoscopy and EUS in the evaluation of GI subepithelial masses. Gastrointest Endosc 2005;62:202ŌĆō208.


10. Hwang JH, Rulyak SD, Kimmey MB.; American Gastroenterological Association Institute. American Gastroenterological Association Institute technical review on the management of gastric subepithelial masses. Gastroenterology 2006;130:2217ŌĆō2228.


11. Nishida T, Blay JY, Hirota S, Kitagawa Y, Kang YK. The standard diagnosis, treatment, and follow-up of gastrointestinal stromal tumors based on guidelines. Gastric Cancer 2016;19:3ŌĆō14.



12. Yasuda K, Cho E, Nakajima M, Kawai K. Diagnosis of submucosal lesions of the upper gastrointestinal tract by endoscopic ultrasonography. Gastrointest Endosc 1990;36(2 Suppl): S17ŌĆōS20.


13. Gress F, Schmitt C, Savides T, et al. Interobserver agreement for EUS in the evaluation and diagnosis of submucosal masses. Gastrointest Endosc 2001;53:71ŌĆō76.


14. Chak A, Canto MI, R├Čsch T, et al. Endosonographic differentiation of benign and malignant stromal cell tumors. Gastrointest Endosc 1997;45:468ŌĆō473.


15. Palazzo L, Landi B, Cellier C, Cuillerier E, Roseau G, Barbier JP. Endosonographic features predictive of benign and malignant gastrointestinal stromal cell tumours. Gut 2000;46:88ŌĆō92.



-
METRICS

-
- 3 Crossref
- 5,257 View
- 180 Download
- Related articles in Korean J Helicobacter Up Gastrointest Res
-
Endoscopic Findings of Common Gastritis in Koreans2023 June;23(2)
Homogenous Subepithelial Esophageal Lesion2023 March;23(1)
Approach to Small Gastric Subepithelial Lesions2023 March;23(1)
The Pathologic Confirmation in Subepithelial Tumors2021 September;21(3)