|
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 24(1); 2024 > Article |
|
Abstract
Gastroesophageal varices occur in more than half of patients with cirrhosis and the incidence increases as liver function worsens. Although the mortality rate for acute variceal bleeding has decreased with the development of variceal endoscopic hemostasis and administration of vasoactive drugs and prophylactic antibiotics, it still reaches 20%. Therefore, surveillance of variceal occurrence and the prevention of their bleeding is very important in patients with cirrhosis. In patients with liver cirrhosis accompanied by portal hypertension, esophagogastroduodenoscopy should be performed to diagnose varices and stratify their bleeding risk. The interval of endoscopic surveillance is adjusted according to variceal condition and cirrhosis severity. If varices are diagnosed, primary prophylaxis (e.g., non-selective beta-blockers or endoscopic prophylaxis) is required to prevent variceal bleeding. Appropriate treatment, including timely endoscopic hemostasis, should be performed in patients with acute variceal bleeding, and secondary prophylaxis is required to prevent rebleeding. Endoscopic variceal ligation is the recommended endoscopic treatment for acute esophageal variceal bleeding; endoscopic variceal obstruction is usually recommended in patients with gastric varices. To prevent bleeding, endoscopic surveillance should be performed at regular intervals until the varices have been eradicated, and endoscopic followup should be performed periodically even after their disappearance. In this review, we investigate the role of endoscopy in the treatment and management of gastroesophageal varices.
ņĀĢļ¦źļźśļŖö Ļ░äņĪ░ņ¦üņØś ņä¼ņ£ĀĒÖöļéś ņ×¼ņāØ Ļ▓░ņĀłņŚÉ ņØśĒĢ┤ Ļ░äļ¼Ėļ¦ź ļé┤ ĒśłļźśņØś ņĀĆĒĢŁ ņ”ØĻ░ĆņÖĆ ņé░ĒÖöņ¦łņåī(nitric oxide)ņØś Ļ░ÉņåīļĪ£ Ļ░ä ļé┤ ĒśłĻ┤ĆņØ┤ ņłśņČĢļÉśļ®┤ņä£ Ļ░äļ¼Ėļ¦źņĢĢņØ┤ ĒĢŁņ¦äļÉśņ¢┤ ņāØņä▒ļÉ£ Ļ░äļ¼Ėļ¦źĻ│╝ ņĀäņŗĀ ņł£ĒÖśĻ│ä ņé¼ņØ┤ņØś Ļ│üņł£ĒÖś(collateral circulation)ņØ┤ļŗż[1-3]. Ļ░ä Ļ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņØś ņĀłļ░ś ņØ┤ņāüņŚÉņä£ ļ░£ņāØĒĢśĻ│Ā Ļ░äĻĖ░ļŖźņØ┤ ņĢģĒÖöļÉĀņłśļĪØ ļ░£ņāØļźĀņØ┤ ņ”ØĻ░ĆĒĢśņŚ¼ ļ╣äļīĆņāüņä▒ Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņŚÉņä£ļŖö 70%-85%Ļ╣īņ¦Ć ļÅÖļ░śļÉ£ļŗż[4,5].
Ļ│╝Ļ▒░ ņĀĢļ¦źļźś ņ┤łņČ£ĒśłļĪ£ ņØĖĒĢ£ ņé¼ļ¦ØļźĀņØĆ 50%ņśĆņ£╝ļéś ļé┤ņŗ£Ļ▓Į ņ¦ĆĒśłņłĀĻ│╝ ļ░®ņé¼ņäĀ ņżæņ×¼ņŗ£ņłĀņØ┤ ļ░£ņĀäĒĢśĻ│Ā ĒśłĻ┤ĆĒÖ£ņä▒ņĢĮļ¼╝(vasoactive drugs)Ļ│╝ ņśłļ░®ņĀüņØĖ ĒĢŁņāØņĀ£ ņé¼ņÜ® ļō▒ņ£╝ļĪ£ ņØĖĒĢ┤ ņé¼ļ¦ØļźĀņØ┤ ļ¦ÄņØ┤ Ļ░ÉņåīļÉśņŚłņ¦Ćļ¦ī ņĢäņ¦üĻ╣īņ¦ĆļÅä 12%-22%ņØś ļåÆņØĆ ņé¼ļ¦ØļźĀĻ│╝ ņČ£Ēśł Ēøä ņĀ£ļīĆļĪ£ Ļ┤Ćļ”¼ļÉśņ¦Ć ņĢŖņ£╝ļ®┤ 60%ņŚÉ ņØ┤ļź┤ļŖö ņ×¼ņČ£ĒśłļźĀņØ┤ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[6-10]. ĻĖēņä▒ ņĀĢļ¦źļźś ņČ£ĒśłņØś ļåÆņØĆ ņé¼ļ¦ØļźĀĻ│╝ ļČłļ¤ēĒĢ£ ņśłĒøäļź╝ Ļ│ĀļĀżĒĢĀ ļĢī Ļ░äĻ▓Įļ│Ćņ”ØņØ┤ ņ¦äļŗ©ļÉśļ®┤ ņĀĢļ¦źļźśņØś ļ░£ņāØ ņŚ¼ļČĆ ļ░Å ņČ£Ēśł ņ£äĒŚśļÅäņŚÉ ļīĆĒĢ£ ĒÅēĻ░ĆĻ░Ć ĒĢäņÜöĒĢśļŗż. ĒŖ╣Ē׳ ļ│Ąņłśļéś ļČĆņóģ, ĒÖ®ļŗ¼, Ļ░äņä▒ļćīņ”Ø, ļ╣äņןļ╣äļīĆ, Ļ▒░ļ»Ėņāü ĒśłĻ┤Ćņóģ, ļ│ĄļČĆĒśłĻ┤ĆņØś ņÜ░ĒÜīņł£ĒÖś(collateral circulation) ļō▒ Ļ░äļ¼Ėļ¦źņĢĢ ĒĢŁņ¦ä ņåīĻ▓¼ņØ┤ ņ׳ļŗżļ®┤ ņĀĢļ¦źļźśĻ░Ć ļ░£ņāØĒ¢łņØä Ļ░ĆļŖźņä▒ņØ┤ ļåÆņ£╝ļ»ĆļĪ£ ļ░śļō£ņŗ£ ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņŚ¼ņĢ╝ ĒĢ£ļŗż. Ļ░äĻ▓Įļ│Ćņ”Ø ņ¦äļŗ© ņŗ£ ņĀĢļ¦źļźśĻ░Ć ņŚåņŚłļŹś ĒÖśņ×ÉņŚÉņä£ļŖö 1ļģä ņØ┤ļé┤ 5%-9%, 2ļģä ņØ┤ļé┤ 14%-17%ņŚÉņä£ ņĀĢļ¦źļźśĻ░Ć ļ░£ņāØĒĢśĻ│Ā Ļ░äĻ▓Įļ│Ćņ”Ø ņ¦äļŗ© ņŗ£ ņ×æņØĆ ņĀĢļ¦źļźśĻ░Ć ņ¦äļŗ©ļÉ£ ĒÖśņ×ÉņŚÉņä£ļŖö 1ļģäņŚÉ 12%, 2ļģäņŚÉ 25%Ļ╣īņ¦Ć Ēü░ ņĀĢļ¦źļźśļĪ£ ņ¦äĒ¢ēļÉśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[11,12]. ļé┤ņŗ£Ļ▓Į ņČöņĀüĻ▓Ćņé¼ļŖö ņĀĢļ¦źļźśĻ░Ć ņŚåļŖö ļīĆņāüņä▒ Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņŚÉņä£ļŖö 2-3ļģä, ļ╣äļīĆņāüņä▒ Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņŚÉņä£ļŖö 1-2ļģä Ļ░äĻ▓®ņ£╝ļĪ£ ņŗ£Ē¢ēĒĢśļÅäļĪØ ĻČīĻ│ĀļÉ£ļŗż[13,14]. ĒŖ╣Ē׳ Ļ░äĻĖ░ļŖźņØ┤ ļ¦żņÜ░ ņĢģĒÖöļÉśņ¢┤ ņ׳Ļ▒░ļéś Ļ░äņåÉņāüņØ┤ ņ¦ĆņåŹļÉśļŖö ĒÖśņ×ÉļŖö ņĀĢļ¦źļźśņØś ņ¦äĒ¢ēņØ┤ ļ╣Āļź╝ ņłś ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ļé┤ņŗ£Ļ▓Į ņČöņĀüĻ▓Ćņé¼ņØś ņŻ╝ĻĖ░ļź╝ ļŗ©ņČĢĒĢśņŚ¼ ņŗ£Ē¢ēĒĢśļŖö Ļ▓āļÅä Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢ£ļŗż.
ļ│ĖĻ│ĀņŚÉņä£ļŖö ĻĖēņä▒ ņĀĢļ¦źļźś ņČ£Ēśł ņŗ£ ņĀüņĀłĒĢ£ ņ╣śļŻīņÖĆ ņĀĢļ¦źļźś ņČ£ĒśłņØä ņ£äĒĢ£ Ļ┤Ćļ”¼ņÖĆ ņśłļ░®ņŚÉ ļīĆĒĢ┤ ņĢīņĢäļ│┤Ļ│Ā ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ņÖĆ ļé┤ņŗ£Ļ▓Į ņ¦ĆĒśłņłĀņØś ņóģļźś ļ░Å ņŚŁĒĢĀņŚÉ ļīĆĒĢ┤ ĻĖ░ņłĀĒĢśĻ│Āņ×É ĒĢ£ļŗż.
ļ»ĖĻĄŁĻ░äĒĢÖĒÜīņŚÉņä£ļŖö 5 mm Ēü¼ĻĖ░ļź╝ ĻĖ░ņżĆņ£╝ļĪ£ ņ×æņØĆ ņŗØļÅäņĀĢļ¦źļźśņÖĆ Ēü░ ņŗØļÅäņĀĢļ¦źļźśļĪ£ ļČäļźśĒĢśņśĆĻ│Ā[15], ĒśĢĒā£ņŚÉ ļö░ļØ╝ņä£ļŖö ņŗØļÅä ņĀÉļ¦ē ņ£äļĪ£ ņĢĮĻ░ä ņ£ĄĻĖ░ļÉśņ¢┤ ņ׳ļŖö Ļ▓ĮņÜ░ļź╝ ņ×æņØĆ ņĀĢļ¦źļźś, ņé¼Ē¢ēņĀĢļ¦ź(tortuous vein)ņØś ĒśĢĒā£ļĪ£ ņ£ĄĻĖ░ļÉ£ ņĀĢļ¦źļźśĻ░Ć ņŗØļÅä ļé┤Ļ░ĢņØś 1/3 ļ»Ėļ¦īņØä ņ░©ņ¦ĆĒĢśļŖö Ļ▓ĮņÜ░ ņżæļō▒ļÅä ņĀĢļ¦źļźś, ņ£ĄĻĖ░ļÉ£ ņĀĢļ¦źļźśĻ░Ć ņŗØļÅä ļé┤Ļ░ĢņØś 1/3 ņØ┤ņāüņØĖ Ļ▓ĮņÜ░ļŖö Ēü░ ņĀĢļ¦źļźśļĪ£ ļéśļłäĻ│Ā ņĀüņāēņåīĻ▓¼ ļÅÖļ░ś ņ£Āļ¼┤ļÅä ĒĢ©Ļ╗ś ĻĖ░ņłĀĒĢśļÅäļĪØ ĒĢśņśĆļŗż[16]. ņØ╝ļ│Ėļ¼Ėļ¦źņĢĢĒĢŁņ¦äņ”ØĒĢÖĒÜīļŖö ņ£äņ╣ś(location), ĒśĢĒā£(form), ņāēņĪ░(color), ņĀüņāēņ¦ĢĒøä(red color sign) ņåīĻ▓¼ņŚÉ ļö░ļØ╝ ļČäļźśĒĢśņśĆļŗż. ņ£äņ╣śņŚÉ ļö░ļØ╝ ĒĢśļČĆ ņŗØļÅäņŚÉ ĻĄŁĒĢ£ļÉ£ ņĀĢļ¦źļźś(Li), ņżæļČĆņŗØļÅäĻ╣īņ¦Ć ņ¦äĒ¢ēļÉ£ ņĀĢļ¦źļźś(Lm), ņāüļČĆņŗØļÅäĻ╣īņ¦Ć ņŚ░Ļ▓░ļÉ£ ņĀĢļ¦źļźś(Ls)ļĪ£ ļéśļłäņŚłĻ│Ā, ĒśĢĒā£ĒĢÖņĀüņ£╝ļĪ£ļŖö ņ¦üņäĀ ņāüņ£╝ļĪ£ ņĢĮĻ░ä ņ£ĄĻĖ░ļÉ£ ņĀĢļ¦źļźś(F1), ņŚ╝ņŻ╝ņāü ņĀĢļ¦źļźś(F2), Ļ▓░ņĀłĒśĢ ņĀĢļ¦źļźś(F3)ļĪ£ ļČäļźśĒĢśņśĆļŗż. ļśÉĒĢ£ ņĀĢļ¦źļźśņØś ņāēņĪ░ņŚÉ ļö░ļØ╝ ļ░▒ņāē ņĀĢļ¦źļźś(Cw)ņÖĆ ņ▓Łņāē ņĀĢļ¦źļźś(Cb)ļĪ£ ļéśļłäĻ│Ā, ņĀüņāēņåīĻ▓¼ņØś ņĀĢļÅäņŚÉ ļö░ļØ╝ņä£ ņĀüņāēņåīĻ▓¼ ņŚåņØī(RC0), ņåīņłśņØś ņĀüņāēņåīĻ▓¼ļ¦ī ņ׳ļŖö Ļ▓ĮņÜ░(RC1), ņżæĻ░ä ņĀĢļÅäņØś ņĀüņāēņåīĻ▓¼ņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░(RC2)ņÖĆ ļŗżņłśņØś ņĀüņāēņåīĻ▓¼ņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░(RC3)ļĪ£ ļČäļźśĒĢśņśĆļŗż(Fig. 1) [17,18]. ļé┤ņŗ£Ļ▓Į ņåīĻ▓¼ņŚÉ ļö░ļźĖ ņĀĢļ¦źļźśņØś ļČäļźśļŖö Ēü¼ĻĖ░ņÖĆ ņĀüņāēņåīĻ▓¼ ļō▒ ĻĖēņä▒ ņČ£ĒśłņØś ņ£äĒŚśņØĖņ×ÉļōżņØä ĒżĒĢ©ĒĢśĻ│Ā ņ׳ņ¢┤ Ē¢źĒøä ņ╣śļŻī ļ░®ņ╣©ņØä Ļ▓░ņĀĢĒĢśĻ│Ā ņśłĒøäļź╝ ĒīÉņĀĢĒĢśļŖö ļŹ░ ļÅäņøĆņØ┤ ļÉ£ļŗż.
ĻĖēņä▒ ņĀĢļ¦źļźś ņČ£ĒśłņØĆ ĒÖ£ļÅÖņä▒ ņČ£Ēśł ņÖĖņŚÉļÅä ņĀĢļ¦źļźśļź╝ ļŹ«Ļ│Ā ņ׳ļŖö ĒśłņĢĪņØæĻ│Ā(clot)ļéś ņĀĢļ¦źļźś Ēæ£ļ®┤ņØś ļ░▒ņāē ņ£ĀļæÉ(whitish nipple) ņåīĻ▓¼ņØ┤ ļ│┤ņØ┤Ļ▒░ļéś ņĀĢļ¦źļźś ņÖĖ ļŗżļźĖ ņČ£ĒśłņØś ņøÉņØĖņØä ņ░ŠņØä ņłś ņŚåļŖö Ļ▓ĮņÜ░ņŚÉļÅä ņ¦äļŗ©ĒĢĀ ņłś ņ׳ļŗż(Fig. 2) [15]. ņŗØļÅäņĀĢļ¦źļźś ņČ£ĒśłņØĆ ņŚ░Ļ░ä 5%-15% ņĀĢļÅä ļ░£ņāØĒĢśļŖöļŹ░ Ēü¼ĻĖ░Ļ░Ć Ļ░Ćņן ņżæņÜöĒĢ£ ņśłņĖĪ ņØĖņ×ÉļĪ£ 5 mmĻ░Ć ļäśļŖö F2 ņØ┤ņāüņØś Ēü░ ņĀĢļ¦źļźśņŚÉņä£ļŖö 15%ņØś ļåÆņØĆ ņČ£ĒśłļźĀņØä ļ│┤ņØ┤Ļ│Ā, ņĀüņāēņ¦ĢĒøäĻ░Ć ļÅÖļ░śļÉśņŚłĻ▒░ļéś ļ╣äļīĆņāüņä▒ Ļ░äĻ▓Įļ│Ćņ”Ø(CHILD B/C)ņØĖ Ļ▓ĮņÜ░ņŚÉļÅä Ļ│Āņ£äĒŚśĻĄ░ņŚÉ ĒĢ┤ļŗ╣ĒĢ£ļŗż[16,19]. ņ¦Ćļé£ ņłśņŗŁ ļģäĻ░ä ņĀĢļ¦źļźś ņČ£ĒśłņŚÉ ļīĆĒĢ£ ņ╣śļŻīĻ░Ć ļ¦żņÜ░ ļ░£ņĀäĒĢśņśĆņØīņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ņĢäņ¦üĻ╣īņ¦ĆļÅä ņČ£Ēśł Ēøä 6ņŻ╝ ņØ┤ļé┤ņØś ņé¼ļ¦ØļźĀņØĆ 20%Ļ░Ć ļäśĻĖ░ ļĢīļ¼ĖņŚÉ[20-22] Ļ│Āņ£äĒŚśĻĄ░ ĒÖśņ×ÉņŚÉņä£ļŖö ņ┤łņČ£Ēśł ņśłļ░®ņØ┤ ļ░śļō£ņŗ£ ĒĢäņÜöĒĢśļŗż.
ņĀĢļ¦źļźśĻ░Ć ņŚåļŖö Ļ▓ĮņÜ░ņŚÉļŖö ņĀüņĀłĒĢ£ ļé┤ņŗ£Ļ▓Į ņČöņĀüĻ▓Ćņé¼ļ¦īņØä ņŗ£Ē¢ēĒĢśļ®┤ ļÉśņ¦Ćļ¦ī[23], Ēü¼ĻĖ░Ļ░Ć Ēü¼Ļ▒░ļéś ņĀüņāēņ¦ĢĒøäļź╝ ļ│┤ņØ┤ļŖö Ļ│Āņ£äĒŚś ņĀĢļ¦źļźśļ┐Éļ¦ī ņĢäļŗłļØ╝[24,25] ņ×æņØĆ ņĀĢļ¦źļźśņŚÉņä£ļÅä Ēü░ ņĀĢļ¦źļźśļĪ£ņØś ņ¦äĒ¢ēņØä ļŖ”ņČ£ ņłś ņ׳ņ¢┤ ņ┤łņČ£ĒśłņØä ņśłļ░®ĒĢśĻĖ░ ņ£äĒĢ┤ ļ╣äņäĀĒāØņĀü ļ▓ĀĒāĆņ░©ļŗ©ņĀ£ņØś ņśłļ░®ņĀüņØĖ Ēł¼ņŚ¼Ļ░Ć ĻČīĻ│ĀļÉśĻĖ░ļÅä ĒĢ£ļŗż[26]. PropranololņØ┤ļéś nadolol ļō▒ņØś ļ╣äņäĀĒāØņĀü ļ▓ĀĒāĆņ░©ļŗ©ņĀ£ņÖĆ ļé┤ņŗ£Ļ▓Į ņĀĢļ¦źļźś Ļ▓░ņ░░ņłĀ(endoscopic variceal ligation, EVL)ņØĆ ļæÉ ņ╣śļŻī Ļ░äņŚÉ ņŗØļÅäņĀĢļ¦źļźśņØś ņ┤łņČ£Ēśł ņśłļ░® ļ░Å ņé¼ļ¦ØļźĀņŚÉļŖö Ēü░ ņ░©ņØ┤Ļ░Ć ņŚåņ¢┤ ņČ£ĒśłņØś ņ£äĒŚśļÅäĻ░Ć ļåÆņØĆ ĒÖśņ×ÉņŚÉņä£ļŖö ĒÖśņ×ÉņØś ņāüĒā£ņÖĆ ņĢĮņĀ£ņŚÉ ļīĆĒĢ£ ĻĖłĻĖ░ ļ░Å ļČĆņ×æņÜ®Ļ│╝ ņł£ņØæļÅä ļō▒ņØä Ļ│ĀļĀżĒĢśņŚ¼ ņ╣śļŻīļ▓ĢņØä ņäĀĒāØĒĢśĻ│Ā[27-29], ņĀĆņ£äĒŚśĻĄ░ņŚÉņä£ļŖö ļ╣äņäĀĒāØņĀü ļ▓ĀĒāĆņ░©ļŗ©ņĀ£ļź╝ ļ©╝ņĀĆ Ēł¼ņŚ¼ĒĢśĻ│Ā ņł£ņØæļÅäĻ░Ć ļé«Ļ▒░ļéś ļČĆņ×æņÜ®ņØ┤ ņ׳ļŖö Ļ▓ĮņÜ░ EVLņØä ņŗ£Ē¢ēĒĢśļŖö Ļ▓āņØ┤ ņČöņ▓£ļÉ£ļŗż[16].
EVLņØĆ ļé┤ņŗ£Ļ▓Į ņäĀļ│äĻ▓Ćņé¼ļź╝ ĒĢśļ®┤ņä£ ļ░öļĪ£ ņŗ£Ē¢ēĒĢĀ ņłś ņ׳Ļ│Ā ĒŖ╣ļ│äĒĢ£ ĻĖłĻĖ░Ļ░Ć ņŚåņ£╝ļ®░ ļ╣äņäĀĒāØņĀü ļ▓ĀĒāĆņ░©ļŗ©ņĀ£ņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ ĒĢ®ļ│æņ”Ø ļ░£ņāØļ╣łļÅäĻ░Ć ļé«ņ£╝ļéś, Ļ│Āļ¼┤ļ░┤ļō£ņØś ĒāłļØĮņ£╝ļĪ£ ņØĖĒĢ£ ņŗØļÅä ĻČżņ¢æĻ│╝ ņČ£ĒśłņØĆ ņ╣śļ¬ģņĀüņØĖ ĒĢ®ļ│æņ”ØņØ┤ ļÉĀ ņłś ņ׳ļŗż. ņŗØļÅä ĻČżņ¢æņØĆ 0.5%-3%Ļ╣īņ¦Ć ļ░£ņāØĒĢśļŖöļŹ░[30,31] ņ¢æņä▒ņ×ÉĒÄīĒöäņ¢ĄņĀ£ņĀ£(proton pump inhibitor, PPI)ņØś Ēł¼ņŚ¼ļŖö ĻČżņ¢æņØś Ēü¼ĻĖ░ļź╝ Ļ░Éņåīņŗ£ĒéżĻ│Ā ņČ£ĒśłņØä ņżäņØ╝ ņłś ņ׳ņ¦Ćļ¦ī[32-34] PPIļź╝ Ēł¼ņŚ¼ ļ░øņØĆ ĒÖśņ×ÉņŚÉņä£ Ļ░äņä▒ļćīņ”ØĻ│╝ ņ×Éļ░£ņä▒ ņäĖĻĘĀņä▒ ļ│Ąļ¦ēņŚ╝ņØś ņ£äĒŚśļÅäĻ░Ć ņ”ØĻ░ĆĒĢśļŖöļŹ░[35], ĒŖ╣Ē׳ Ļ░äņä▒ ļćīņ”ØņØś Ļ▓ĮņÜ░ ņé¼ņÜ® ĻĖ░Ļ░äņØ┤ 1-4Ļ░£ņøö, 4-12Ļ░£ņøö, 12Ļ░£ņøö ņØ┤ņāüņØä ļ╣äĻĄÉĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ ņé¼ņÜ® ĻĖ░Ļ░äņŚÉ ļö░ļØ╝ ņ£äĒŚśļÅäĻ░Ć ņ”ØĻ░ĆĒĢśņśĆļŗż[36]. ļśÉĒĢ£ ņĄ£ĻĘ╝ 7ņØ╝ ņØ┤ļé┤ PPIļź╝ Ēł¼ņŚ¼ĒĢ£ ĒÖśņ×ÉĻĄ░Ļ│╝ 3Ļ░£ņøö ņØ┤ļé┤ ņé¼ņÜ®ĒĢ£ ņĀüņØ┤ ņŚåļŖö ĒÖśņ×ÉĻĄ░ņØä ļ╣äĻĄÉĒĢśņśĆņØä ļĢī ņ×Éļ░£ņä▒ ļ│Ąļ¦ēņŚ╝ņØś ļ░£ņāØņØ┤ ņ”ØĻ░ĆĒĢśņśĆļŗż[37]. ļö░ļØ╝ņä£ Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņŚÉņä£ PPIļź╝ ņé¼ņÜ®ĒĢĀ ļĢīļŖö ņé¼ņÜ® ļ¬®ņĀüņŚÉ ļ¦×Ļ▓ī Ļ░ĆļŖźĒĢ£ ņĄ£ņåī ĻĖ░Ļ░äņØä ņé¼ņÜ®ĒĢśĻ│Ā ņןĻĖ░Ļ░ä ņ¦ĆņåŹņĀüņ£╝ļĪ£ Ēł¼ņŚ¼ĒĢĀ ļĢīļŖö Ļ░äņä▒ ļćīņ”ØņØ┤ļéś ņ×Éļ░£ņä▒ ļ│Ąļ¦ēņŚ╝ ļ░£ņāØ ņ£Āļ¼┤ļź╝ ņŻ╝ņØś Ļ╣ŖĻ▓ī Ļ┤Ćņ░░ĒĢ┤ņĢ╝ ĒĢ£ļŗż.
ņŗØļÅäņĀĢļ¦źļźśĻ░Ć ņŚåņ¢┤ņ¦ĆĻ▒░ļéś Ļ▓░ņ░░ĒĢĀ ņłś ņŚåņØä ņĀĢļÅäļĪ£ ļ¦żņÜ░ ņ×æņĢäņ¦ĆļŖö Ļ▓ĮņÜ░ ņĀĢļ¦źļźśĻ░Ć ņåīņŗżļÉśņŚłļŗżĻ│Ā ĒīÉļŗ©ĒĢ£ļŗż. ņ┤łņČ£Ēśł ņśłļ░®ņØä ņ£äĒĢ┤ 1-2ņŻ╝ Ļ░äĻ▓®ņ£╝ļĪ£ ņĀĢļ¦źļźśĻ░Ć ņåīņŗżļÉĀ ļĢīĻ╣īņ¦Ć ļé┤ņŗ£Ļ▓Į ņĀĢļ¦źļźś Ļ▓░ņ░░ņłĀņØä ņŗ£Ē¢ēĒĢśļÅäļĪØ ĻČīĻ│ĀļÉśņŚłļŖöļŹ░[16] ļé┤ņŗ£Ļ▓Į Ļ▓░ņ░░ņłĀņØä ņŗ£Ē¢ēĒĢ£ 63ļ¬ģņØś ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ Ļ▓®ņŻ╝ļĪ£ ņ×¼Ļ▓░ņ░░ņØä ņŗ£Ē¢ēĒĢ£ ĻĄ░Ļ│╝ Ļ▓®ņøöļĪ£ ņŗ£Ē¢ēĒĢ£ ĻĄ░ņØä ļ╣äĻĄÉĒĢśņśĆņØä ļĢī Ļ▓®ņŻ╝ļĪ£ ņŗ£Ē¢ēĒĢ£ ĻĄ░ņŚÉņä£ 3ņ░©ļĪĆņØś Ļ▓░ņ░░ Ēøä ņĀĢļ¦źļźśĻ░Ć ļŹö ļ¦ÄņØ┤ ņåīņŗżļÉśņŚłĻ│Ā ņØ┤Ēøä ņ×¼ļ░£ļźĀņØ┤ ļé«ņĢśļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłļŗż[38]. ĻĘĖļ¤¼ļéś ņØ┤Ēøä 1-8ņŻ╝ņØś ļŗżņ¢æĒĢ£ Ļ░äĻ▓®ņ£╝ļĪ£ ņŗ£Ē¢ēĒĢ£ ņŚ░ĻĄ¼ļōżņØś Ļ▓░Ļ│╝ļź╝ ļ░öĒāĢņ£╝ļĪ£[39-45] Ēśäņ×¼ļŖö 2-8ņŻ╝ Ļ░äĻ▓®ņ£╝ļĪ£ ņ×¼Ļ▓░ņ░░ņØä ņŗ£Ē¢ēĒĢśĻ│Ā ņĀĢļ¦źļźśĻ░Ć ņåīņŗżļÉ£ ņØ┤ĒøäņŚÉļŖö 6Ļ░£ņøö ņØ┤ļé┤ ņ×¼ĒÅēĻ░Ć Ēøä 6-12Ļ░£ņøö Ļ░äĻ▓®ņ£╝ļĪ£ ļé┤ņŗ£Ļ▓Į ņČöņĀü Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśļÅäļĪØ ĻČīĻ│ĀĒĢśĻ│Ā ņ׳ļŗż[25,43,46].
ļ¬©ļōĀ ņ£äņןĻ┤Ć ņČ£ĒśłĻ│╝ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ ņĀĢļ¦źļźś ņČ£ĒśłņŚÉ ņ׳ņ¢┤ņä£ļÅä ĒśłņŚŁĒĢÖņĀü ņĢłņĀĢĻ│╝ ĒśĖĒØĪ ņ£Āņ¦ĆĻ░Ć ļ¼┤ņŚćļ│┤ļŗżļÅä ņżæņÜöĒĢśļŗż. ĻĘĖļ¤¼ļéś Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņŚÉņä£ Ļ│╝ļÅäĒĢ£ ņłśņĢĪņØś Ļ│ĄĻĖēņØĆ ņśżĒ׳ļĀż ļ¼Ėļ¦źņĢĢ ĒĢŁņ¦äņØä ņ£Āļ░£ĒĢśņŚ¼ ņĀĢļ¦źļźś ņČ£ĒśłņØä ņĢģĒÖöņŗ£Ēé¼ ņłś ņ׳ņ£╝ļ»ĆļĪ£ ņŻ╝ņØśĒĢ┤ņĢ╝ ĒĢ£ļŗż. ĻĖēņä▒ ņ£äņןĻ┤Ć ņČ£ĒśłņØś Ļ▓ĮņÜ░ ĒŚżļ¬©ĻĖĆļĪ£ļ╣łņØ┤ 7 g/dL ļ»Ėļ¦ī ņŗ£ņŚÉļ¦ī ļåŹņČĢ ņĀüĒśłĻĄ¼ ņłśĒśłņØä ĒĢśļŖö ņĀ£ĒĢ£ņĀü ņłśĒśłņØ┤ ĻČīĻ│ĀļÉśļŖöļŹ░ ĻĖēņä▒ ņĀĢļ¦źļźś ņČ£ĒśłņŚÉņä£ļÅä ņØ┤ ĻĖ░ņżĆņŚÉ ļö░ļØ╝ ņłśĒśłĒĢśņŚ¼ ĒŚżļ¬©ĻĖĆļĪ£ļ╣ł ņłśņ╣śļź╝ 7-9 g/dL ņĀĢļÅäļĪ£ ņ£Āņ¦ĆĒĢśļŖö ņĀ£ĒĢ£ņĀü ņłśĒśłņØĆ ņé¼ļ¦ØļźĀĻ│╝ ņłśĒśłļĪ£ ņØĖĒĢ£ ļČĆņ×æņÜ®ņØä Ļ░Éņåīņŗ£Ēé©ļŗż[50]. ņĢäņÜĖļ¤¼ ņŚ░ņןļÉ£ ĒöäļĪ£ĒŖĖļĪ¼ļ╣ł ņŗ£Ļ░äĻ│╝ Ļ░ÉņåīļÉ£ ĒśłņåīĒīÉ ņłśņ╣śļź╝ ĻĄÉņĀĢĒĢśĻĖ░ ņ£äĒĢ£ ņŗĀņäĀļÅÖĻ▓░ĒśłņןņØ┤ļéś ĒśłņåīĒīÉ ņłśĒśłņØĆ ņČ£Ēśł Ļ▓ĮĒ¢źņØä ĻĄÉņĀĢĒĢśļŖö ļŹ░ ĒÜ©Ļ│╝Ļ░Ć ļ¬ģĒÖĢĒ׳ ņ×ģņ”ØļÉśņ¦Ć ņĢŖĻ│Ā ņśżĒ׳ļĀż ļ¼Ėļ¦źņĢĢ ĒĢŁņ¦äņØä ņĢģĒÖöņŗ£Ēé¼ ņłś ņ׳ņ¢┤ ņØ╝ļ░śņĀüņ£╝ļĪ£ ĻČīņןļÉśņ¦Ć ņĢŖļŖöļŗż.
ņśłļ░®ņĀü ĒĢŁņāØņĀ£ļŖö ņäĖĻĘĀ Ļ░ÉņŚ╝ņØä ņżäņØ┤Ļ│Ā ņ×¼ņČ£Ēśł ļ░Å ņé¼ļ¦ØļźĀņØä Ļ░Éņåīņŗ£Ēéżļ»ĆļĪ£ Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņŚÉņä£ ĻĖēņä▒ ņ£äņןĻ┤Ć ņČ£ĒśłņØ┤ ņØśņŗ¼ļÉśļ®┤ ļé┤ņøÉ ļŗ╣ņŗ£ļČĆĒä░ ļ░öļĪ£ Ēł¼ņŚ¼ĒĢ┤ņĢ╝ ĒĢśļŖöļŹ░ 7ņØ╝ ņØ┤ļé┤ņØś 1ņØ╝ 1 gņØś ceftriaxone ņĀĢļ¦ź ļé┤ Ēł¼ņŚ¼Ļ░Ć ĻČīņןļÉśĻ│Ā ņ׳ļŗż[51,52]. Terlipressin, somatostatin, octreotide ļō▒ņØś ĒśłĻ┤ĆĒÖ£ņä▒ņĢĮļ¼╝ņØĆ ļé┤ņןĻĖ░Ļ┤Ćņ£╝ļĪ£ ņ£Āņ×ģļÉśļŖö Ēśłļźśļ¤ēņØä ņżäņŚ¼ ļ¼Ėļ¦źņĢĢņØä Ļ░Éņåīņŗ£Ēé┤ņ£╝ļĪ£ņŹ© ņ¦ĆĒśł ņä▒Ļ│ĄļźĀņØä Ē¢źņāüņŗ£ĒéżĻ│Ā ņé¼ļ¦ØļźĀņØä ņżäņØ┤ļ»ĆļĪ£[53,54] ļé┤ņøÉ ņŗ£ ļ░öļĪ£ Ēł¼ņŚ¼ļź╝ ņŗ£ņ×æĒĢśĻ│Ā 3-5ņØ╝ ņĀĢļÅä ņ¦ĆņåŹĒĢśļÅäļĪØ ĻČīņןļÉśĻ│Ā ņ׳ļŗż[24,25]. ĒśłņĢĪņØś ĒØĪņØĖņØä ļ¦ēĻĖ░ ņ£äĒĢ┤ ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ ņŗ£Ē¢ē ņĀä ĻĖ░Ļ┤Ć ļé┤ ņéĮĻ┤ĆļÅä ņŗ£Ē¢ēĒĢĀ ņłś ņ׳ņ£╝ļéś ļ¦ÄņØĆ ņŚ░ĻĄ¼ņŚÉņä£ ĻĖ░Ļ┤Ć ļé┤ ņéĮĻ┤ĆņØä ņŗ£Ē¢ēĒĢ£ ĒÖśņ×ÉĻĄ░ņŚÉņä£ ņśłĒøäĻ░Ć ļŹö ļČłļ¤ēĒĢśņŚ¼ Ļ░äņä▒ ļćīņ”Ø ļō▒ņ£╝ļĪ£ ņ×Éļ░£ņĀüņØĖ ĻĖ░ļÅä ņ£Āņ¦ĆĻ░Ć ņ¢┤ļĀĄļŗżĻ│Ā ĒīÉļŗ©ļÉśļŖö Ļ▓ĮņÜ░ņŚÉ ĒĢ£ĒĢ┤ ņŗĀņżæĒ׳ Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢ£ļŗż.
ĻĖēņä▒ ņĀĢļ¦źļźś ņČ£ĒśłņØ┤ ņØśņŗ¼ļÉśļŖö Ļ▓ĮņÜ░ņŚÉļŖö ĒśłņŚŁĒĢÖņĀüņ£╝ļĪ£ ļ¦żņÜ░ ļČłņĢłņĀĢĒĢ£ ņČ£Ēśł ĒÖśņ×ÉņŚÉ ņżĆĒĢ┤ ļ╣ĀļźĖ ņŗ£Ļ░ä ļé┤ņŚÉ ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņŚ¼ ņĀĢļ¦źļźś ņČ£Ēśł ņ£Āļ¼┤ļź╝ ĒÖĢņØĖĒĢśņŚ¼ ļé┤ņŗ£Ļ▓Į ņ¦ĆĒśłņłĀņØä ņŗ£Ē¢ēĒĢ┤ņĢ╝ ĒĢśļŖöļŹ░ Ļ░ĆļŖźĒĢ£ ļé┤ņøÉ 12ņŗ£Ļ░ä ņØ┤ļé┤ ņĪ░ĻĖ░ ņŗ£Ē¢ēņØä ĻČīņןĒĢ£ļŗż[16]. ĻĖēņä▒ ņŗØļÅäņĀĢļ¦źļźś ņČ£ĒśłņŚÉņä£ļŖö EVLņØ┤ ņØ╝ņ░©ņĀüņØĖ Ēæ£ņżĆ ņ╣śļŻīļĪ£ ĻČīĻ│ĀļÉśĻ│Ā ņ׳ļŗż. ļé┤ņŗ£Ļ▓Į ņäĀļŗ©ļČĆņŚÉ Ļ│Āļ¼┤ ļ░┤ļō£Ļ░Ć ņןņ░®ļÉ£ Ēł¼ļ¬ģ ņ║Ī ĒśĢĒā£ņØś Ļ▓░ņ░░ ņןņ╣śļź╝ Ļ▒░ņ╣śĒĢ£ Ēøä ņĀĢļ¦źļźśņŚÉ ņĀæĻĘ╝ņŗ£Ēé© Ēøä ņĀĢļ¦źļźśļź╝ Ļ▓░ņ░░ ņןņ╣ś ņĢłņ£╝ļĪ£ ņČ®ļČäĒ׳ ĒØĪņØĖĒĢśņŚ¼ ļüīņ¢┤ļō£ļ”░ Ēøä Ļ│Āļ¼┤ ļ░┤ļō£ļź╝ ļ░£ņé¼ĒĢśņŚ¼ Ļ▓░ņ░░ĒĢśļŖöļŹ░ ņØ┤ļĢī ņĀĢļ¦źļźśņÖĆ Ļ│Āļ¼┤ļ░┤ļō£Ļ░Ć ņןņ░®ļÉ£ Ēł¼ļ¬ģ ņ║ĪņØ┤ ļäłļ¼┤ ļ░Ćņ░®ļÉśņ¢┤ ņ׳ņ£╝ļ®┤ ņĀĢļ¦źļźśĻ░Ć ņל ĒØĪņ×ģļÉśņ¦Ć ņĢŖĻĖ░ ļĢīļ¼ĖņŚÉ ņĀĢļ¦źļźśņÖĆ ņ║Ī ņé¼ņØ┤Ļ░Ć ļäłļ¼┤ ļ░Ćņ░®ļÉśņ¦Ć ņĢŖņØĆ ņāüĒā£ņŚÉņä£ ĒØĪņØĖņØä ĒĢ┤ņĢ╝ ĒĢ£ļŗż. ņČ£Ēśłņ¢æņØ┤ ļ¦ÄņĢä ņĀĢĒÖĢĒĢ£ ņČ£ĒśłņĀÉņØä ĒÖĢņØĖĒĢśĻĖ░ ņ¢┤ļĀżņÜĖ ļĢīļŖö ņČ£ĒśłņØ┤ ņ׳ļŖö ņĀĢļ¦źļźśņØś ņøÉņ£äļČĆņŚÉņä£ Ļ▓░ņ░░ņØä ņŗ£Ē¢ēĒĢśļ®┤ ņČ£Ēśłļ¤ēņØ┤ ņżäņ¢┤ļōżņ¢┤ ņČ£ĒśłņĀÉņØä ņēĮĻ▓ī ņ░ŠņØä ņłśļÅä ņ׳ļŗż. ņČ£Ēśł ļČĆņ£äņŚÉ ļīĆĒĢ£ Ļ▓░ņ░░ ĒøäņŚÉļŖö ņĀĢļ¦źļźśļź╝ ņåīņŗżņŗ£ņ╝£ ņ×¼ņČ£ĒśłņØä ņśłļ░®ĒĢśĻĖ░ ņ£äĒĢ┤ ļé©ņĢä ņ׳ļŖö ļŗżļźĖ ņĀĢļ¦źļźśļōżļÅä Ļ░ĆļŖźĒĢ£ Ļ▓░ņ░░ĒĢ£ļŗż(Fig. 3). 5% Ethanolamine oleate, sodium morrhuateņÖĆ Ļ░ÖņØĆ Ļ▓ĮĒÖöņĀ£ļź╝ ņØ┤ņÜ®ĒĢ£ ļé┤ņŗ£Ļ▓Į ņŻ╝ņé¼Ļ▓ĮĒÖöņÜöļ▓Ģ(endoscopic injection sclerotherapy, EIS)ņØĆ Ļ▓ĮĒÖöņĀ£ļź╝ ņĀĢļ¦źļźśņŚÉ ļ░öļĪ£ ņŻ╝ņ×ģĒĢśĻ▒░ļéś ņŻ╝ļ│Ćņ£╝ļĪ£ ņŻ╝ņ×ģĒĢśļŖö Ļ▓ĮņÜ░ļÅä ņ׳ļŗż. 90%ņØś ņ¦ĆĒśł ņä▒Ļ│ĄļźĀņØä ļ│┤ņØ┤ņ¦Ćļ¦ī ļ░£ņŚ┤, ņ▓£ņ×ÉļĪ£ ņØĖĒĢ£ ņČ£Ēśł, ņŗØļÅäņØś ĻČżņ¢æ ļ░Å ņ¦ĆņŚ░ņä▒ ņČ£Ēśł, Ēśæņ░® ļ░Å ņ▓£Ļ│Ą, ņóģĻ▓®ļÅÖņŚ╝, ĻĖ░Ļ┤Ćņ¦ĆņŗØļÅäļźś, Ļ░ÉņŚ╝ ļō▒ ļŗżņ¢æĒĢ£ ĒĢ®ļ│æņ”ØņØ┤ ļ░£ņāØĒĢĀ ņłś ņ׳Ļ│Ā, 5% ethanolamine oleateļŖö ļŗżļ¤ē Ēł¼ņŚ¼ ņŗ£ ņÜ®Ēśłņ×æņÜ®ņ£╝ļĪ£ ņØĖĒĢ┤ ĒŚżļ¬©ĻĖĆļĪ£ļ╣łļć©ņÖĆ ņŗĀļČĆņĀäņØ┤ ļ░£ņāØĒĢĀ ņłś ņ׳ņ¢┤ Ēł¼ņŚ¼ ņÜ®ļ¤ēņØä 0.4 mL/kgņØ┤ ļäśņ¦Ć ņĢŖļÅäļĪØ ņŻ╝ņØśĒĢ┤ņä£ ņé¼ņÜ®ĒĢ┤ņĢ╝ ĒĢ£ļŗż. EVLņØ┤ EISņŚÉ ļ╣äĒĢ┤ ļŹö ļ╣Āļź┤Ļ▓ī ņĀĢļ¦źļźśļź╝ ņåīņŗżņŗ£ĒéżĻ│Ā ņ×¼ņČ£ĒśłļźĀņØ┤ ļé«Ļ│Ā ļČĆņ×æņÜ®ņØ┤ ņĀüņ£╝ļ®░ ņāØņĪ┤ņ£©ņØ┤ ļåÆļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņ¢┤ Ēśäņ×¼ EISļŖö ņŗØļÅäņĀĢļ¦źļźś ņČ£ĒśłņØś ņØ╝ņ░©ņ╣śļŻīļĪ£ļŖö ĻČīņןĒĢśņ¦Ć ņĢŖĻ│Ā EVLņØ┤ ņŗżĒī©ĒĢśĻ▒░ļéś Ļ▓░ņ░░ņłĀņØä ņŗ£Ē¢ēĒĢĀ ņłś ņŚåļŖö Ļ▓ĮņÜ░ņŚÉ ņŗ£Ē¢ēĒĢśļÅäļĪØ ĻČīĻ│ĀĒĢśĻ│Ā ņ׳ļŗż[30,55-62]. ĻĖēņä▒ ņĀĢļ¦źļźś ņČ£Ēśł ĒÖśņ×ÉņŚÉņä£ ļé┤ņøÉ 2ņŗ£Ļ░ä ņØ┤ļé┤ ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņŚ¼ ņ¦ĆĒśłļČäļ¦ÉņØä ļÅäĒżĒĢ£ Ēøä ļé┤ņøÉ 12-24ņŗ£Ļ░ä ļé┤ņŚÉ EVLņØ┤ļéś ļé┤ņŗ£Ļ▓Į ņĀĢļ¦źļźś ĒÅÉņćäņłĀ(endoscopic variceal obturation, EVO)ņØä ņŗ£Ē¢ēĒĢ£ Ļ▓ĮņÜ░ ļīĆņĪ░ĻĄ░Ļ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ņ¦ĆĒśłļźĀņØä ļåÆņØ┤Ļ│Ā ņé¼ļ¦ØļźĀņØĆ ļé«ņČöņŚłļŗżĻ│Ā ļ│┤Ļ│ĀļÉśĻĖ░ļÅä ĒĢśņśĆņ£╝ļéś ņ¦ĆĒśłļČäļ¦É(hemostatic powder)ņØś ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ┤ņä£ļŖö Ē¢źĒøä ņČöĻ░ĆņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż[63].
ļé┤ņŗ£Ļ▓Į ņ¦ĆĒśłņłĀņØ┤ ņŗżĒī©ĒĢ£ Ļ▓ĮņÜ░ ĻĄ¼ņĀ£ņÜöļ▓Ģņ£╝ļĪ£ ļ¬®ņĀĢļ¦źĻ▓Įņ£ĀĻ░äļé┤ļ¼Ėļ¦źņĀäņŗĀņł£ĒÖśņģśĒŖĖ(transjugular intrahepatic portosystemic shunt, TIPS)ļź╝ ņŗ£Ē¢ēĒĢśļŖöļŹ░ 90%ņØś ļåÆņØĆ ņ¦ĆĒśł ņä▒Ļ│ĄļźĀņØä ļ│┤ņśĆļŗż[64]. ĻĄ¼ņĀ£ņÜöļ▓Ģ ņŗ£Ē¢ē ņĀä ņČ£Ēśłņ¢æņØ┤ ļ¦ÄņĢä ĒśłņŚŁĒĢÖņĀüņ£╝ļĪ£ ļČłņĢłņĀĢĒĢ£ Ļ▓ĮņÜ░ņŚÉļŖö Ļ░ĆĻĄÉņ╣śļŻīļĪ£ S-B ĒŖ£ļĖī(Sengstaken-Blakemore tube) ļō▒ņØä ņØ┤ņÜ®ĒĢ£ ĒÆŹņäĀ ĒāÉĒÅ░ ņéĮņ×ģņłĀļź╝ ņŗ£Ē¢ēĒĢśļŖöļŹ░ 80%-90%ņŚÉņä£ ņ¦ĆĒśłņØ┤ ļÉśņ¦Ćļ¦ī65 ĒāÉĒÅ░ ņĀ£Ļ▒░ Ēøä ņ×¼ņČ£Ēśł ņ£äĒŚśļÅäĻ░Ć ļåÆĻ│Ā ņŗØļÅä ĒīīņŚ┤ ļō▒ņØś ņŗ¼Ļ░üĒĢ£ ĒĢ®ļ│æņ”ØņØä ņ£Āļ░£ĒĢĀ ņłś ņ׳ņ¢┤ 24ņŗ£Ļ░ä ņØ┤ļé┤ TIPS ļō▒ņØä ņŗ£Ē¢ēĒĢ┤ņĢ╝ ĒĢ£ļŗż[66]. ņ×ÉĻ░ĆĒīĮņ░ĮĒśĢ ĻĖłņåŹņŖżĒģÉĒŖĖļÅä Ļ░ĆĻĄÉņ╣śļŻīļĪ£ ņé¼ņÜ®ĒĢĀ ņłś ņ׳ļŖöļŹ░ ĒÆŹņäĀ ĒāÉĒÅ░ ņéĮņ×ģļ▓ĢĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ņé¼ļ¦ØļźĀņØś ņ░©ņØ┤ļŖö ņŚåņŚłņ£╝ļéś ņ¦ĆĒśłļźĀņØ┤ ņØśļ»Ė ņ׳Ļ▓ī ļåÆņĢśĻ│Ā ļČĆņ×æņÜ®ņØś ļ░£ņāØņØĆ ņĀüņ£╝ļ®░ ĻĄ¼ņĀ£ņÜöļ▓Ģ ņŗ£Ē¢ē ņĀäĻ╣īņ¦Ć ņóĆ ļŹö ĻĖ┤ ĻĖ░Ļ░äļÅÖņĢł ņé¼ņÜ®ĒĢĀ ņłś ņ׳ļŖö ņןņĀÉņØ┤ ņ׳ļŗż[67].
ņŗØļÅäņĀĢļ¦źļźśņØś ņ×¼ņČ£ĒśłņØĆ ņ┤łņČ£Ēśł ņØ┤Ēøä 6ņŻ╝ ļé┤ņŚÉ 50% [68], 2ļģä ņØ┤ļé┤ 60% ņĀĢļÅäņŚÉņä£ ļ░£ņāØĒĢśĻ│Ā[10,69,70] 20%-40%ņØś ļåÆņØĆ ņé¼ļ¦ØļźĀņØ┤ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ņ¢┤ ņ×¼ņČ£ĒśłņØä ņśłļ░®ĒĢśļŖö Ļ▓āņØ┤ ņżæņÜöĒĢśļŗż[71]. ļ╣äņäĀĒāØņĀü ļ▓ĀĒāĆņ░©ļŗ©ņĀ£ Ēł¼ņŚ¼ņÖĆ EVLņØä ļ╣äĻĄÉĒĢśņśĆņØä ļĢī ļŗ©ļÅģ ņÜöļ▓Ģņ£╝ļĪ£ ņé¼ņÜ® ņŗ£ ļæÉ ņ╣śļŻīļ▓Ģ Ļ░ä ņ×¼ņČ£ĒśłļźĀņØś ņ░©ņØ┤ļŖö ņŚåņŚłņ¦Ćļ¦ī[28,72,73] ļæÉ ņ╣śļŻīļź╝ ĒĢ©Ļ╗ś ņŗ£Ē¢ēĒĢ£ Ļ▓ĮņÜ░ Ļ░üĻ░üņØś ļŗ©ļÅģ ņÜöļ▓ĢņŚÉ ļ╣äĒĢ┤ ņ×¼ņČ£Ēśł ļ░£ņāØņØ┤ ņżäņ¢┤ļōĀļŗżĻ│Ā ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ņ¢┤ ļ│æĒĢ®ņÜöļ▓ĢņØ┤ ņĀĢļ¦źļźśņØś ņØ┤ņ░© ņśłļ░®ļź╝ ņ£äĒĢ┤ Ļ░Ćņן ņĀüņĀłĒĢ£ ņØ╝ņ░©ņ╣śļŻīļĪ£ ņČöņ▓£ļÉśĻ│Ā ņ׳ļŗż[74,75]. ņ×¼ņČ£Ēśł ņśłļ░®ņØä ņ£äĒĢ£ Ļ▓░ņ░░ ņŻ╝ĻĖ░ļŖö ņØ╝ņ░© ņśłļ░®Ļ│╝ Ļ░ÖņØ┤ 1-2ņŻ╝ Ļ░äĻ▓®ņØ┤ ĻČīĻ│ĀļÉśņŚłĻ│Ā[16] ĒÅēĻĘĀ 2-4ĒÜī ņĀĢļÅäņØś ņČöĻ░Ć Ļ▓░ņ░░ņØä ņŗ£Ē¢ēĒĢ£ Ēøä ņĀĢļ¦źļźśĻ░Ć ņåīņŗżļÉśņŚłļŖöļŹ░[76] Harewood ļō▒[77]ņØś ņŚ░ĻĄ¼ņŚÉ ļö░ļź┤ļ®┤ 2ņŻ╝ ņØ┤ļé┤ļĪ£ Ļ▓░ņ░░ ņŻ╝ĻĖ░Ļ░Ć ņ¦¦ņØĆ ĒÖśņ×ÉĻĄ░ņŚÉņä£ ņśżĒ׳ļĀż ņ×¼ņČ£ĒśłņØ┤ ļŹö ļ¦ÄņØ┤ ļ░£ņāØĒĢśņśĆĻ│Ā ņŚ░ļĀ╣, ņä▒ļ│ä, Ļ░äĻĖ░ļŖź ņāüĒā£ļź╝ ļ│┤ņĀĢĒ¢łņØä ļĢī 3ņŻ╝ ņØ┤ņāüņØś Ļ░äĻ▓®ņ£╝ļĪ£ Ļ▓░ņ░░ĒĢ£ ĻĄ░ņŚÉņä£ ņ×¼ņČ£ĒśłņØ┤ ņĀüņ¢┤ 2ņ░© ņśłļ░®ņØä ņ£äĒĢ£ EVLļÅä 1-8ņŻ╝ ņĀĢļÅä Ļ░äĻ▓®ņØä ļæÉĻ│Ā ņŗ£Ē¢ēĒĢśļŖö Ļ▓āņØ┤ ņĀüņĀłĒĢśļŗżĻ│Ā ĒīÉļŗ©ļÉ£ļŗż[60].
TIPSļŖö ļ╣äņäĀĒāØņĀü ļ▓ĀĒāĆņ░©ļŗ©ņĀ£ņÖĆ EVLņØś ļ│æĒĢ®ņÜöļ▓ĢĻ│╝ ļ╣äĻĄÉĒĢśņŚ¼ ņ×¼ņČ£ĒśłļźĀņØ┤ ļé«ņĢśņ¦Ćļ¦ī Ļ░äņä▒ ļćīņ”Ø ļō▒ ĒĢ®ļ│æņ”Øņ£╝ļĪ£ ņØĖĒĢ┤ ņØ╝ņ░©ņ╣śļŻīļĪ£ ĻČīņןļÉśņ¦ĆļŖö ņĢŖĻ│Ā ļ│æĒĢ®ņÜöļ▓ĢņØä ņŗ£Ē¢ēĒĢ©ņŚÉļÅä ņ×¼ņČ£ĒśłņØ┤ ļ░£ņāØĒĢ£ Ļ▓ĮņÜ░ ĻĄ¼ņĀ£ņÜöļ▓Ģņ£╝ļĪ£ ņŗ£Ē¢ēļÉ£ļŗż[68,78]. ņØ┤ļ¤¼ĒĢ£ ņŚ¼ļ¤¼ ņ╣śļŻīļ▓ĢņŚÉļÅä ņŗØļÅäņĀĢļ¦źļźś ņČ£ĒśłņØ┤ ņ×¼ļ░£ĒĢśļŖö Ļ▓ĮņÜ░ņŚÉļŖö Ļ░äņØ┤ņŗØņØä Ļ│ĀļĀż ĒĢ┤ņĢ╝ ĒĢ£ļŗż[79,80].
ņ£äņĀĢļ¦źļźśļŖö ņŗØļÅäņĀĢļ¦źļźśņØś ļÅÖļ░ś ņ£Āļ¼┤ņŚÉ ļö░ļØ╝ ņ£äņŗØļÅäņĀĢļ¦źļźś(gastoesophageal varices, GOV)ņÖĆ ļŗ©ļÅģ ņ£äņĀĢļ¦źļźś(isolated gastric varices, IGV)ļĪ£ ļéśļłäĻ│Ā ņĀĢļ¦źļźśņØś ņ£äņ╣śņŚÉ ļö░ļØ╝ ņäĖļČäĒÖö ĒĢ£ļŗż. GOVļŖö ņ£ä ņåīļ¦īņØä ļö░ļØ╝ ļ░£ņāØĒĢ£ GOV1Ļ│╝ ņ£ä ņĀĆļČĆņŚÉ ņ£äņ╣śĒĢ£ GOV2ļĪ£ ņäĖļČäļÉ£ļŗż. ņ£äņĀĆļČĆņŚÉ ļ░£ņāØĒĢ£ IGVļŖö IGV1, ĻĘĖ ņÖĖ ļŗżļźĖ ļČĆņ£äņŚÉņä£ Ļ┤Ćņ░░ļÉśļŖö Ļ▓ĮņÜ░ļź╝ IGV2ļĪ£ ļČäļźśĒĢ£ļŗż. IGV1ņØś Ļ▓ĮņÜ░ Ļ░äĻ▓Įļ│Ćņ”Ø ņÖĖņŚÉļÅä ņĘīņן ņ¦łĒÖśņŚÉ ņØśĒĢ£ ļ╣äņןņĀĢļ¦źņØś ĒśłņĀäņ”Øņ£╝ļĪ£ ņØĖĒĢ┤ņä£ļÅä ļ░£ņāØĒĢĀ ņłśļÅä ņ׳ļŗż. ļ░£ņāØ ļ╣łļÅäļź╝ ļ│┤ļ®┤ GOV1ņØ┤ 70%ļź╝ ņ░©ņ¦ĆĒĢśĻ│Ā GOV2Ļ░Ć 21%, IGV1ņØ┤ 7% ņĀĢļÅäļĪ£ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳Ļ│Ā ņČ£Ēśł ļ╣łļÅäļŖö IGV1ņØ┤ 78%ļĪ£ Ļ░Ćņן ļåÆĻ│Ā GOV2Ļ░Ć 55%ņØĖļŹ░ ļ░śĒĢ┤ GOV1Ļ│╝ IGV2ļŖö 10% ņĀĢļÅäņØ┤ļŗż[81]. ņ£äņĀĢļ¦źļźśļŖö ņŗØļÅäņĀĢļ¦źļźśņŚÉ ļ╣äĒĢ┤ ļ░£ņāØ ļ╣łļÅäļŖö ļé«ņ¦Ćļ¦ī ņĀĢļ¦źļźśĻ░Ć Ēü¼Ļ│Ā ņĀÉļ¦ēĒĢśņĖĄņŚÉ ļŹö Ļ╣ŖĻ▓ī ņ£äņ╣śĒĢśļ®░ Ēü░ ņĀĢļ¦źņ£╝ļĪ£ ļ░öļĪ£ ņŚ░Ļ▓░ņØ┤ ļÉśņ¢┤ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ļīĆļ¤ē ņČ£ĒśłņØ┤ ļ░£ņāØĒĢĀ ņłś ņ׳ņ¢┤ ņé¼ļ¦ØļźĀņØ┤ ļåÆļŗż. ļśÉĒĢ£ ļé┤ņŗ£Ļ▓Į ņĀæĻĘ╝ņØ┤ ņ¢┤ļĀżņÜ┤ ņ£äņĀĆļČĆļéś ņ£äņ▓┤ļČĆ Ēøäļ▓Į ļō▒ņŚÉ ņŻ╝ļĪ£ ļ░£ņāØĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ļé┤ņŗ£Ļ▓Į ņ¦ĆĒśłņłĀņØ┤ ņ¢┤ļĀĄĻ│Ā ņ¦ĆĒśłņØ┤ ņä▒Ļ│ĄĒĢśņŚ¼ļÅä ņ×¼ņČ£ĒśłņØ┤ ļŹö ļ¦ÄņØ┤ ļ░£ņāØĒĢ£ļŗż[81-83]. ĻĖēņä▒ ņ£äņĀĢļ¦źļźś ņČ£ĒśłņØĆ 25%ņŚÉņä£ ņ¦äļŗ© 2ļģä ņØ┤ļé┤ņŚÉ ļ░£ņāØĒĢśļŖöļŹ░81 ņŗØļÅäņĀĢļ¦źļźśņÖĆ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ Ēü¼ĻĖ░Ļ░Ć Ēü¼Ļ▒░ļéś ņĀüņāēņ¦ĢĒøäĻ░Ć ļÅÖļ░śļÉ£ Ļ▓ĮņÜ░ ĻĘĖļ”¼Ļ│Ā ļ╣äļīĆņāüņä▒ Ļ░äĻ▓Įļ│Ćņ”ØņØś Ļ▓ĮņÜ░ ņ£äĒŚśļÅäĻ░Ć ņ”ØĻ░ĆĒĢ£ļŗż[81,84-86].
GOV1ņØś Ļ▓ĮņÜ░ ņ┤łņČ£Ēśł ņśłļ░®ņØä ņ£äĒĢ┤ ņŗØļÅäņĀĢļ¦źļźśņŚÉ ļīĆĒĢ£ EVLņØä ņŗ£Ē¢ēĒĢśļ®┤ 2/3ņŚÉņä£ GOVļÅä ĒĢ©Ļ╗ś ņåīņŗżļÉ£ļŗż[87]. GOV2ļéś IGV1ņŚÉņä£ļŖö ņŗ£ņĢäļģĖņĢäĒü¼ļ”┤ļĀłņØ┤ĒŖĖ(cyanoacrylate)ļź╝ ņØ┤ņÜ®ĒĢ£ EVOĻ░Ć ĻČīĻ│ĀļÉ£ļŗż. Mishra ļō▒[88]ņØĆ ņ£äņĀĢļ¦źļźś ĒÖśņ×ÉņŚÉņä£ ņ┤łņČ£Ēśł ņśłļ░®ņØä ņ£äĒĢ┤ EVOļź╝ ņŗ£Ē¢ēĒĢ£ ĻĄ░ņŚÉņä£ 26Ļ░£ņøöĻ░äņØś ņČöņĀüĻ┤Ćņ░░ ĻĖ░Ļ░ä ļÅÖņĢł 13%ņŚÉņä£ļ¦ī ņ┤łņČ£ĒśłņØ┤ ļ░£ņāØĒĢśņŚ¼ ļ╣äņäĀĒāØņĀü ļ▓ĀĒāĆņ░©ļŗ©ņĀ£ņÖĆ ļ╣äĻĄÉĒĢśņŚ¼ ļŹö ĒÜ©Ļ│╝ņĀüņØ┤ļ®┤ņä£ ņāØņĪ┤ņ£©ļÅä ļåÆņĢśļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆļŗż. ļé┤ņŗ£Ļ▓Į ņ╣śļŻīļéś ļ╣äņäĀĒāØņĀü ļ▓ĀĒāĆņ░©ļŗ©ņĀ£ Ēł¼ņŚ¼ ņÖĖņŚÉļÅä ņ£äņĀĢļ¦źļźśņØś ņ┤łņČ£Ēśł ņśłļ░®ņØä ņ£äĒĢ┤ ĒÆŹņäĀņ░©ļŗ©ņŚŁĒ¢ēĻ▓ĮņĀĢļ¦ź ĒÅÉņāēņłĀ(balloon-occluded regtrograde transvenous obliteration, BRTO) ļ░Å ĒśłĻ┤Ćļ¦łĻ░£ ļ│┤ņĪ░ ņŚŁĒ¢ē Ļ▓ĮņĀĢļ¦ź ĒÅÉņāēņłĀ(vascular plug-assisted retrograde transvenous obliteration, PARTO) ļō▒ ļ░®ņé¼ņäĀ ņżæņ×¼ ņŗ£ņłĀ ņŗ£Ē¢ēņØä Ļ│ĀļĀżĒĢ┤ ļ│╝ ņłś ņ׳ļŗż[89-91].
ĻĖēņä▒ ņ£äņĀĢļ¦źļźś ņČ£ĒśłņØś Ļ▓ĮņÜ░ņŚÉļÅä ņŗØļÅäņĀĢļ¦źļźś ņČ£ĒśłĻ│╝ ļ¦łņ░¼Ļ░Ćņ¦ĆļĪ£ terlipressin, somatostatin ļśÉļŖö octreotideņÖĆ Ļ░ÖņØĆ ĒśłĻ┤ĆņłśņČĢņĀ£ņÖĆ ĒĢŁņāØņĀ£ļź╝ ļ░öļĪ£ Ēł¼ņŚ¼ĒĢśĻ│Ā 12ņŗ£Ļ░ä ņØ┤ļé┤ņŚÉ ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņŚ¼ ņČ£Ēśł ļČĆņ£äļź╝ ĒÖĢņØĖĒĢśĻ│Ā ņ¦ĆĒśłņłĀņØä ņŗ£Ē¢ēĒĢśļÅäļĪØ ĻČīĻ│ĀļÉśļŖöļŹ░ ļé┤ņŗ£Ļ▓Į ņŗ£Ē¢ē ņĀä ĒÖśņ×Éļź╝ ĒśłņŚŁĒĢÖņĀüņ£╝ļĪ£ ņĢłņĀĢņŗ£ĒéżĻ│Ā ĻĖ░ļÅäļź╝ ĒÖĢļ│┤ĒĢ£ Ēøä ņĀüņĀłĒĢ£ ņןļ╣äļź╝ Ļ░¢ņČś ĒÖśĻ▓ĮņŚÉņä£ Ļ▓ĮĒŚśņØ┤ ļ¦ÄņØĆ ļé┤ņŗ£Ļ▓Į ņØśņé¼ņŚÉ ņØśĒĢ┤ ņŗ£Ē¢ēļÉśļŖö Ļ▓āņØ┤ ļ░öļ×īņ¦üĒĢśļŗż[92].
ĻĖēņä▒ ņ£äņĀĢļ¦źļźś ņČ£ĒśłņŚÉņä£ Ļ░Ćņן ļ©╝ņĀĆ ĻČīĻ│ĀļÉśļŖö ļé┤ņŗ£Ļ▓Į ņ¦ĆĒśłņłĀņØĖ EVOļŖö ņŗ£ņĢäļģĖņĢäĒü¼ļ”┤ļĀłņØ┤ĒŖĖļź╝ ņĀĢļ¦źļźśņŚÉ ņŻ╝ņ×ģĒĢśļ®┤ ņłśļČäĻ│╝ ņĀæņ┤ēĒĢśņŚ¼ ņżæĒĢ®ņ▓┤ļź╝ ĒśĢņä▒ĒĢśļ®┤ņä£ ĻĄ│ļŖö ĒŖ╣ņä▒ņØä ņØ┤ņÜ®ĒĢ£ ņ╣śļŻīļ▓ĢņØ┤ļŗż(Fig. 4). ņłśļČäĻ│╝ ņĀæņ┤ēĒĢśļ®┤ņä£ ņēĮĻ▓ī Ļ▓ĮĒÖöļÉśĻĖ░ ļĢīļ¼ĖņŚÉ ņŗ£ņłĀ ņŗ£ ņŻ╝ņØśĻ░Ć ĒĢäņÜöĒĢ£ļŹ░ ļé┤ņŗ£Ļ▓Į ļĀīņ”łļéś Ļ▓Ėņ×ÉĻ│Ąņ£╝ļĪ£ ņ£ĀņČ£ļÉśņ¢┤ ņŗ£ņłĀ ļÅäņżæ ļé┤ņŗ£Ļ▓Į ņŗ£ņĢ╝Ļ░Ć Ļ░ĆļĀżņ¦ĆĻ▒░ļéś ļé┤ņŗ£Ļ▓ĮņØ┤ ņåÉņāüļÉĀ ņłś ņ׳ņ¢┤ Ļ▓Ćņé¼ ņĀä ļé┤ņŗ£Ļ▓Į Ļ▓Ėņ×ÉĻ│Ąņ£╝ļĪ£ ņś¼ļ”¼ļĖī ņśżņØ╝ņØä ĒØĪņØĖĒĢśņŚ¼ ņ▒äļäÉ ļé┤ļČĆņŚÉ Ļ│Āļź┤Ļ▓ī ļ░£ļØ╝ņŻ╝ļŖö Ļ▓āņØ┤ ņóŗļŗż[93].
ņ▓£ņ×Éņ╣©ņØ┤ ļäłļ¼┤ Ļ░ĆļŖśļ®┤ ņĀæĒĢ®ņĀ£ļź╝ ļ╣Āļź┤Ļ▓ī ņŻ╝ņ×ģĒĢĀ ņłś ņŚåĻ│Ā ļÅäĻ┤Ć ļé┤ņŚÉņä£ ĻĄ│ņ¢┤ļ▓äļ”┤ ņłś ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ 21-22 G ņĀĢļÅäņØś ĻĄĄņØĆ ņ▓£ņ×Éņ╣©ņØä ņé¼ņÜ®ĒĢśļŖö Ļ▓āņØ┤ ņóŗĻ│Ā ņĀÉļ¦ēĒĢśņĖĄ ņŗ¼ļČĆņŚÉ ņ£äņ╣śĒĢ£ ņ£äņĀĢļ¦źļźśĻ╣īņ¦Ć Ļ░ĆļŖźĒĢ£ Ļ╣ŖņłÖĒ׳ ņ▓£ņ×ÉĒĢśĻĖ░ ņ£äĒĢ┤ņä£ļŖö 5 mm ņØ┤ņāüņØś ņŻ╝ņé¼ļ░öļŖśņØ┤ ĻĖ┤ Ļ▓āņØä ņé¼ņÜ®ĒĢ┤ņĢ╝ ĒĢ£ļŗż. ņŗ£ņłĀ ļÅäņżæ ņĀæņ░®ņĀ£Ļ░Ć ņŗ£ņłĀņ×Éļéś ļ│┤ņĪ░ņ×ÉņØś ļłłņŚÉ ļōżņ¢┤Ļ░Ćļ®┤ ņĢłĻĄ¼ ņåÉņāüņØä ņ£Āļ░£ĒĢĀ ņłś ņ׳ņ¢┤ ņŗ£ņłĀņŚÉ ņ░ĖņŚ¼ĒĢśļŖö ņØśļŻīņ¦äņØĆ Ļ│ĀĻĖĆĻ│╝ Ļ░ÖņØĆ ļ│┤ĒśĖņןĻĄ¼ļÅä ĒĢäĒ׳ ņ░®ņÜ®ĒĢ┤ņĢ╝ ĒĢ£ļŗż. ņ▓£ņ×É ļČĆņ£äļź╝ Ļ▓░ņĀĢĒĢĀ ļĢīļŖö ņĀĢļ¦źļźś ņżæņĢÖņØś ļÅīņČ£ ļČĆņ£äļŖö ņĀĢļ¦źļźśņØś ņĢĢļĀźņØ┤ ņ¦æņżæļÉśņ¢┤ ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ Ēö╝ĒĢśļŖö Ļ▓āņØ┤ ņóŗļŗż. ļČäņČ£ņä▒ ņČ£Ēśł ņŗ£ ņČ£ĒśłņĀÉņŚÉ ņ¦üņĀæ ņ▓£ņ×ÉĒĢśļŖö Ļ▓ĮņÜ░ ĒśłņĢĪņØ┤ ņ▓£ņ×Éņ╣©ņØä ĒāĆĻ│Ā ĒØśļ¤¼ ņŗ£ņĢ╝Ļ░Ć ĒØÉļĀżņ¦ĆļŖö Ļ▓ĮņÜ░ļÅä ņ׳ņ£╝ļŗł ņŻ╝ņØśĒĢ┤ņĢ╝ ĒĢ£ļŗż. Ļ░ĆļŖźĒĢ£ ļé┤ņŗ£Ļ▓ĮņØä ņ▓£ņ×É ļČĆņ£äņŚÉ Ļ░ĆĻ╣ØĻ▓ī ņ£äņ╣śņŗ£Ēé© Ēøä ļÅäĻ┤ĆņŚÉ ņāØļ”¼ņŗØņŚ╝ņłś 1-2 mLļź╝ Ļ┤Ćļźśņŗ£Ēé© ļŗżņØī ņ▓£ņ×ÉĒĢśĻ│Ā ņŗ£ņĢäļģĖņĢäĒü¼ļ”┤ļĀłņØ┤ĒŖĖĻ░Ć ļ╣Āļź┤Ļ▓ī Ļ▓ĮĒÖöļÉśļŖö Ļ▓āņØä ļ¦ēĻĖ░ ņ£äĒĢ┤ ļ░śļō£ņŗ£ ņŻ╝ņ×ģ ņ¦üņĀäņŚÉ ņŻ╝ņé¼ĻĖ░ņŚÉ ņś«Ļ▓© ļ”¼Ēö╝ņśżļÅī(lipiodol)Ļ│╝ ĒĢ©Ļ╗ś Ēś╝ĒĢ®ĒĢśņŚ¼ ņé¼ņÜ®ĒĢ┤ņĢ╝ ĒĢ£ļŗż. ņØ╝ļ░śņĀüņ£╝ļĪ£ļŖö 1:1ņØś ļ╣äņ£©ļĪ£ Ēś╝ĒĢ®ĒĢśņŚ¼ 1-2 cc ņĀĢļÅäņö® ļ░śļ│ĄņĀüņ£╝ļĪ£ ņŻ╝ņ×ģĒĢśļŖöļŹ░ ņ£äņĀĢļ¦źļźśņØś Ēü¼ĻĖ░Ļ░Ć Ēü¼Ļ│Ā Ēśłļźś ņåŹļÅäĻ░Ć ļ╣Āļź┤ļŗżĻ│Ā ĒīÉļŗ©ļÉśĻ▒░ļéś ņŗŁņØ┤ņ¦ĆņןņØä ĒżĒĢ©ĒĢ£ ļŗżļźĖ ņןĻĖ░ņŚÉ ļ░£ņāØĒĢ£ ņĀĢļ¦źļźśņØś Ļ▓ĮņÜ░ņŚÉļŖö ņŗ£ņĢäļģĖņĢäĒü¼ļ”┤ļĀłņØ┤ĒŖĖņØś ļ╣äņ£©ņØä 60%-70%Ļ╣īņ¦Ć ļåÆņŚ¼ Ēś╝ĒĢ®ĒĢśņŚ¼ 2 cc ņØ┤ņāü Ēł¼ņŚ¼ĒĢśĻĖ░ļÅä ĒĢ£ļŗż. ņŻ╝ņé¼ĻĖ░ ļé┤ ņÜ®ņĢĪņØä ļ¬©ļæÉ ņŻ╝ņ×ģĒĢ£ ĒøäņŚÉļŖö 1 cc ņĀĢļÅäņØś ņāØļ”¼ņŗØņŚ╝ņłśļź╝ ņČöĻ░ĆņĀüņ£╝ļĪ£ Ļ┤ĆļźśĒĢśņŚ¼ ļÅäĻ┤Ć ļé┤ņØś ļé©ņØĆ Ēś╝ĒĢ®ņĢĪļōżĻ╣īņ¦Ć ļ¬©ļæÉ ņĀĢļ¦źļźś ļé┤ļĪ£ ņŻ╝ņ×ģĒĢ£ļŗż. ņ▓£ņ×Éņ╣©ņØ┤ ņĀĢļ¦źļźś ļé┤ņŚÉņä£ ņØæĻ│ĀļÉśļŖö Ļ▓āņØä ņśłļ░®ĒĢśĻĖ░ ņ£äĒĢ┤ ņŻ╝ņ×ģņØ┤ ļüØļé£ ĒøäņŚÉļŖö ļ░öļĪ£ ņ▓£ņ×Éņ╣©ņØä ļ╣╝ļé┤Ļ│Ā ņ▓£ņ×ÉļČĆņ£äņŚÉņä£ ĒØśļ¤¼ļéśņśżļŖö ņŗ£ņĢäļģĖņĢäĒü¼ļ”┤ļĀłņØ┤ĒŖĖĻ░Ć ļ╣©ļ”¼ Ļ│ĀĒśĢĒÖö ļÉśļÅäļĪØ ņāØļ”¼ņŗØņŚ╝ņłśļź╝ ņČöĻ░ĆņĀüņ£╝ļĪ£ ļ┐īļĀżņżĆļŗż. EVOņØś ņ¦ĆĒśł ņä▒Ļ│ĄļźĀņØĆ 90% ņØ┤ņāüņØ┤ļéś 1ļģä ņØ┤ļé┤ ņ×¼ņČ£ĒśłņØ┤ 17%-49%ņŚÉ ņØ┤ļźĖļŗż[94-98]. ņĀĢļ¦źļźśĻ░Ć Ēü¼Ļ│Ā ņ£ĀņåŹņØ┤ ļ╣Āļź┤Ļ▒░ļéś ņŗ£ņĢäļģĖņĢäĒü¼ļ”┤ļĀłņØ┤ĒŖĖņØś Ēś╝ĒĢ® ļ╣äņ£©ņØ┤ 40% ņØ┤ĒĢśļĪ£ ļé«ņĢä Ļ▓ĮĒÖöĻ░Ć ļŖ”ņ¢┤ņ¦ä Ļ▓ĮņÜ░ ņŗ£ņłĀ Ēøä 5% ņĀĢļÅäņŚÉņä£ ņżæĒĢ®ņ▓┤Ļ░Ć ņ£äņŗĀļŗ©ļØĮ(gastrorenal shunt)ņØä ĒåĄĒĢ┤ ļīĆņĀĢļ¦źņ£╝ļĪ£ ņ£Āņ×ģļÉśļ®┤ņä£ ņāēņĀäņ£╝ļĪ£ ņØĖĒĢ£ ņĀäņŗĀ ĒĢ®ļ│æņ”ØņØä ņ£Āļ░£ĒĢśļŖöļŹ░[99] ļćīņÖĆ ĒÅÉ, ļ¼Ėļ¦ź ņāēņĀäņ”Ø, ļ¼Ėļ¦źĒśłņĀä, ļ╣äņĀĢļ¦źĒśłņĀä, ļ╣äņן ĒÅÉņāē, Ēøäļ│ĄĻ░Ģ ļåŹņ¢æ, ņ£äĻČżņ¢æ, ņ▓£Ļ│ĄĻ│╝ ļ│Ąļ¦ēņŚ╝ ļō▒ņØ┤ ļ░£ņāØĒĢĀ ņłś ņ׳Ļ│Ā[100-107] ņŗ£ņĢäļģĖņĢäĒü¼ļ”┤ļĀłņØ┤ĒŖĖ ņÜ®ļ¤ēņØ┤ ļ¦ÄĻ▒░ļéś[108] ņ£äņŗĀļŗ©ļØĮņØ┤ Ēü░ Ļ▓ĮņÜ░ņŚÉ ļŹö ļ¦ÄņØ┤ ļ░£ņāØĒĢ£ļŗż[109]. EVO Ēøä PPI Ēł¼ņŚ¼ļŖö ņ×¼ņČ£Ēśł ņ£äĒŚśņØä ļé«ņČ£ ņłś ņ׳ļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłļŗż[110].
GOV1ņØĆ ņóīņ£äņĀĢļ¦ź(left gastric vein)Ļ│╝ ņŚ░Ļ┤ĆļÉśņ¢┤ ņ׳ņ¢┤ ņŗØļÅäņĀĢļ¦źļźśĻ░Ć ņåīņŗżļÉśļ®┤ ĒĢ©Ļ╗ś ņåīņŗżļÉĀ ņłś ņ׳ņ¢┤ EVLņØä ņŗ£Ē¢ēĒĢĀ ņłś ņ׳ļŖöļŹ░ 80%-90%ņØś ņ¦ĆĒśł ņä▒Ļ│ĄļźĀĻ│╝ 14%-56%ņØś ņ×¼ņČ£ĒśłļźĀņØ┤ ļ│┤Ļ│ĀļÉśņŚłļŗż[87,111-113]. ĻĘĖļ¤¼ļéś GOV1ņØś ņČ£ĒśłņŚÉņä£ļÅä EVOĻ░Ć EVLņŚÉ ļ╣äĒĢ┤ ņ¦ĆĒśł ņä▒Ļ│ĄļźĀņØ┤ ļåÆĻ│Ā ņŗ£ņłĀ Ēøä ņ×¼ņČ£ĒśłņØ┤ ļé«ņ£╝ļ®░[87,111-114] 2 cm ņØ┤ņāüņØś Ēü░ GOV1ņØĆ EVLļĪ£ ņĀĢļ¦źļźś ņĀäņ▓┤ļź╝ Ļ▓░ņ░░ĒĢśĻĖ░ ņ¢┤ļĀĄĻĖ░ ļĢīļ¼ĖņŚÉ EVOļź╝ ņŗ£Ē¢ēĒĢśļŖö Ļ▓āņØ┤ ņóŗļŗż. ļö░ļØ╝ņä£ GOV1ņØś Ļ▓ĮņÜ░ ĒÖśņ×ÉņØś ņāüĒā£, ņĀĢļ¦źļźśņØś Ēü¼ĻĖ░ņÖĆ ņČ£Ēśł ņ¢æņāü ļ░Å ņŗ£ņłĀ ņØśņé¼ņØś ņłÖļĀ©ļÅä ļ░Å ņŗ£ņłĀ ĒÖśĻ▓Į ļō▒ņØä Ļ│ĀļĀżĒĢśņŚ¼ ņŗ£ņłĀ ļ░®ļ▓ĢņØä ņäĀĒāØĒĢ┤ņĢ╝ ĒĢ£ļŗż.
Ēøäļ░®ņ£äņĀĢļ¦ź(posterior gastric vein)Ļ│╝ ņ¦¦ņØĆ ņ£äņĀĢļ¦ź(short gastric vein)ņŚÉņä£ ĻĖ░ņøÉĒĢśļŖö ņ£äļ░öļŗź ņĀĢļ¦źļźś(gastric fundal varices, GOV2 & IGV1)ļŖö Ēü¼ĻĖ░Ļ░Ć Ēü¼Ļ│Ā ņĀĢļ¦źļźśļź╝ ļŹ«Ļ│Ā ņ׳ļŖö ņĀÉļ¦ēņĖĄļÅä ļæÉĻ║╝ņÜ░ļ®░ ļŗżļ¤ēņØś ĒśłļźśĻ░Ć ļ╣ĀļźĖ ņåŹļÅäļĪ£ ĒØÉļź┤ĻĖ░ ļĢīļ¼ĖņŚÉ EVOĻ░Ć ņØ╝ņ░©ņ╣śļŻīļĪ£ ĻČīņןļÉśĻ│Ā[115,116], EVLņØ┤ļéś EISļĪ£ļŖö ņ¦ĆĒśłņØ┤ ņ¢┤ļĀĄĻ│Ā ņ×¼ņČ£ĒśłļźĀņØ┤ ļåÆņĢä ĻČīņןļÉśņ¦Ć ņĢŖļŖöļŗż. 2 cm ņØ┤ņāüņØś Ēü░ ņ£äņĀĢļ¦źļźśņŚÉņä£ ļ░Ģļ”¼ņä▒ ņś¼Ļ░Ćļ»Ė(detachable snare)ļź╝ ņØ┤ņÜ®ĒĢ£ Ļ▓░ņ░░ņØĆ[117,118] ļīĆļČĆļČä 2ļģä ņØ┤ļé┤ ņĀĢļ¦źļźśĻ░Ć ņ×¼ļ░£ĒĢśņśĆļŗż[111].
ļé┤ņŗ£Ļ▓Į ņ¦ĆĒśłņłĀņØ┤ ņŗżĒī©ĒĢ£ ĒÖśņ×ÉņŚÉņä£ļŖö TIPSņÖĆ ņŚŁĒ¢ē Ļ▓ĮņĀĢļ¦ź ĒÅÉņāēņłĀ(retrograde transvenous obliteration, RTO; BRTO or PARTO)Ļ│╝ Ļ░ÖņØĆ ĻĄ¼ņĀ£ņÜöļ▓ĢņØä ņŗ£Ē¢ēĒĢśļŖöļŹ░ 90% ņØ┤ņāüņŚÉņä£ ņä▒Ļ│ĄņĀüņ£╝ļĪ£ ņ¦ĆĒśłņØ┤ ņØ┤ļŻ©ņ¢┤ņ¦Ćņ¦Ćļ¦ī ņŗ£ņłĀļĪ£ ņØĖĒĢ£ ĒĢ®ļ│æņ”ØņØ┤ļéś ĻĖłĻĖ░ņ”ØņŚÉ ļö░ļØ╝ ņŗĀņżæĒ׳ Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢśĻ│Ā, ņŗ£ņłĀ Ļ░ĆļŖźĒĢ£ ļŗ©ļØĮņØś ĒÖĢņØĖņØ┤ ĒĢäņÜöĒĢśļŗż. ĻĄ¼ņĀ£ņÜöļ▓ĢņØä ņŗ£Ē¢ēĒĢśĻĖ░ ņĀä Ļ░ĆĻĄÉņ╣śļŻī ņŗ£ S-B ĒŖ£ļĖīļŖö ņ£äļČĆ ĒÆŹņäĀ(gastric balloon) ņÜ®ņĀüņØ┤ 200 mL ņĀĢļÅäļĪ£ ņ×æņĢä ņ£äņĀĢļ¦źļźśņØś ņČ£ĒśłņŚÉ ļīĆĒĢ┤ņä£ļŖö ņ¦ĆĒśłņØ┤ ņĀ£ļīĆļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦Ćņ¦Ć ņĢŖļŖö Ļ▓ĮņÜ░Ļ░Ć ļ¦Äļŗż. Linton-Nicholas tubeļŖö ņ£äļČĆ ĒÆŹņäĀņØ┤ 600 mLļĪ£ S-B ĒŖ£ļĖīņŚÉ ļ╣äĒĢ┤ ņ£äļ░öļŗź ņĀĢļ¦źļźśļź╝ ņóĆ ļŹö ĒÜ©Ļ│╝ņĀüņ£╝ļĪ£ ņĢĢļ░ĢĒĢĀ ņłś ņ׳ņ¢┤ 50% ņĀĢļÅäņØś ņ¦ĆĒśł ņä▒Ļ│ĄļźĀņØä ļ│┤ņØ┤ņ¦Ćļ¦ī 20%ņŚÉņä£ ņ×¼ņČ£ĒśłņØ┤ ļ░£ņāØĒĢśļ»ĆļĪ£ ĻĄ¼ņĀ£ņÜöļ▓Ģ ņŗ£Ē¢ē ņĀä Ļ░ĆļŖźĒĢ£ ņ¦¦ņØĆ ņŗ£Ļ░ä ļÅÖņĢłļ¦ī ņé¼ņÜ®ĒĢ┤ņĢ╝ ĒĢ£ļŗż[65,119].
GOV1ņØĆ ņ£äņĀĢļ¦źļźś ņČ£ĒśłņØä ņ¦ĆĒśłĒĢśļ®┤ņä£ Ēś╣ņØĆ ņ¦ĆĒśł ņØ┤ĒøäņŚÉ ņĢłņĀĢļÉ£ ņāüĒā£ņŚÉņä£ ļÅÖļ░śļÉ£ ņŗØļÅäņĀĢļ¦źļźśļź╝ 2-8ņŻ╝ Ļ░äĻ▓®ņ£╝ļĪ£ ļ░śļ│ĄņĀüņ£╝ļĪ£ Ļ▓░ņ░░ĒĢśĻ│Ā ļ╣äņäĀĒāØņĀü ļ▓ĀĒāĆņ░©ļŗ©ņĀ£ļź╝ ļ│æņÜ® Ēł¼ņŚ¼ĒĢ£ļŗż. ļ░śļ│ĄņĀüņØĖ Ļ▓░ņ░░ņłĀļĪ£ ņŗØļÅäņĀĢļ¦źļźśĻ░Ć ņåīņŗż Ēøä GOV1ņØś ņ×¼ņČ£ĒśłļźĀņØĆ 16%-42%ņØ┤Ļ│Ā[111,112] 65%ņŚÉņä£ ņ£äņĀĢļ¦źļźśļÅä ĒĢ©Ļ╗ś ņåīņŗżļÉ£ļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłļŗż[87]. GOV1ņŚÉņä£ EVOĻ░Ć EVLļ│┤ļŗż ņ×¼ņČ£ĒśłļźĀņØ┤ ļé«ļŗżĻ│Ā ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ņ£╝ļéś ņóĆ ļŹö ļīĆĻĘ£ļ¬©ņØś ņĀäĒ¢źņĀüņØĖ ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż. ļśÉĒĢ£ ļé┤ņŗ£Ļ▓Į ņ¦ĆĒśłņłĀņŚÉ ļ╣äĒĢ┤ TIPSĻ░Ć ņóĆ ļŹö ņ×¼ņČ£ĒśłņØä ņśłļ░®ĒĢśļŖö ļŹ░ ĒÜ©Ļ│╝ņĀüņØ┤ņŚłļŗżļŖö ļ│┤Ļ│ĀĻ░Ć ņ׳ņ¦Ćļ¦ī ņØ┤ ņŚŁņŗ£ ņĢäņ¦üĻ╣īņ¦ĆļŖö ĻĘ╝Ļ▒░Ļ░Ć ļČĆņĪ▒ĒĢśļŗż.
ļ░śļ│ĄņĀüņ£╝ļĪ£ EVOļź╝ ņŗ£Ē¢ēĒĢśņŚ¼ ņ£äļ░öļŗź ņĀĢļ¦źļźśĻ░Ć 75%Ļ╣īņ¦Ć ņåīņŗżļÉśņŚłļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłļŖöļŹ░[109], ļ╣äņäĀĒāØņĀü ļ▓ĀĒāĆņ░©ļŗ©ņĀ£ņÖĆ ļ╣äĻĄÉĒĢśņśĆņØä ļĢī ņ£ĀņØśĒĢśĻ▓ī ņ×¼ņČ£ĒśłļźĀņØ┤ ļé«ņĢśļŗż[120]. TIPSļŖö EVOņÖĆ ņ×¼ņČ£ĒśłļźĀņŚÉļŖö Ēü░ ņ░©ņØ┤Ļ░Ć ņŚåņ£╝ļéś Ļ░äņä▒ļćīņ”Ø ļō▒ņØś ĒĢ®ļ│æņ”Ø ļ░£ņāØņØ┤ ļåÆņĢśļŗż[121]. ņ£äļ░öļŗź ņĀĢļ¦źļźśņØś ņ×¼ņČ£Ēśł ņśłļ░®ņŚÉ ļīĆĒĢ£ ļ░®ņé¼ņäĀ ņżæņ×¼ņłĀ Ļ░äņØś ļ╣äĻĄÉ ņŚ░ĻĄ¼ļź╝ ļ│┤ļ®┤ RTOĻ░Ć TIPSņŚÉ ļ╣äĒĢ┤ ņ×¼ņČ£Ēśł ņśłļ░®ņŚÉ ļŹö ĒÜ©Ļ│╝ņĀüņØ┤ļéś Ļ░äņŗĀļŗ©ļØĮņØ┤ ņŚåļŖö Ļ▓ĮņÜ░ ņŗ£Ē¢ēĒĢĀ ņłś ņŚåĻ│Ā ņŗ£ņłĀ Ēøä ņŗØļÅäņĀĢļ¦źļźśĻ░Ć ņĢģĒÖöļÉśļŖö ņĀ£ĒĢ£ņĀÉņØ┤ ņ׳ļŗż[122].
ĻĖēņä▒ ņĀĢļ¦źļźś ņČ£ĒśłņØĆ Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņŚÉņä£ ņ╣śļ¬ģņĀüņØĖ ĒĢ®ļ│æņ”Øņ£╝ļĪ£ ņĀĢļ¦źļźśņØś ņāüĒā£ ļ░Å ĒÖśņ×ÉņØś Ļ░äĻĖ░ļŖźņØś ņżæļō▒ļÅäņŚÉ ļö░ļØ╝ ņ£äĒŚśļÅäĻ░Ć ļåÆņĢäņ¦äļŗż. ĻĖēņä▒ ņĀĢļ¦źļźś ņČ£ĒśłņØ┤ ņØśņŗ¼ļÉśļ®┤ 12ņŗ£Ļ░ä ņØ┤ļé┤ ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢ┤ņä£ ņČ£Ēśł ļČĆņ£äļź╝ ĒÖĢņØĖĒĢśĻ│Ā ļé┤ņŗ£Ļ▓Į ņ¦ĆĒśłņłĀņØä ņŗ£Ē¢ēĒĢ┤ņĢ╝ ĒĢśļŖöļŹ░ ĻĖēņä▒ ņŗØļÅäņĀĢļ¦źļźś ņČ£ĒśłņŚÉņä£ļŖö EVLņØ┤ ņØ╝ņ░©ņ╣śļŻīļĪ£ ĻČīĻ│ĀļÉśĻ│Ā ņ׳Ļ│Ā ĻĖēņä▒ ņ£äņĀĢļ¦źļźś ņČ£ĒśłņŚÉņä£ļŖö ņŗ£ņĢäļģĖņĢäĒü¼ļ”┤ļĀłņØ┤ĒŖĖļź╝ ņØ┤ņÜ®ĒĢ£ EVOĻ░Ć ĻČīĻ│ĀļÉśĻ│Ā ņ׳ļŗż. ļŗżņ¢æĒĢ£ ņ╣śļŻīļ▓ĢņØś ļ░£ļŗ¼ņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā ņĢäņ¦üĻ╣īņ¦Ć ĻĖēņä▒ ņĀĢļ¦źļźś ņČ£ĒśłņØ┤ ļ░£ņāØĒĢśļ®┤ ņé¼ļ¦ØļźĀņØ┤ ļåÆĻ│Ā ņ×¼ņČ£ĒśłņØ┤ ņל ļ░£ņāØĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ Ļ░äļ¼Ėļ¦źĒĢŁņ¦äņ”ØņØ┤ ļÅÖļ░śļÉ£ Ļ░äĻ▓Įļ│Ćņ”Ø ĒÖśņ×ÉņŚÉņä£ļŖö ņĀĢļ¦źļźśņØś ļ░£ņāØĻ│╝ ņ¦äĒ¢ēņŚÉ ļīĆĒĢ£ ļé┤ņŗ£Ļ▓Į Ļ░Éņŗ£(endoscopic surveillance)ņÖĆ ņ┤łņČ£Ēśł ļ░Å ņ×¼ņČ£Ēśł ļ░®ņ¦Ćļź╝ ņ£äĒĢ£ ņĀüĻĘ╣ņĀüņØĖ ņśłļ░®ņØ┤ ņŗ£Ē¢ēļÉśņ¢┤ņĢ╝ ĒĢ£ļŗż.
Notes
Fig.┬Ā1.
Endoscopic classifications of esophageal varices. A: Esophagus shows straight and small-caliber varices (F1). B: The moderate enlarged tortuous beady veins are distributed in less than one-third of the esophageal lumen (F2). C: The marked enlarged nodular or tumorshaped veins occupies more than one-third of the esophageal lumen (F3). D: Whitish esophageal varices are observed (Cw). E: The esophageal varices are bluish in color (Cb). F: There was no red color sign (RCS0). G: The red color signs are small in number and localized (RCS1). H: The intermediated red color sign between RCS1 and RCS3 are observed (RCS2). I: The red color signs are large in number and localized (RCS3).

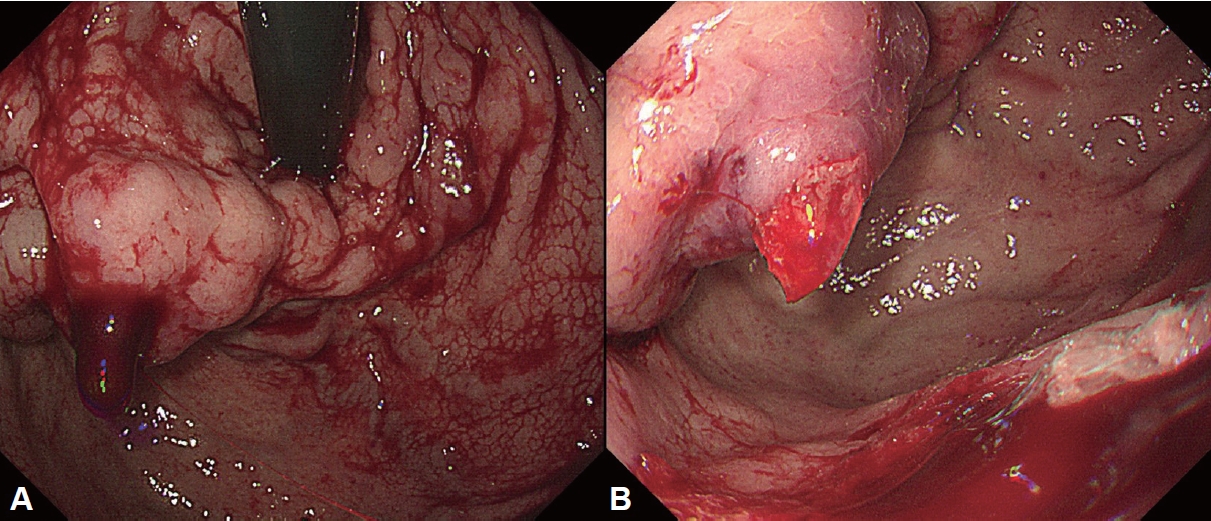
Fig.┬Ā2.
Endoscopic features of acute esophageal variceal hemorrhage. A: Active spurting bleeding is identified in esophageal varix. B: A blood clot is attached to the esophageal varix. C: A white nipple is seen on the esophageal varix.
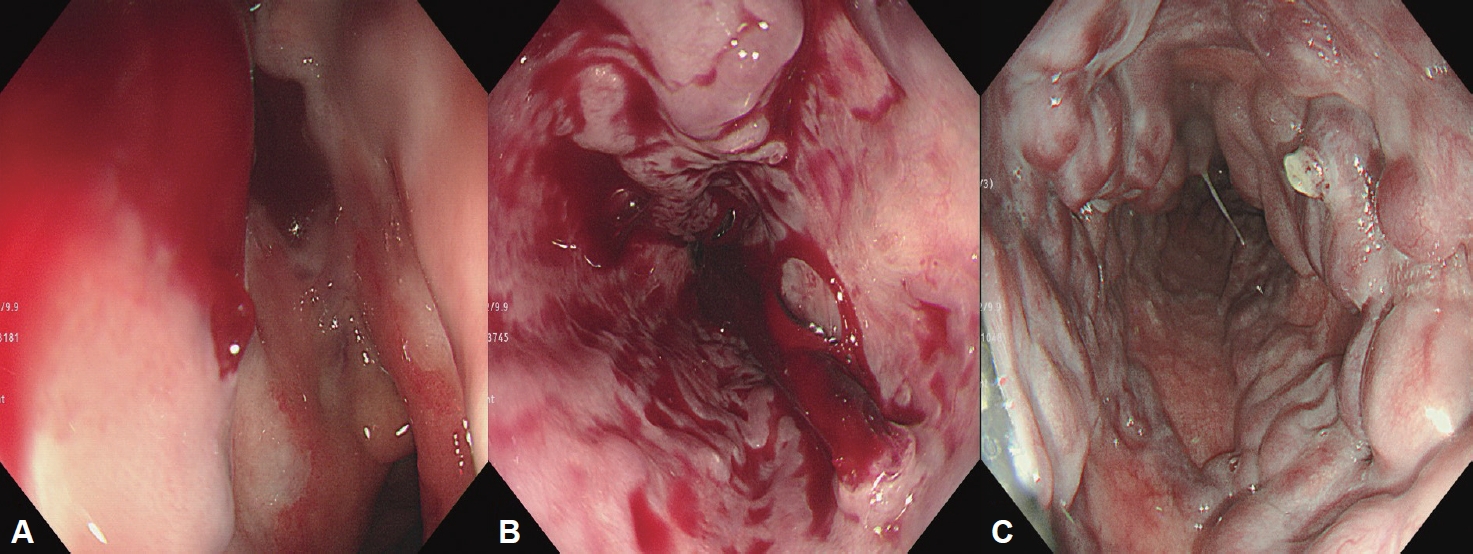
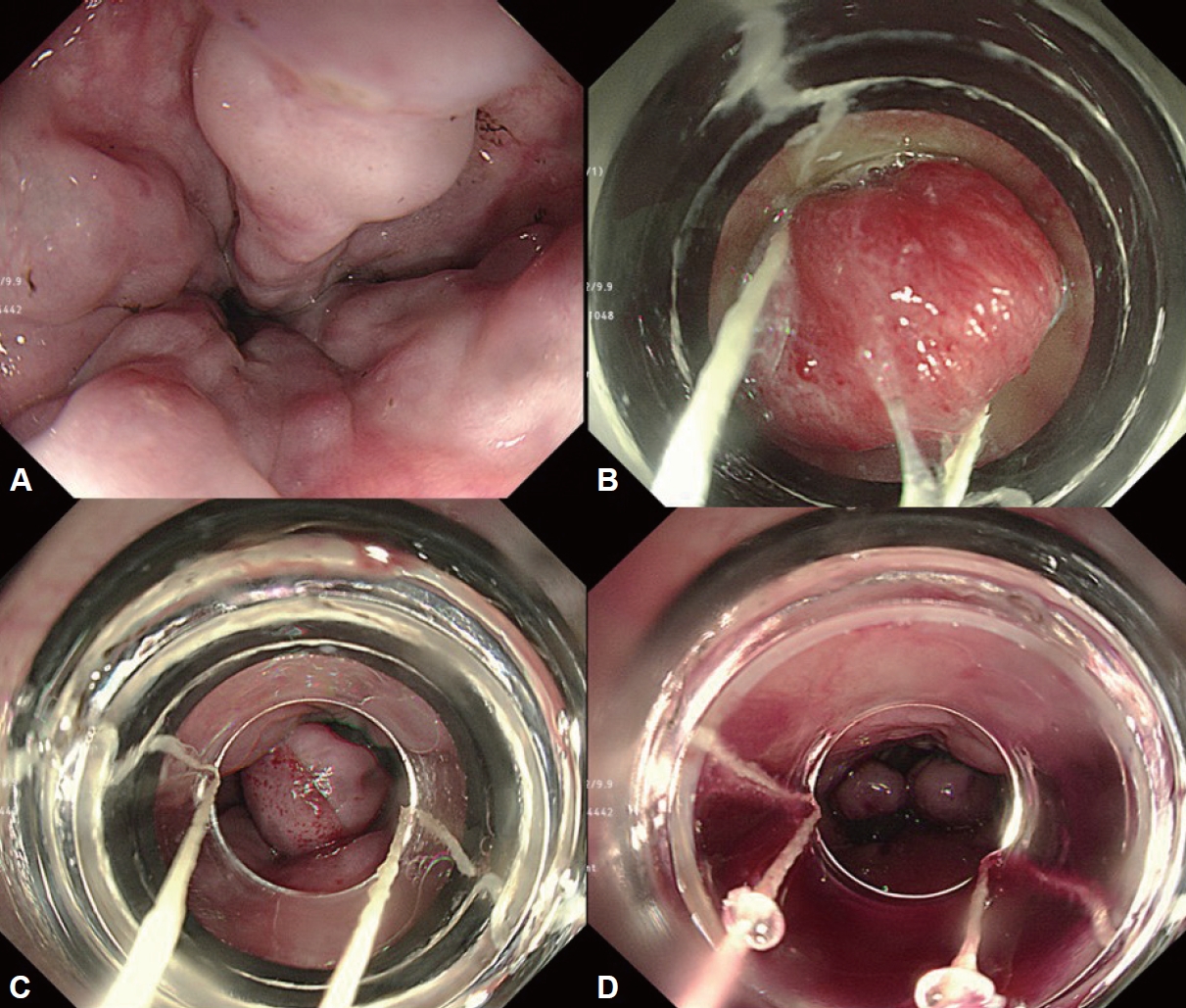
Fig.┬Ā3.
Endoscopic variceal ligation for esophageal varices. A: Endoscopy reveals a white nipple on the esophageal varix. B: Place the endoscope as close as possible to the esophageal varix and pull sufficiently into the ligation device through suction. C: Ligation esophageal varix by firing a rubber band. D: Additional ligations of remaining varices are also performed.
REFERENCES
1. Iwakiri Y, Groszmann RJ. The hyperdynamic circulation of chronic liver diseases: from the patient to the molecule. Hepatology 2006;43(2 Suppl 1): S121ŌĆōS131.


2. Abraldes JG, Iwakiri Y, Loureiro-Silva M, Haq O, Sessa WC, Groszmann RJ. Mild increases in portal pressure upregulate vascular endothelial growth factor and endothelial nitric oxide synthase in the intestinal microcirculatory bed, leading to a hyperdynamic state. Am J Physiol Gastrointest Liver Physiol 2006;290:G980ŌĆōG987.


3. Garc├Ła-Pag├Īn JC, Gracia-Sancho J, Bosch J. Functional aspects on the pathophysiology of portal hypertension in cirrhosis. J Hepatol 2012;57:458ŌĆō461.


4. DŌĆÖAmico G, Pasta L, Morabito A, et al. Competing risks and prognostic stages of cirrhosis: a 25-year inception cohort study of 494 patients. Aliment Pharmacol Ther 2014;39:1180ŌĆō1193.


5. Kovalak M, Lake J, Mattek N, Eisen G, Lieberman D, Zaman A. Endoscopic screening for varices in cirrhotic patients: data from a national endoscopic database. Gastrointest Endosc 2007;65:82ŌĆō88.


6. Seo YS, Park SY, Kim MY, et al. Lack of difference among terlipressin, somatostatin, and octreotide in the control of acute gastroesophageal variceal hemorrhage. Hepatology 2014;60:954ŌĆō963.


7. Villanueva C, Piqueras M, Aracil C, et al. A randomized controlled trial comparing ligation and sclerotherapy as emergency endoscopic treatment added to somatostatin in acute variceal bleeding. J Hepatol 2006;45:560ŌĆō567.


8. Reverter E, Tandon P, Augustin S, et al. A MELD-based model to determine risk of mortality among patients with acute variceal bleeding. Gastroenterology 2014;146:412ŌĆō419.e3.


9. Kim YD, Cheon GJ, Kim MY, Suk KT, Baik SK, Kim DJ. Changes in the clinical outcomes of variceal bleeding in cirrhotic patients: a 10-year experience in Gangwon province, South Korea. Gut Liver 2012;6:476ŌĆō481.



11. Groszmann RJ, Garcia-Tsao G, Bosch J, et al. Beta-blockers to prevent gastroesophageal varices in patients with cirrhosis. N Engl J Med 2005;353:2254ŌĆō2261.


12. Merli M, Nicolini G, Angeloni S, et al. Incidence and natural history of small esophageal varices in cirrhotic patients. J Hepatol 2003;38:266ŌĆō272.


13. de Franchis R. Updating consensus in portal hypertension: report of the Baveno III consensus workshop on definitions, methodology and therapeutic strategies in portal hypertension. J Hepatol 2000;33:846ŌĆō852.


14. Grace ND, Groszmann RJ, Garcia-Tsao G, et al. Portal hypertension and variceal bleeding: an AASLD single topic symposium. Hepatology 1998;28:868ŌĆō880.


15. de Franchis R, Pascal JP, Ancona E, et al. Definitions, methodology and therapeutic strategies in portal hypertension. A consensus development workshop, Baveno, Lake Maggiore, Italy, April 5 and 6, 1990. J Hepatol 1992;15:256ŌĆō261.

16. Garcia-Tsao G, Sanyal AJ, Grace ND, Carey W. Prevention and management of gastroesophageal varices and variceal hemorrhage in cirrhosis. Hepatology 2007;46:922ŌĆō938.


17. Beppu K, Inokuchi K, Koyanagi N, et al. Prediction of variceal hemorrhage by esophageal endoscopy. Gastrointest Endosc 1981;27:213ŌĆō218.


18. Idezuki Y. General rules for recording endoscopic findings of esophagogastric varices (1991). World J Surg 1995;19:420ŌĆō422; discussion 423.



19. North Italian Endoscopic Club for the Study and Treatment of Esophageal Varices. Prediction of the first variceal hemorrhage in patients with cirrhosis of the liver and esophageal varices. A prospective multicenter study. N Engl J Med 1988;319:983ŌĆō989.


20. El-Serag HB, Everhart JE. Improved survival after variceal hemorrhage over an 11-year period in the Department of Veterans Affairs. Am J Gastroenterol 2000;95:3566ŌĆō3573.


21. DŌĆÖAmico G, De Franchis R. Upper digestive bleeding in cirrhosis. Post-therapeutic outcome and prognostic indicators. Hepatology 2003;38:599ŌĆō612.


22. Carbonell N, Pauwels A, Serfaty L, Fourdan O, L├®vy VG, Poupon R. Improved survival after variceal bleeding in patients with cirrhosis over the past two decades. Hepatology 2004;40:652ŌĆō659.


23. de Franchis R, Bosch J, Garcia-Tsao G, Reiberger T, Ripoll C. Baveno VIIŌĆōrenewing consensus in portal hypertension. J Hepatol 2022;76:959ŌĆō974.

24. de Franchis R. Expanding consensus in portal hypertension: report of the Baveno VI consensus workshop: stratifying risk and individualizing care for portal hypertension. J Hepatol 2015;63:743ŌĆō752.

25. Garcia-Tsao G, Abraldes JG, Berzigotti A, Bosch J. Portal hypertensive bleeding in cirrhosis: risk stratification, diagnosis, and management: 2016 practice guidance by the American Association for the study of liver diseases. Hepatology 2017;65:310ŌĆō335.



26. Merkel C, Marin R, Angeli P, et al. A placebo-controlled clinical trial of nadolol in the prophylaxis of growth of small esophageal varices in cirrhosis. Gastroenterology 2004;127:476ŌĆō484.


27. Gluud LL, Klingenberg S, Nikolova D, Gluud C. Banding ligation versus beta-blockers as primary prophylaxis in esophageal varices: systematic review of randomized trials. Am J Gastroenterol 2007;102:2842ŌĆō2848; quiz 2841, 2849.


28. Li L, Yu C, Li Y. Endoscopic band ligation versus pharmacological therapy for variceal bleeding in cirrhosis: a meta-analysis. Can J Gastroenterol 2011;25:147ŌĆō155.




29. Lebrec D, Vinel JP, Dupas JL. Complications of portal hypertension in adults: a French consensus. Eur J Gastroenterol Hepatol 2005;17:403ŌĆō410.


30. Laine L, Cook D. Endoscopic ligation compared with sclerotherapy for treatment of esophageal variceal bleeding. A meta-analysis. Ann Intern Med 1995;123:280ŌĆō287.


31. Petrasch F, Grothaus J, M├Čssner J, Schiefke I, Hoffmeister A. Differences in bleeding behavior after endoscopic band ligation: a retrospective analysis. BMC Gastroenterol 2010;10:5.




32. Shaheen NJ, Stuart E, Schmitz SM, et al. Pantoprazole reduces the size of postbanding ulcers after variceal band ligation: a randomized, controlled trial. Hepatology 2005;41:588ŌĆō594.


33. Boo GB, Oh JC, Lee BJ, et al. The effect of proton pump inhibitor on healing of post-esophageal variceal ligation ulcers. Korean J Gastroenterol 2008;51:232ŌĆō240.

34. Kang SH, Yim HJ, Kim SY, et al. Proton pump inhibitor therapy is associated with reduction of early bleeding risk after prophylactic endoscopic variceal band ligation: a retrospective cohort study. Medicine (Baltimore) 2016;95:e2903.


35. Dam G, Vilstrup H, Watson H, Jepsen P. Proton pump inhibitors as a risk factor for hepatic encephalopathy and spontaneous bacterial peritonitis in patients with cirrhosis with ascites. Hepatology 2016;64:1265ŌĆō1272.


36. Tsai CF, Chen MH, Wang YP, et al. Proton pump inhibitors increase risk for hepatic encephalopathy in patients with cirrhosis in a population study. Gastroenterology 2017;152:134ŌĆō141.


37. Goel GA, Deshpande A, Lopez R, Hall GS, van Duin D, Carey WD. Increased rate of spontaneous bacterial peritonitis among cirrhotic patients receiving pharmacologic acid suppression. Clin Gastroenterol Hepatol 2012;10:422ŌĆō427.


38. Yoshida H, Mamada Y, Taniai N, et al. A randomized control trial of bi-monthly versus bi-weekly endoscopic variceal ligation of esophageal varices. Am J Gastroenterol 2005;100:2005ŌĆō2009.


39. Lay CS, Tsai YT, Lee FY, et al. Endoscopic variceal ligation versus propranolol in prophylaxis of first variceal bleeding in patients with cirrhosis. J Gastroenterol Hepatol 2006;21:413ŌĆō419.


40. Lo GH, Chen WC, Chen MH, et al. Endoscopic ligation vs. nadolol in the prevention of first variceal bleeding in patients with cirrhosis. Gastrointest Endosc 2004;59:333ŌĆō338.


41. Schepke M, Kleber G, N├╝rnberg D, et al. Ligation versus propranolol for the primary prophylaxis of variceal bleeding in cirrhosis. Hepatology 2004;40:65ŌĆō72.


42. Jutabha R, Jensen DM, Martin P, Savides T, Han SH, Gornbein J. Randomized study comparing banding and propranolol to prevent initial variceal hemorrhage in cirrhotics with high-risk esophageal varices. Gastroenterology 2005;128:870ŌĆō881.


43. Sarin SK, Wadhawan M, Agarwal SR, Tyagi P, Sharma BC. Endoscopic variceal ligation plus propranolol versus endoscopic variceal ligation alone in primary prophylaxis of variceal bleeding. Am J Gastroenterol 2005;100:797ŌĆō804.


44. Villanueva C, Mi├▒ana J, Ortiz J, et al. Endoscopic ligation compared with combined treatment with nadolol and isosorbide mononitrate to prevent recurrent variceal bleeding. N Engl J Med 2001;345:647ŌĆō655.


45. Wang HM, Lo GH, Chen WC, et al. Comparison of endoscopic variceal ligation and nadolol plus isosorbide-5-mononitrate in the prevention of first variceal bleeding in cirrhotic patients. J Chin Med Assoc 2006;69:453ŌĆō460.


46. Hwang JH, Shergill AK, Acosta RD, et al. The role of endoscopy in the management of variceal hemorrhage. Gastrointest Endosc 2014;80:221ŌĆō227.


47. Bonilha DQ, Lenz L, Correia LM, et al. Propranolol associated with endoscopic band ligation reduces recurrence of esophageal varices for primary prophylaxis of variceal bleeding: a randomized-controlled trial. Eur J Gastroenterol Hepatol 2015;27:84ŌĆō90.

48. Stauch S, Kircheis G, Adler G, et al. Oral L-ornithine-L-aspartate therapy of chronic hepatic encephalopathy: results of a placebo-controlled double-blind study. J Hepatol 1998;28:856ŌĆō864.


49. Poo JL, G├│ngora J, S├Īnchez-Avila F, et al. Efficacy of oral L-ornithine-L-aspartate in cirrhotic patients with hyperammonemic hepatic encephalopathy. Results of a randomized, lactulose-controlled study. Ann Hepatol 2006;5:281ŌĆō288.


50. Villanueva C, Colomo A, Bosch A, et al. Transfusion strategies for acute upper gastrointestinal bleeding. N Engl J Med 2013;368:11ŌĆō21.

51. Bernard B, Grang├® JD, Khac EN, Amiot X, Opolon P, Poynard T. Antibiotic prophylaxis for the prevention of bacterial infections in cirrhotic patients with gastrointestinal bleeding: a meta-analysis. Hepatology 1999;29:1655ŌĆō1661.


52. Chavez-Tapia NC, Barrientos-Gutierrez T, Tellez-Avila F, et al. Meta-analysis: antibiotic prophylaxis for cirrhotic patients with upper gastrointestinal bleeding - an updated Cochrane review. Aliment Pharmacol Ther 2011;34:509ŌĆō518.


53. Wells M, Chande N, Adams P, et al. Meta-analysis: vasoactive medications for the management of acute variceal bleeds. Aliment Pharmacol Ther 2012;35:1267ŌĆō1278.


54. Ioannou G, Doust J, Rockey DC. Terlipressin for acute esophageal variceal hemorrhage. Cochrane Database Syst Rev 2003;1:CD002147.

55. Hashizume M, Ohta M, Ueno K, Tanoue K, Kitano S, Sugimachi K. Endoscopic ligation of esophageal varices compared with injection sclerotherapy: a prospective randomized trial. Gastrointest Endosc 1993;39:123ŌĆō126.


56. Gimson AE, Ramage JK, Panos MZ, et al. Randomised trial of variceal banding ligation versus injection sclerotherapy for bleeding oesophageal varices. Lancet 1993;342:391ŌĆō394.


57. Lo GH, Lai KH, Cheng JS, et al. A prospective, randomized trial of sclerotherapy versus ligation in the management of bleeding esophageal varices. Hepatology 1995;22:466ŌĆō471.


58. Lo GH, Lai KH, Cheng JS, et al. Emergency banding ligation versus sclerotherapy for the control of active bleeding from esophageal varices. Hepatology 1997;25:1101ŌĆō1104.


59. Stiegmann GV, Goff JS, Michaletz-Onody PA, et al. Endoscopic sclerotherapy as compared with endoscopic ligation for bleeding esophageal varices. N Engl J Med 1992;326:1527ŌĆō1532.


60. Baroncini D, Milandri GL, Borioni D, et al. A prospective randomized trial of sclerotherapy versus ligation in the elective treatment of bleeding esophageal varices. Endoscopy 1997;29:235ŌĆō240.


61. Hou MC, Lin HC, Kuo BI, Chen CH, Lee FY, Lee SD. Comparison of endoscopic variceal injection sclerotherapy and ligation for the treatment of esophageal variceal hemorrhage: a prospective randomized trial. Hepatology 1995;21:1517ŌĆō1522.


62. Laine L, el-Newihi HM, Migikovsky B, Sloane R, Garcia F. Endoscopic ligation compared with sclerotherapy for the treatment of bleeding esophageal varices. Ann Intern Med 1993;119:1ŌĆō7.


63. Ibrahim M, El-Mikkawy A, Abdel Hamid M, et al. Early application of haemostatic powder added to standard management for oesophagogastric variceal bleeding: a randomised trial. Gut 2019;68:844ŌĆō853.


64. Azoulay D, Castaing D, Majno P, et al. Salvage transjugular intrahepatic portosystemic shunt for uncontrolled variceal bleeding in patients with decompensated cirrhosis. J Hepatol 2001;35:590ŌĆō597.


65. Ter├®s J, Cecilia A, Bordas JM, Rimola A, Bru C, Rod├®s J. Esophageal tamponade for bleeding varices. Controlled trial between the Sengstaken-Blakemore tube and the Linton-Nachlas tube. Gastroenterology 1978;75:566ŌĆō569.


66. Haq I, Tripathi D. Recent advances in the management of variceal bleeding. Gastroenterol Rep (Oxf) 2017;5:113ŌĆō126.



67. Escorsell ├Ć, Pavel O, C├Īrdenas A, et al. Esophageal balloon tamponade versus esophageal stent in controlling acute refractory variceal bleeding: a multicenter randomized, controlled trial. Hepatology 2016;63:1957ŌĆō1967.


68. Boyer TD, Haskal ZJ. The role of transjugular intrahepatic portosystemic shunt in the management of portal hypertension. Hepatology 2005;41:386ŌĆō400.


69. Teran JC, Imperiale TF, Mullen KD, Tavill AS, McCullough AJ. Primary prophylaxis of variceal bleeding in cirrhosis: a cost-effectiveness analysis. Gastroenterology 1997;112:473ŌĆō482.


70. DŌĆÖAmico G, Pagliaro L, Bosch J. Pharmacological treatment of portal hypertension: an evidence-based approach. Semin Liver Dis 1999;19:475ŌĆō505.


71. Graham DY, Smith JL. The course of patients after variceal hemorrhage. Gastroenterology 1981;80:800ŌĆō809.


72. Cheung J, Zeman M, van Zanten SV, Tandon P. Systematic review: secondary prevention with band ligation, pharmacotherapy or combination therapy after bleeding from oesophageal varices. Aliment Pharmacol Ther 2009;30:577ŌĆō588.


73. Ding SH, Liu J, Wang JP. Efficacy of beta-adrenergic blocker plus 5-isosorbide mononitrate and endoscopic band ligation for prophylaxis of esophageal variceal rebleeding: a meta-analysis. World J Gastroenterol 2009;15:2151ŌĆō2155.


74. Lo GH, Lai KH, Cheng JS, et al. Endoscopic variceal ligation plus nadolol and sucralfate compared with ligation alone for the prevention of variceal rebleeding: a prospective, randomized trial. Hepatology 2000;32:461ŌĆō465.


75. de la Pe├▒a J, Brullet E, Sanchez-Hern├Īndez E, et al. Variceal ligation plus nadolol compared with ligation for prophylaxis of variceal rebleeding: a multicenter trial. Hepatology 2005;41:572ŌĆō578.


76. Saeed ZA, Stiegmann GV, Ramirez FC, et al. Endoscopic variceal ligation is superior to combined ligation and sclerotherapy for esophageal varices: a multicenter prospective randomized trial. Hepatology 1997;25:71ŌĆō74.


77. Harewood GC, Baron TH, Song LM. Factors predicting success of endoscopic variceal ligation for secondary prophylaxis of esophageal variceal bleeding. J Gastroenterol Hepatol 2006;21(1 Pt 2): 237ŌĆō241.


78. Holster IL, Tjwa ET, Moelker A, et al. Covered transjugular intrahepatic portosystemic shunt versus endoscopic therapy + ╬▓-blocker for prevention of variceal rebleeding. Hepatology 2016;63:581ŌĆō589.



79. Henderson JM. Salvage therapies for refractory variceal hemorrhage. Clin Liver Dis 2001;5:709ŌĆō725.


80. Kawaoka T, Takahashi S, Aikata H, et al. Beneficial effects of livingdonor liver transplantation on esophageal varices. J Gastroenterol 2008;43:982ŌĆō989.



81. Sarin SK, Lahoti D, Saxena SP, Murthy NS, Makwana UK. Prevalence, classification and natural history of gastric varices: a longterm follow-up study in 568 portal hypertension patients. Hepatology 1992;16:1343ŌĆō1349.


82. de Franchis R, Primignani M. Natural history of portal hypertension in patients with cirrhosis. Clin Liver Dis 2001;5:645ŌĆō663.


83. Sarin SK. Long-term follow-up of gastric variceal sclerotherapy: an eleven-year experience. Gastrointest Endosc 1997;46:8ŌĆō14.


84. Kim T, Shijo H, Kokawa H, et al. Risk factors for hemorrhage from gastric fundal varices. Hepatology 1997;25:307ŌĆō312.


85. Lee CH, Lee JH, Choi YS, et al. Natural history of gastric varices and risk factors for bleeding. Korean J Hepatol 2008;14:331ŌĆō341.


86. Jakab SS, Garcia-Tsao G. Screening and surveillance of varices in patients with cirrhosis. Clin Gastroenterol Hepatol 2019;17:26ŌĆō29.


87. Park SW, Seo YS, Lee HA, et al. Changes in cardiac varices and their clinical significance after eradication of esophageal varices by band ligation. Can J Gastroenterol Hepatol 2016;2016:2198163.




88. Mishra SR, Sharma BC, Kumar A, Sarin SK. Primary prophylaxis of gastric variceal bleeding comparing cyanoacrylate injection and beta-blockers: a randomized controlled trial. J Hepatol 2011;54:1161ŌĆō1167.


89. Park JK, Saab S, Kee ST, et al. Balloon-occluded retrograde transvenous obliteration (BRTO) for treatment of gastric varices: review and meta-analysis. Dig Dis Sci 2015;60:1543ŌĆō1553.



90. Gwon DI, Ko GY, Yoon HK, et al. Gastric varices and hepatic encephalopathy: treatment with vascular plug and gelatin sponge-assisted retrograde transvenous obliteration--a primary report. Radiology 2013;268:281ŌĆō287.


91. Gwon DI, Kim YH, Ko GY, et al. Vascular plug-assisted retrograde transvenous obliteration for the treatment of gastric varices and hepatic encephalopathy: a prospective multicenter study. J Vasc Interv Radiol 2015;26:1589ŌĆō1595.


92. Tripathi D, Stanley AJ, Hayes PC, et al. U.K. guidelines on the management of variceal haemorrhage in cirrhotic patients. Gut 2015;64:1680ŌĆō1704.


93. Korean Association for the Study of the Liver (KASL). KASL clinical practice guidelines for liver cirrhosis: varices, hepatic encephalopathy, and related complications. Clin Mol Hepatol 2020;26:83ŌĆō127.




94. Akahoshi T, Hashizume M, Shimabukuro R, et al. Long-term results of endoscopic Histoacryl injection sclerotherapy for gastric variceal bleeding: a 10-year experience. Surgery 2002;131(1 Suppl): S176ŌĆōS181.


95. Kim JW, Baik SK, Kim KH, et al. Effect of endoscopic sclerotherapy using N-butyl-2-cyanoacrylate in patients with gastric variceal bleeding. Korean J Hepatol 2006;12:394ŌĆō403.

96. Paik CN, Kim SW, Lee IS, et al. The therapeutic effect of cyanoacrylate on gastric variceal bleeding and factors related to clinical outcome. J Clin Gastroenterol 2008;42:916ŌĆō922.


97. Jun CH, Kim KR, Yoon JH, et al. Clinical outcomes of gastric variceal obliteration using N-butyl-2-cyanoacrylate in patients with acute gastric variceal hemorrhage. Korean J Intern Med 2014;29:437ŌĆō444.



98. Lee HA, Chang JM, Goh HG, et al. Prognosis of patients with gastric variceal bleeding after endoscopic variceal obturation according to the type of varices. Eur J Gastroenterol Hepatol 2019;31:211ŌĆō217.


99. Irisawa A, Obara K, Sato Y, et al. Adherence of cyanoacrylate which leaked from gastric varices to the left renal vein during endoscopic injection sclerotherapy: a histopathologic study. Endoscopy 2000;32:804ŌĆō806.


100. S├®e A, Florent C, Lamy P, L├®vy VG, Bouvry M. [Cerebrovascular accidents after endoscopic obturation of esophageal varices with isobutyl-2-cyanoacrylate in 2 patients]. Gastroenterol Clin Biol 1986;10:604ŌĆō607; French.

101. Joo HS, Jang JY, Eun SH, et al. Long-term results of endoscopic Histoacryl (N-butyl-2-cyanoacrylate) injection for treatment of gastric varices--a 10-year experience. Korean J Gastroenterol 2007;49:320ŌĆō326.

102. Roesch W, Rexroth G. Pulmonary, cerebral and coronary emboli during bucrylate injection of bleeding fundic varices. Endoscopy 1998;30:S89ŌĆōS90.
103. Thakeb F, Salama Z, Salama H, Abdel Raouf T, Abdel Kader S, Abdel Hamid H. The value of combined use of N-butyl-2-cyanoacrylate and ethanolamine oleate in the management of bleeding esophagogastric varices. Endoscopy 1995;27:358ŌĆō364.


104. Verger P, Blais J, Gruau M, Haffaf Y. [Retrogastric abscess secondary to gastric varices obturation with cyanoacrylate]. Gastroenterol Clin Biol 1998;22:248ŌĆō249; French.

105. Cheng PN, Sheu BS, Chen CY, Chang TT, Lin XZ. Splenic infarction after histoacryl injection for bleeding gastric varices. Gastrointest Endosc 1998;48:426ŌĆō427.


106. Shim CS, Cho YD, Kim JO, et al. A case of portal and splenic vein thrombosis after Histoacryl injection therapy in gastric varices. Endoscopy 1996;28:461.


107. Seo YS. Prevention and management of gastroesophageal varices. Clin Mol Hepatol 2018;24:20ŌĆō42.



108. Hwang SS, Kim HH, Park SH, et al. N-butyl-2-cyanoacrylate pulmonary embolism after endoscopic injection sclerotherapy for gastric variceal bleeding. J Comput Assist Tomogr 2001;25:16ŌĆō22.


109. Ryan BM, Stockbrugger RW, Ryan JM. A pathophysiologic, gastroenterologic, and radiologic approach to the management of gastric varices. Gastroenterology 2004;126:1175ŌĆō1189.


110. Kim KR, Jun CH, Cho KM, et al. Can proton pump inhibitors reduce rebleeding following Histoacryl sclerotherapy for gastric variceal hemorrhage? Korean J Intern Med 2015;30:593ŌĆō601.




111. Tan PC, Hou MC, Lin HC, et al. A randomized trial of endoscopic treatment of acute gastric variceal hemorrhage: N-butyl-2-cyanoacrylate injection versus band ligation. Hepatology 2006;43:690ŌĆō697.


112. El Amin H, Abdel Baky L, Sayed Z, et al. A randomized trial of endoscopic variceal ligation versus cyanoacrylate injection for treatment of bleeding junctional varices. Trop Gastroenterol 2010;31:279ŌĆō284.

113. Lo GH, Lin CW, Perng DS, et al. A retrospective comparative study of histoacryl injection and banding ligation in the treatment of acute type 1 gastric variceal hemorrhage. Scand J Gastroenterol 2013;48:1198ŌĆō1204.


114. Cal├©s P, Masliah C, Bernard B, et al. Early administration of vapreotide for variceal bleeding in patients with cirrhosis. N Engl J Med 2001;344:23ŌĆō28.

115. Kim MY, Um SH, Baik SK, et al. Clinical features and outcomes of gastric variceal bleeding: retrospective Korean multicenter data. Clin Mol Hepatol 2013;19:36ŌĆō44.



116. Qiao W, Ren Y, Bai Y, Liu S, Zhang Q, Zhi F. Cyanoacrylate injection versus band ligation in the endoscopic management of acute gastric variceal bleeding: meta-analysis of randomized, controlled studies based on the PRISMA Statement. Medicine (Baltimore) 2015;94:e1725.


117. Yoshida T, Hayashi N, Suzumi N, et al. Endoscopic ligation of gastric varices using a detachable snare. Endoscopy 1994;26:502ŌĆō505.


118. Lee MS, Cho JY, Cheon YK, et al. Use of detachable snares and elastic bands for endoscopic control of bleeding from large gastric varices. Gastrointest Endosc 2002;56:83ŌĆō88.


119. Pan├®s J, Ter├®s J, Bosch J, Rod├®s J. Efficacy of balloon tamponade in treatment of bleeding gastric and esophageal varices. Results in 151 consecutive episodes. Dig Dis Sci 1988;33:454ŌĆō459.

120. Mishra SR, Chander Sharma B, Kumar A, Sarin SK. Endoscopic cyanoacrylate injection versus beta-blocker for secondary prophylaxis of gastric variceal bleed: a randomised controlled trial. Gut 2010;59:729ŌĆō735.


-
METRICS

-
- 0 Crossref
- 2,490 View
- 37 Download
- Related articles in Korean J Helicobacter Up Gastrointest Res
-
Endoscopic Treatments in Perforation or Fistula in Upper Gastrointestinal Tract2024 March;24(1)
Endoscopic Treatment for Esophageal Cancer2019 September;19(3)
Endoscopic Classification of Intestinal Metaplasia2013 June;13(2)
Endoscopic Treatment of Gastric Subepithelial Tumor2015 March;15(1)
Endoscopic Hemostatic Treatment of Peptic Ulcer Bleeding2018 December;18(4)