Epstein-Barr virus 관련 위암
Epstein-Barr Virus-associated Gastric Carcinoma
Article information
Trans Abstract
Epstein-Barr virus-associated gastric carcinoma (EBVaGC) comprises approximately 10% of all gastric cancers and is now defined as one of the four subtypes of gastric cancer according to the molecular classification proposed by the Cancer Genome Atlas project. EBVaGC has characteristic genetic profiles that harbor a DNA methylation phenotype, frequent mutations in PIK3CA and ARID1A, and amplification of JAK2 and programmed death-ligand (PD-L)1/PD-L2. Therefore, EBVaGC shows several distinct clinicopathological features, including a male predominance, proximal stomach location, gastric carcinoma with lymphoid stroma histology, low risk of lymph node metastasis, and favorable prognosis. In clinical practice, patients with early EBVaGC might be good candidates for endoscopic resection or minimally invasive surgery since the rate of lymph node metastasis is very low, even with deep submucosal invasion. Furthermore, in the case of advanced EBVaGC, the applicability of immunotherapy has been investigated based on its increased expression of PD-L1 and high immunogenicity. In conclusion, EBV can serve as a biomarker in gastric cancer, and further identification of other molecular characteristics of EBVaGC is essential for new potential therapeutic targets.
서 론
Epstein-Barr virus (EBV)는 Herpes virus에 속하는 이중 나선형의 DNA 바이러스이고, 구인두의 상피세포에서 증식하면서 주로 타액을 통해 전파된다. 원발성 감염은 소아기에 별다른 증상 없이 지나가고, 이후로는 B림프구에 무증상의 잠복 감염 형태를 보이는데, 전 세계 성인 인구의 90% 이상에서 양성 혈청반응을 보이는 것으로 알려져 있다[1]. EBV 감염의 두 가지 주 표적세포는 잠복 감염을 나타내는 B림프구와 바이러스 증식이 일어나는 인후두상피세포로 버키트 림프종(Burkitt’s lymphoma), 비호지킨 림프종(non-Hodgikin’s lymphoma), 호지킨 림프종(Hodgikin’s lymphoma), 이식후 림프증식성질환(post-transplant lymphoproliferative disorder), 비인두암(nasopharyngeal carcinoma)과 같은 악성 종양을 유발할 수 있어 International Agency for Research on Cancer에서는 EBV를 group-1 carcinogen으로 분류하고 있다[2].
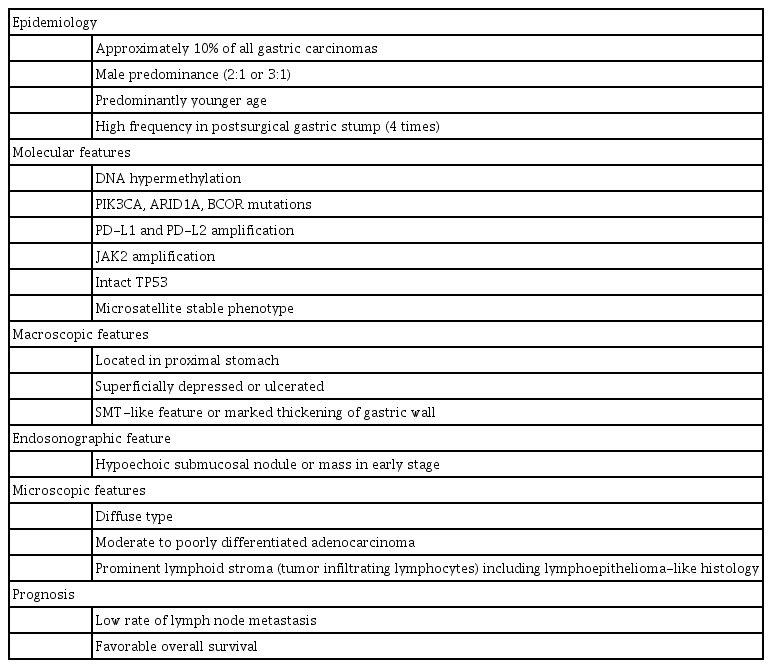
1990년 Burke 등이 EBV와 연관된 위암(EBV-associated gastric carcinoma, EBVaGC)을 처음으로 보고한 이후 이에 대한 여러 연구들이 있었다. 최근 보고에 따르면 EBVaGC는 EBV 연관 악성 종양 가운데 가장 흔하고, 전 세계적으로 연간 75,000-90,000예 정도 발생하는 것으로 알려져 있다. 이는 전체 위암 중 10%를 차지하며, 우리나라에서는 전체 위암의 5.6~13%가 EBV 감염과 연관성이 있다고 보고되고 있다[3-5]. EBVaGC는 위암의 분자학적 분류에 따라 별도의 유형으로 분류하고 있으며, 다른 유형의 위암과는 다른 유전적, 임상병리학적인 특성을 보이는 것으로 알려져 있다(Table 1) [3].
본고에서는 EBVaGC의 병인과 임상병리학적 특징을 고찰해보고 실제 진료에서 그 임상적 의의에 대해 알아보고자 하였다.
본 론
1. 병인
EBV가 어떤 경로로 위점막 상피세포에 침입하는지에 대해서는 아직도 불분명하다. 위점막 상피세포에는 CD21 antigen (C3d/EBV-receptor)이 없기 때문에 바이러스에 의한 위점막 상피세포로의 직접 감염 가능성은 낮고, EBV에 감염된 위점막 고유층의 B림프구에 의하여 위점막 상피세포와 세포 융합을 일으키거나 EBV-specific IgA를 매개체로 하여 바이러스를 위점막 상피세포로 전달할 것이라는 가설이 유력하다[6]. 하지만 아직 알려지지 않은 바이러스 수용체를 매개로 하여 EBV가 위점막 상피세포로 직접 침투할 수 있다는 의견도 있다[6]. 한편 EBV 감염은 암화 과정(carcinogenesis)에서 초기에 일어나는 것인지, 아니면 위점막 상피세포의 암성 변환 후에 감염이 일어나는 것인지에 대해서도 논란은 있지만, EBVaGC의 거의 모든 종양세포가 EBV에 균일하게 감염되어 있으면서 단클론성(monoclonality)의 EBV DNA를 나타내는 것으로 보아 상피세포가 악성으로 변형되기 이전에 바이러스 감염이 선행할 것으로 추정한다[7].
EBV 잠복 감염(latent infection)은 잠복 유전자(latent gene)의 표현형에 따라 3가지 아형으로 나누어지는데, EBVaGC에서는 EBV encoded small RNAs (EBERs), Epstein-Barr nuclear antigen-1 (EBNA-1), BamHI-A rightward transcripts (BARTs), BART miRNA가 나타나며, 약 반 수에서 latent membrane protein-2A (LMP-2A)가 발현되어 잠복 제1형 또는 제2형(latency type 1 or 2)을 나타낸다(Table 2) [8]. EBNA-1은 세포사멸과 숙주면역반응을 저해하고 genome 불안정화를 유도하여 세포의 초기 변형에 주요한 역할을 하는 반면, LMP-2A는 phosphatase and tensin homolog (PTEN)과 같은 종양억제유전자(tumor suppressor gene)를 억제하여 세포 증식과 이동에 관여함으로써 침습성 상피암에서 종양의 진행을 촉진하는 것으로 알려져 있다[9].
2. 분자적 특성
EBVaGC는 임상병리학적으로 특이한 성향을 보이는데, 이것은 다른 유형의 위선암과는 암 발생 기전이 다르기 때문으로 생각한다. 2014년 발표된 Cancer Genome Atlas (TCGA) project는 종합적인 분자적 분석(comprehensive molecular analysis)을 통해 위선암을 다음의 4가지 아형으로 분류하였다(Fig. 1) [10]: 1) EBVaGC, 2) gastric carcinoma with microsatellite instability (MSI), 3) gastric carcinoma with chromosomal instability, 4) genetically stable gastric carcinoma. EBVaGC는 다른 아형과는 다르게 높은 빈도의 DNA hypermethylation을 보이면서 CpG island methylator phenotype 발현이 높았으며, 특히 CDKN2A (p16INK4A) promoter hypermethylation을 거의 모든 경우에서 확인할 수 있었다[10]. 또한 EBVaGC의 80%에서 PIK3CA mutation이 관찰되었으며, JAK2, CD274 (programmed death-ligand [PD-L] 1), PDCD1LG2 (PD-L2)의 증폭과 ARID1A (55%)와 BCOR (23%) 유전자 변이도 흔하게 보이는 것으로 보고하였다[10]. 반면 TP53 과발현이나 MSI와의 관련성은 매우 낮은 것으로 알려져 있다[6]. 이러한 분자적 특성의 차이가 다른 아형과는 다른 기전으로 암 발생과 진행에 관여하여 특징적인 임상병리학적 소견을 나타낼 것으로 생각된다.
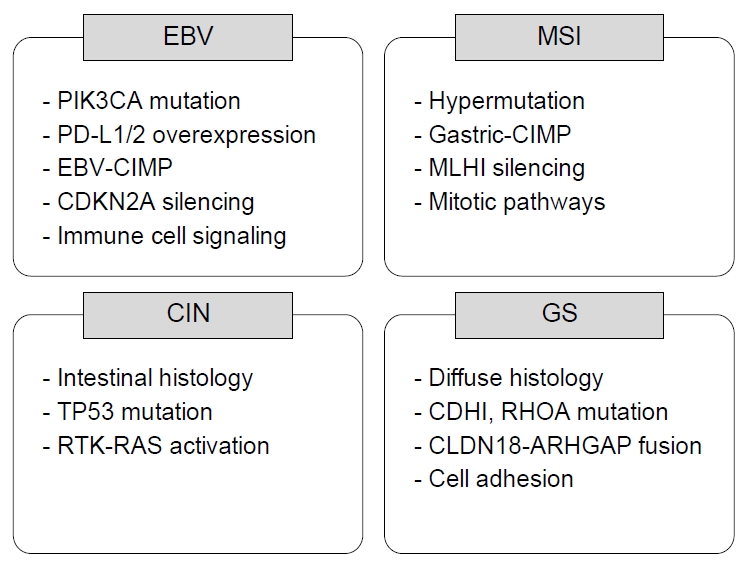
Molecular subtypes of gastric carcinoma. The four molecular subtypes of gastric carcinoma (GC) are as follows: 1) Epstein-Barr virus (EBV)-positive GC, 2) GC with microsatellite instability (MSI), 3) GC with chromosomal instability (CIN), and 4) genetically stable (GS) GC. CIMP, CpG island methylator phenotype; PD-L, programmed death-ligand; RTK, receptor tyrosine kinase.
3. 위험인자
최근 39개의 환자-대조군 연구(case-control study)를 분석한 메타분석에 따르면 EBVaGC의 위험도는 지역에 따라 다르며, 위암 발생률이 높은 극동 아시아 지역에서 높았다[11]. 흡연도 EBVaGC의 발생의 위험인자로 알려져 있으며, 비흡연자와 비교하였을 때 현재 흡연자(current smoker)에서 2.4배, 과거 흡연자(former smoker)에서 2배 정도 EBVaGC의 발병이 높다[12]. 또한, human immunodeficiency virus나 Helicobacter pylori (H. pylori)와 동반 감염된 경우에서 위암 발생이 증가할 수 있는데[4], 한 연구에 따르면 H. pylori와 EBV의 중복 감염이 일어난 경우에 각각의 단독 감염에 비하여 중증 위염(severe polymorphonuclear and mononuclear cell infiltration according to Sydney system)과의 연관성이 유의하게 높았다[13]. 이는 H. pylori와 EBV의 중복 감염에서 조직 손상을 일으키는 각각의 염증반응이 단순히 더해진 결과인지 H. pylori와 EBV 유전자 사이의 밀접한 상호작용으로 인한 것인지에 대해서는 명확하지 않으며, 일부 연구[14]는 EBV와 H. pylori 간의 상호 연관이 없었다고 하여 이에 대해서는 좀 더 연구가 필요할 것으로 보인다. 이전 한 연구는 위궤양 병력이 EBVaGC의 위험을 증가시킨다고 하였으며, 위 절제술 후 잔위에서 발생한 위암 가운데 35%가 EBVaGC였음을 근거로 하여 EBVaGC의 발생에 있어 위점막의 화학적 손상이 중요한 요인임을 제시하였다[15]. 또 다른 연구에서는 악성 빈혈(pernicious anemia)이 있는 환자에서 EBVaGC의 빈도가 2배 정도 높아 위축성 위염과 악성 빈혈이 발생을 증가시키는 요인일 것으로 주장하였다[16].
4. 임상병리학적 특징
EBVaGC는 전체 위암 가운데 약 10% (1.3~20.1%)로 보고되고 있으며, 남성에서 2~3배 정도 발생 빈도가 높고, 특히 젊은 연령에서 흔하게 발견된다[4]. 특정 지역에서 호발하는 버키트 림프종이나 비인두암과는 달리 전 세계적 분포를 보이나 전체 위암에서 EBVaGC가 차지하는 비율은 지역별로 차이를 보이는데, 우리나라의 경우 전체 위암의 5.6~13%에서 EBV 감염과 연관성이 있음을 보고하였다[5].
위 근위부에서 많이 발생하고, 국내의 한 보고에 따르면 EBVaGC의 84.4%가 위의 중상부에 위치하였다[17]. Lauren 분류법에 따른 조직학적 형태는 미만형(diffuse type)이 흔하며, World Health Organization 분류법에 따르면 중등도-저분화(moderate to poorly differentiated) 선암의 특성을 보이는데 한 연구에서는 EBVaGC의 76.2%가 저분화 위암임을 보고하였다[4]. 특징적으로 림프상피종성 암종(lymphoepithelioma-like carcinoma, LELC)이라고도 불리는 림프성 기질을 가진 위암종(gastric carcinoma with lymphoid stroma, GCLS)의 80%에서 EBV 양성을 보이는 것으로 알려져 있다[18]. GCLS는 전체 위암에서는 1~4%를 차지하는 드문 조직형으로 림프구 침윤(lymphoid infiltration)이 동반된 특별한 형태의 위암종이다. 비결합조직성 간질에 많은 림프구 및 형질세포가 미만성으로 전 종양에 걸쳐 일정하게 침윤되어 있고, 다양한 배열을 보이는 비교적 작은 양의 종양세포가 사이사이의 간질에 의해 나눠지는 모양(lace-like or small nested patten)을 가진다[19]. 이러한 림프성 기질반응은 주로 세포 독성 CD8+ T림프구에 의해 일어나는데, EBV 자체에 대한 직접반응이기보다는 EBV에 감염된 세포에 표현된 바이러스 항원에 대한 항원-항체반응, 즉 숙주 세포면역반응(host cellular immune response)이 활성화된 결과로 예상한다[20]. 림프구 침윤 정도에 따라 EBVaGC를 typical LELC, Crohn’s disease-like lymphocytic reaction (CLR), conventional type adenocarcinoma (CA)의 세 가지 유형으로 분류할 수 있으며, 일반적으로 GCLS는 typical LELC에 CLR 조직형을 포함한 개념으로 받아들여지고 있다(Fig. 2) [20].
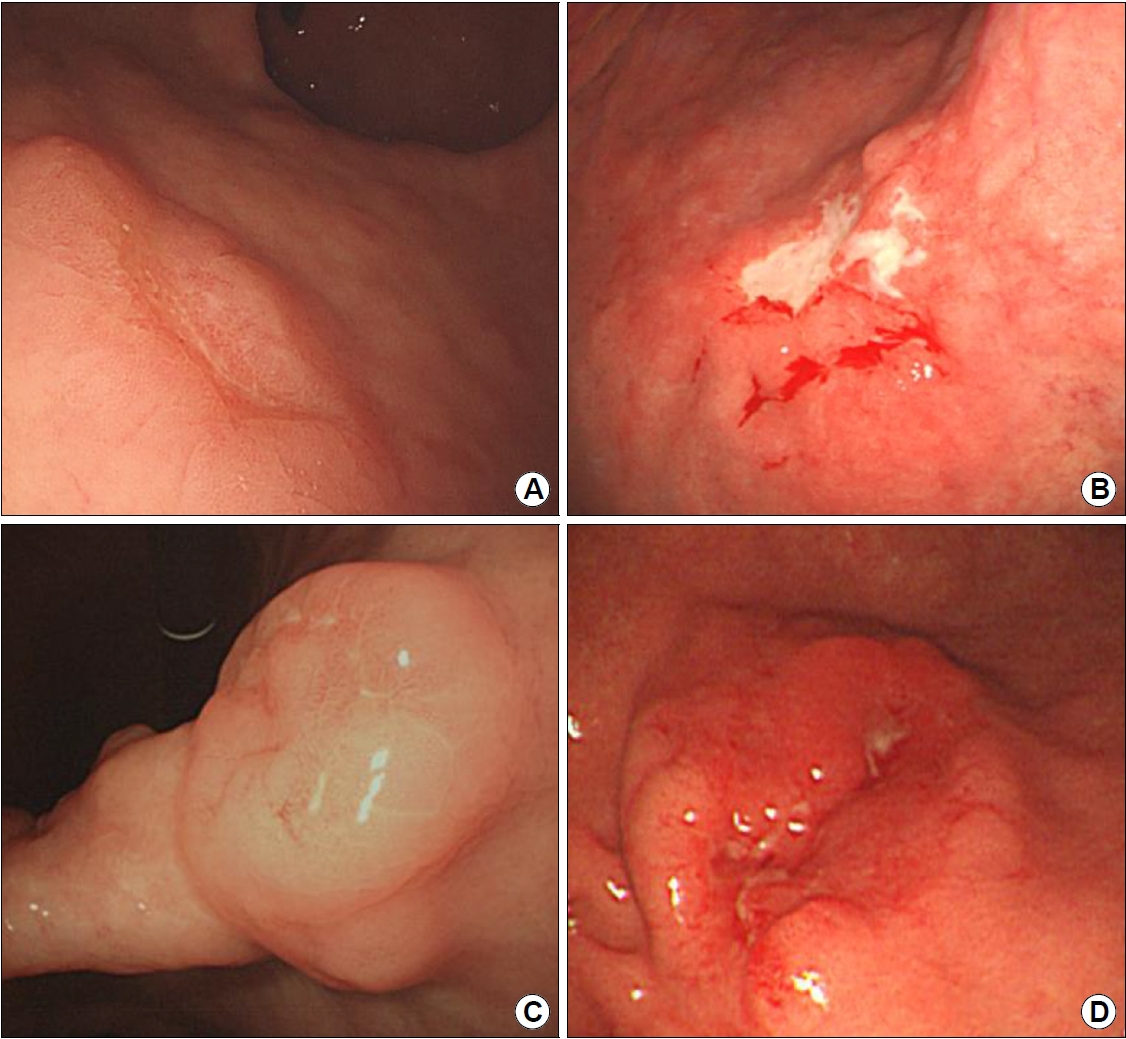
Endoscopic findings of Epstein-Barr virus-associated gastric carcinoma. (A) Superficially depressed lesion on the anterior wall of the antrum. (B) Ulcerative lesion on the greater curvature/posterior wall of the upper body. (C) Submucosal tumor-like morphology on the posterior wall of the angle. (D) Marked gastric wall thickening with ulceration on the greater curvature of the lower body.
EBVaGC는 육안적으로 표면 함몰형(superficially depressed) 또는 궤양형(ulcerative)이 흔하며, 많은 경우에서 위벽 비후가 두드러지면서 점막하종양 유사 위암(submucosal tumor-like carcinoma)의 형태로 보인다(Fig. 3) [21]. 이러한 육안형은 종양세포에 동반된 풍부한 림프성 기질로 인하여 발생하며 내시경 초음파에서 특징적인 저에코성 점막하 결절(hypoechoic submucosal nodule)을 관찰할 수 있다(Fig. 4) [22,23].
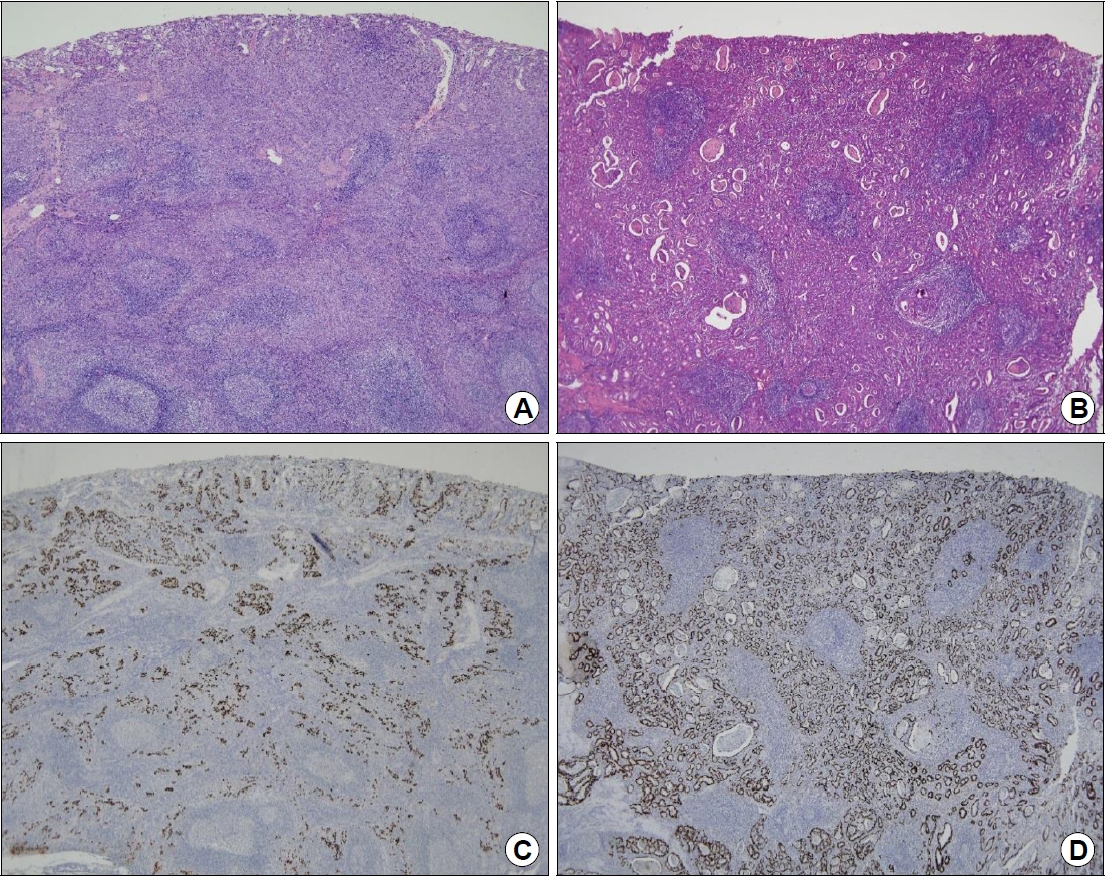
Histologic findings of Epstein-Barr virus-associated gastric carcinoma (EBVaGC) with lymphoid stroma. (A) Typical lymphoepithelioma-like carcinoma shows dense lymphocytic infiltration, accompanied by a syncytial growth pattern with poorly formed glandular structures (hematoxylin and eosin [H&E], ×40). (B) In Crohn’s disease-like lymphocytic reaction, tumor cells show frequent tubule formation with fewer lymphoid stroma than tumor cells (H&E, ×40). (C, D) EBV in situ hybridization highlights tumor cells (×40). Adapted from the article of Shin et al. Surg Endosc 2017;31:4156-4164, with permission [23].
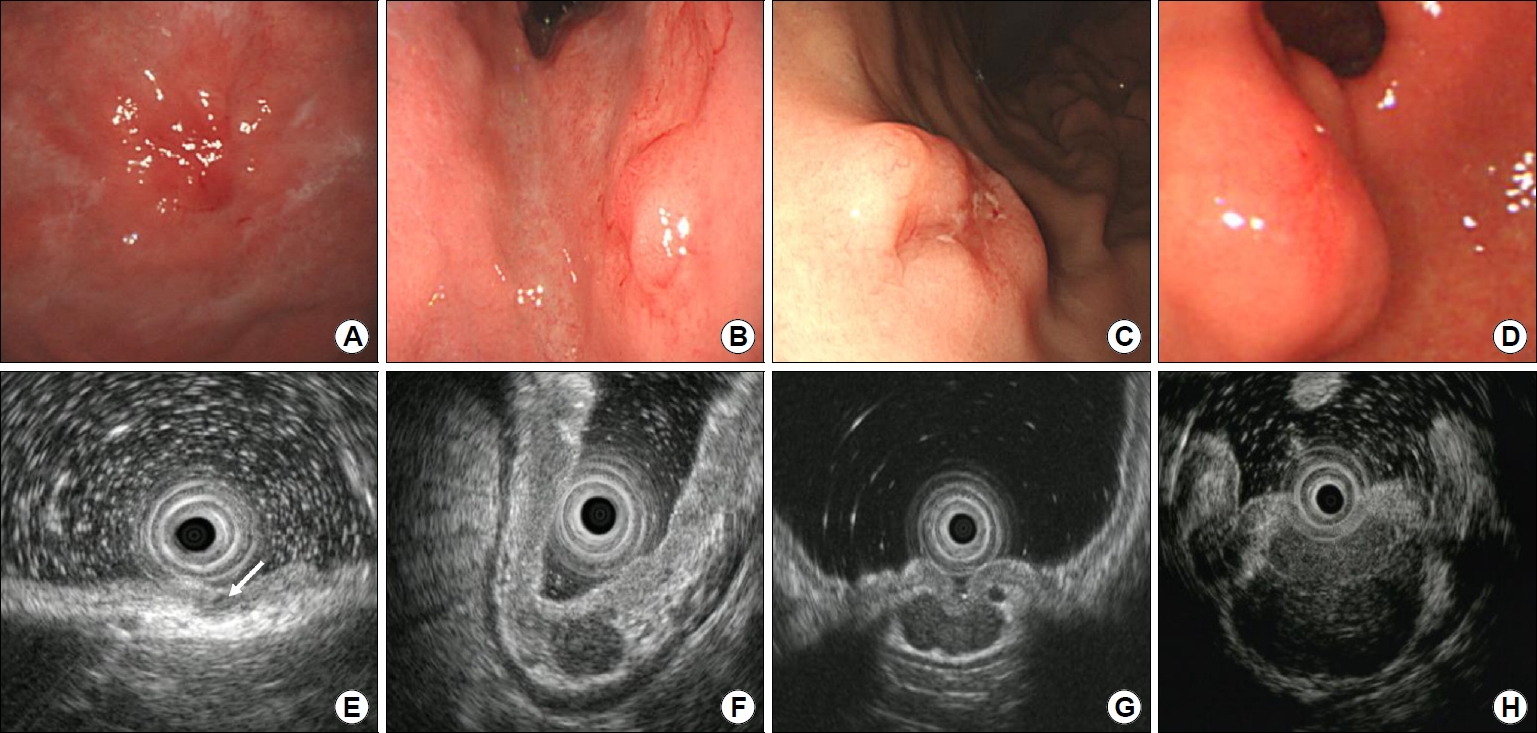
Endosonographic images of early Epstein-Barr virus-associated gastric carcinoma (EBVaGC) with lymphoid stroma. (A, E) Marked hypoechogenicity in the mucosal layer at the center of the tumor (arrow); mucosal cancer (confined to muscularis mucosa) on the gastric fundus. (B, F) A hypoechoic round submucosal nodule; SM3 cancer (2,000 µm invasion from the muscularis mucosa) on the upper body. (C, G) Hypoechoic submucosal nodules; SM3 cancer (3,125 µm invasion from the muscularis mucosa) on the lower body. (D, H) A hypoechoic submucosal mass; SM3 cancer (6,500 µm invasion from the muscularis mucosa) on the prepylorus. Adapted from the article of Shin et al. Surg Endosc 2017;31:4156-4164, with permission [23].
5. 진단
EBVaGC를 진단하기 위해서는 종양세포에서 EBV가 검출되어야 한다. 조직에서의 EBV 검출은 제자리부합법(in situ hybridization, ISH)과 중합효소연쇄반응(polymerase chain reaction, PCR)을 이용하여 다음의 진단 표지자(diagnostic marker)를 확인한다: 1) small RNA EBER1/EBER2 for ISH, 2) EBNA-1, Bam-M, BamHI-W viral antigens for PCR [24]. 일반적인 유전물질 검출에는 유전자 증폭이 수반되는 PCR이 민감도가 높지만, 종양 조직내 잠복 감염된 B림프구에 의해 위양성을 초래하기도 한다. 이러한 이유로 ISH 방법이 비교적 민감도는 낮지만 EBVaGC를 진단하는 데 있어 표준 진단법(gold standard)이라 하겠다[24].
6. 예후
EBV 음성 위암과 비교하여 종양의 침윤 정도(T stage)와 림프절 전이(N state) 빈도가 낮아 일반적으로 좋은 예후를 보인다[4]. 조기(early stage) EBVaGC에서의 림프절 전이율은 점막암과 점막하 침윤암에서 각각 2.2~4.2%와 14.0~23.6%로 보고되었고[17], 한 메타분석에 따르면 EBVaGC 환자군에서 생존 기간의 중앙값(median survival time)이 길었다(8.5년 vs. 5.3년) [25]. 다른 연구에서도 EBVaGC 환자군에서 대조군보다 1기 환자의 비율이 더 많으면서(37.4% vs. 4.9%), 더 나은 생존율을 보임을 주장하였다(5-year overall survival rate: 71.4% vs. 56.1%; 5-year disease-free survival rate: 67.5% vs. 55.2%) [20]. TCGA project에 따라 위암을 분류하여 분석한 최근 국내 연구에서도 진행성 EBVaGC 환자에서 화학요법(chemotherapy) 후 전체 생존 기간(overall survival)과 무재발 생존 기간(relapse-free survival)이 더 나은 결과를 보여주었다[26].
EBVaGC의 예후는 종양의 크기, 림프절 전이 여부 외에도 환자의 염증반응이 중요한 역할을 하는 것으로 알려져 있다. EBVaGC를 림프구 침윤 정도에 따라 전형적인 LELC와 CLR, CA로 분류하였을 때 LELC와 CLR 조직형에서 더 긴 전체 생존 기간(hazard ratio 각각 0.09와 0.42)과 무질병 생존 기간(disease-free survival; hazard ratio 각각 0.05와 0.46)을 보였다[20]. 이것은 EBVaGC의 예후가 환자의 염증반응(host inflammatory response)에 의존한다는 근거로서 림프구성 침윤이 숙주의 세포면역과 체액성 면역반응을 반영하며 암세포에 대한 일종의 방어기전으로 작용할 것으로 생각한다[27]. 최근 연구에서도 EBVaGC에서 종양침윤성 림프구(tumor infiltrating lymphocytes, TILs)가 환자의 무재발 생존 기간(hazard ratio, 12.193)과 무질병 생존 기간(hazard ratio, 4.836)을 향상시켰으며, 낮은 TILs은 국소림프절 전이와 나쁜 예후를 예측할 수 있는 인자라고 보고하였다[28]. GCLS의 형태를 보이는 EBVaGC가 항암제에도 더 잘 반응하는 것으로도 보고하였는데, 이는 간질에 림프구 침윤이 풍부하여 종양 기질내 결체 조직과 섬유화가 거의 없기 때문에 항암제가 종양세포로 더 잘 침투할 수 있다는 점과 종양세포가 EBV에 감염됨으로써 항암제에 대해 높은 예민도를 가지게 된 것으로 추측한다[29].
이 외에도 종양의 크기(>5 cm), PD-L1 overexpression, PTEN과 ARID1A와 같은 종양억제유전자의 소실, PIK3CA 증폭과 같은 유전자 변이가 있는 경우에서는 EBVaGC의 예후가 나쁜 것으로 알려져 있다[4,30].
7. 임상적 의의
EBVaGC는 대부분에서 미만형 또는 저분화 선암의 조직형을 보이기 때문에 조기 위암이라 하더라도 Gotoda 등[31]이 제시한 내시경 절제술의 일반적인 적응증이 되지 않는다. 하지만 GCLS의 형태를 보이는 조기 위암(early gastric carcinoma with lymphoid stroma, EGCLS)의 경우에서는 분화암과 비교하여 림프절 전이의 위험이 같거나 오히려 더 낮다고 보고되고 있으며 점막하 침윤이 있는 경우에서도 림프절 전이의 빈도가 매우 낮았다[23,32,33]. 국내 연구들에서도 EGCLS의 침윤 깊이에 따른 림프절 전이 여부를 분석하였을 때 SM1/SM2 침윤암에서 림프절 전이가 발견되지 않았다[23,32]. 이러한 결과를 종합해 보면 EGCLS의 조직형을 보이는 EBVaGC의 경우에서 미만형의 조직형을 보이거나 점막하 침윤이 있다 하더라도 내시경 절제술이 효과적인 치료가 될 수 있음을 조심스럽게 생각해볼 수 있다. 하지만 내시경 절제술의 적응증으로 정립되기 위해서는 좀 더 많은 전향적 연구가 필요하며, 현재로서는 기저질환으로 인하여 전신 상태가 좋지 않은 환자 또는 위전절제술의 부담이 있는 환자에서 내시경 절제술을 효과적인 대안으로 고려해볼 수 있겠다.
한편 EBVaGC는 면역원성(immunogenicity)이 높은 위암으로 PD-L1/PD-L2의 발현이 높고, CD8+ TILs가 풍부하여 면역관문억제제(immune check point inhibitor)에 반응이 좋을 것으로 기대되어 왔다[27]. Anti-PD-L1 antibody인 pembrolizumab을 사용한 phase II trial은 PD-L1 양성 위암 환자에서 PD-L1 음성 위암 환자와 비교하여 약제의 전체 반응률(overall response rate)이 높았음(15.5% vs. 5.5%)을 보고하였고, nivolumab을 이용한 phase III trial에서는 EBVaGC 환자의 전체 생존 기간의 중앙값(median overall survival)이 향상된 것으로 나타났다(5.3 vs. 4.1 months) [4]. 이 외에도 PIK3K 억제제나 demethylating agent의 치료 효과를 확인하기 위한 연구들도 시도되고 있지만, 현재까지 일관된 결과를 보여주고 있지 않아 후속 연구들의 결과를 기다려 보아야 할 것이다.
결 론
EBVaGC는 다른 유형의 위암과는 다른 유전적, 임상병리학적 특성을 보이며, 특징적으로 GCLS 형태의 조직형을 관찰할 수 있다. GCLS에서 동반되는 림프구성 기질은 EBV 감염 종양세포에 대한 일종의 숙주면역반응으로 항종양 효과(anti-tumor effect)를 나타내어 EBVaGC의 좋은 예후와 연관된 인자로 생각한다. GCLS의 80%에서 EBV 양성을 보이기 때문에 GCLS의 조직형을 보이는 위암 조직에서 EBV를 진단하는 것이 필요한데, EBER ISH가 EBVaGC를 진단하는 적합한 표준 검사법이다. 임상적인 측면에서 GCLS의 조직형을 보이는 조기 EBVaGC의 경우 다른 유형의 암과 비교하여 림프절 전이율이 매우 낮기 때문에 점막하 침윤이 있다 하더라도 내시경 절제술의 효과적인 대상으로 고려해 볼 수 있으며, 진행성 EBVaGC의 경우 PD-L1의 발현이 높아 면역관문억제제 치료 효과에 대한 기대를 하고 있으며 많은 면역억제제 치료 연구를 진행하고 있다. 결론으로 EBV는 위암 진단에 있어 예후를 예측하고 치료 계획을 결정하는 새로운 생체표지자(novel biomarker)로서 중요하고, EBVaGC에서 실제 예후를 향상시킬 수 있는 새로운 표적 항원의 개발과 연구가 필요하다.
Notes
No potential conflict of interest relevant to this article was reported.