 |
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 20(3); 2020 > Article |
|
Abstract
Achalasia is a rare primary esophageal motility disorder characterized by the loss of enteric neurons leading to an absence of peristalsis and impaired relaxation of the lower esophageal sphincter. The subsequent stasis of ingested food not only leads to symptoms of dysphagia, regurgitation, chest pain, and weight loss, but also results in an increased risk of esophageal carcinoma. Structural or functional pulmonary abnormalities occur in more than half of patients and may be due to recurrent aspiration or tracheal compression from a dilated esophagus. Delayed diagnosis or ineffective intervention may lead to progressive dilation of the esophagus and the development of a megaesophagus. Respiratory distress and cardiopulmonary arrest from tracheal or left atrial compression secondary to a megaesophagus are rare complications of achalasia. There is only limited evidence that pneumatic dilation may be used as a first-line therapy for a megaesophagus. The choice of definitive treatment will depend on many factors including achalasia type, patient wishes, performance status, and surgical expertise.
ņŗØļÅäņØ┤ņÖäļČłļŖźņ”Ø(achalasia)ņØĆ ņŚ░ĒĢśņŗ£ ņŗØļÅä ņ▓┤ļČĆņØś ņŚ░ļÅÖņÜ┤ļÅÖ ņåīņŗżĻ│╝ ĒĢśļČĆņŗØļÅäĻ┤äņĢĮĻĘ╝ņØś ļČłņÖäņĀäĒĢ£ ņØ┤ņÖäņØä ļ│┤ņØ┤ļŖö ņŗØļÅäņÜ┤ļÅÖ ņ¦łĒÖśņØ┤ļŗż[1]. ĒĢśļČĆņŗØļÅäĻ┤äņĢĮĻĘ╝ņØś ĒÅÉņćäļĪ£ ņØīņŗØļ¼╝ņØ┤ ņŗØļÅä ļé┤Ļ░ĢņŚÉ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņĀĢņ▓┤ļÉśņ¢┤ ņé╝Ēé┤Ļ│żļ×Ć, ņåīĒÖöļÉśņ¦Ć ņĢŖņØĆ ņØīņŗØļ¼╝ņØś ņŚŁļźś, ĒØĪņØĖņä▒ ĻĖ░ņ╣©, ĒØēĒåĄ, ņ▓┤ņżæ Ļ░Éņåī ļō▒ņØś ņ”ØņāüņØä ņ£Āļ░£ĒĢ£ļŗż[2]. ņ¦äļŗ©ņØ┤ ņ¦ĆņŚ░ļÉśĻ▒░ļéś ņ╣śļŻīĻ░Ć ļČłņČ®ļČäĒĢ£ Ļ▓ĮņÜ░ ņŗØļÅä ĒÖĢņןņØ┤ ņ¦äĒ¢ēļÉśņ¢┤ Ļ▒░ļīĆ ņŗØļÅä(megaesophagus)ļĪ£ ļ│ĆĒśĢļÉśļŖö ļ¦ÉĻĖ░ ņŗØļÅäņØ┤ņÖäļČłļŖźņ”Ø(end-stage achalasia)ņ£╝ļĪ£ ļ░£ĒśäĒĢ£ļŗż[3]. ĒÖĢņןļÉ£ Ļ▒░ļīĆ ņŗØļÅäļŖö ĒØēĻ░Ģ ļ░Å ņŻ╝ļ│Ć ņóģĻ▓®ļÅÖ ņןĻĖ░ļź╝ ņĢĢļ░ĢĒĢśņŚ¼ ņżæņ”Ø ĒĢ®ļ│æņ”ØņØä ņ£Āļ░£ĒĢĀ ņłś ņ׳ļŗż. ļ░śļ│ĄņĀüņØĖ ļ»ĖņäĖ ĒØĪņØĖņØ┤ļéś ĒÖĢņןļÉ£ ņŗØļÅäņŚÉ ņØśĒĢ£ ĻĖ░ļÅä ņĢĢļ░Ģņ£╝ļĪ£ ĻĄ¼ņĪ░ņĀü ļśÉļŖö ĻĖ░ļŖźņĀü ĒÅÉ ņØ┤ņāüņØä ņ┤łļלĒĢĀ ņłś ņ׳ņ£╝ļ®░[4], ĻĖēņä▒ ņāüĻĖ░ļÅä ĒÅÉņćäņÖĆ Ļ░ÖņØĆ ĒśĖĒØĪĻĖ░ ĒĢ®ļ│æņ”Ø ļ░£ņāØņØ┤ Ļ░ĆļŖźĒĢśļŗż[5]. ļśÉĒĢ£ ņŻ╝ļ│Ć ĒśłĻ┤Ć ņĢĢļ░Ģņ£╝ļĪ£ ņØĖĒĢ£ ņŗ¼ĒśłĻ┤ĆĻ│ä ĒŚłĒāł ļ░Å ņóīņŗ¼ļ░®ņØä ņĢĢļ░ĢĒĢśņŚ¼ ļČĆņĀĢļ¦ź ļ░Å ĒśłņŚŁĒĢÖņĀü ļČłņĢłņĀĢņØä ņ£Āļ░£ĒĢĀ ņłś ņ׳ņ£╝ļéś[6], ĻĖēņä▒ ĒśĖĒØĪļČĆņĀä ļ░Å ņŗ¼ņĀĢņ¦ĆņŚÉ ņØ┤ļź┤ļŖö Ļ▓ĮņÜ░ļŖö ļ¦żņÜ░ ļō£ļ¼╝ļŗż[7]. ņĀĆņ×ÉļōżņØĆ Ļ▒░ļīĆ ņŗØļÅäņŚÉ ņØśĒĢ£ ņóīņŗ¼ļ░® ņĢĢļ░Ģņ£╝ļĪ£ ļ░£ņāØĒĢ£ ĻĖēņä▒ ņŗ¼ņĀĢņ¦Ćļź╝ ļÅÖļ░śĒĢ£ ļ¦ÉĻĖ░ ņŗØļÅäņØ┤ņÖäļČłļŖźņ”Ø ĒÖśņ×Éļź╝ Ļ▓ĮĒŚśĒĢśĻ│Ā ĒÆŹņäĀĒÖĢņןņłĀļĪ£ ņ╣śļŻīĒĢśņśĆĻĖ░ņŚÉ ļ¼ĖĒŚī Ļ│Āņ░░Ļ│╝ ĒĢ©Ļ╗ś ļ│┤Ļ│ĀĒĢśļŖö ļ░öņØ┤ļŗż.
67ņäĖ ļé©ņ×ÉĻ░Ć ĒĢ£ļŗ¼ ņĀäļČĆĒä░ ļ░£ņāØĒĢ£ ņé╝Ēé┤Ļ│żļ×Ć ļ░Å ĻĄ¼ĒåĀļź╝ ņŻ╝ņåīļĪ£ ļé┤ņøÉĒĢśņśĆļŗż. ņĢĮ 8ļģä ņĀäļČĆĒä░ Ļ░äĒŚÉņĀüņØĖ ĻĄ¼ĒåĀ ņ”ØņäĖĻ░Ć ņ׳ņŚłņ£╝ļéś ņ╣śļŻīļź╝ ĒĢśņ¦Ć ņĢŖņĢśņ£╝ļ®░ 2ļģä ņĀäļČĆĒä░ ņØīņŗØļ¼╝ ņŚŁļźś ņ”Øņāüņ£╝ļĪ£ Ļ░£ņØĖļ│æņøÉņŚÉņä£ ņŚŁļźśņä▒ ņŗØļÅäņŚ╝ņ£╝ļĪ£ ņ¦äļŗ©ļ░øĻ│Ā ņĢĮļ¼╝ ņ╣śļŻīļź╝ ĒĢśņśĆņ£╝ļéś ņ”ØņāüņØś ņĢģĒÖöņÖĆ ĒśĖņĀäņØä ļ░śļ│ĄĒĢśņśĆļŗż. ĒĢ£ļŗ¼ ņĀäļČĆĒä░ ļ¼╝Ļ│╝ Ļ│ĀĒśĢņŗØņØś ņé╝Ēé┤Ļ│żļ×Ć ļ░Å ņŗØņé¼ ņ¦üĒøä ĻĄ¼ĒåĀ ņ”ØņäĖĻ░Ć ņ¦ĆņåŹļÉśĻ│Ā 1ņŻ╝ ņĀäņŚÉļŖö ņłśļ®┤ ņżæ ĻĄ¼ĒåĀĻ░Ć ļ░£ņāØĒĢśņŚ¼ ņåīĒÖöĻĖ░ļé┤Ļ│╝ ņÖĖļלļĪ£ ļé┤ņøÉĒĢśņśĆļŗż. Ļ│╝Ļ▒░ļĀźņŚÉņä£ ļ│ĖĒā£ņä▒ Ļ│ĀĒśłņĢĢņ£╝ļĪ£ 5ļģäĻ░ä ņĢĮņĀ£ļź╝ ļ│ĄņÜ®ĒĢśņśĆņ£╝ļ®░, 30ļģä ņĀä ņ£äņ▓£Ļ│Ą ņłśņłĀņØä ĒĢśņśĆļŗż. ņŗĀņ▓┤ Ļ▓Ćņé¼ņŚÉņä£ ļ¦īņä▒ ļ│æņāēņØ┤ņŚłņ£╝ļ®░ ņןņØīņØĆ ņĀĢņāüņØ┤ņŚłĻ│Ā, ĻĘĖ ņÖĖņŚÉ ĒŖ╣ņØ┤ ņåīĻ▓¼ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. ņŗ¼ņĀäļÅä ļ░Å ĒØēļČĆ ļŗ©ņł£ ņ┤¼ņśüņŚÉņä£ ņØ┤ņāü ņåīĻ▓¼ņØĆ ņŚåņŚłļŗż. ĒØēļČĆ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ ņĀäļ░śņĀüņØĖ ņŗØļÅäņØś ĒÖĢņןĻ│╝ ņŗØļÅä ļé┤Ļ░Ģ ļé┤ ņĢĪņ▓┤ ņĀĆļźś ņåīĻ▓¼ņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż(Fig. 1).
ņāüļČĆņ£äņןĻ┤Ć ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ņŚÉņä£ ņŗØļÅä ņ▓┤ļČĆņØś ļ╣äņĀĢņāüņĀüņØĖ ĒÖĢņןĻ│╝ ņØīņŗØļ¼╝ ņĀĆļźśĻ░Ć Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░ ņ£äņŗØļÅäņĀæĒĢ®ļČĆĻ░Ć ļÅÖņŗ¼ņøÉņāüņ£╝ļĪ£ Ļ░ĢĒĢśĻ▓ī ņłśņČĢļÉśņ¢┤ ņóüņĢäņĀĖ ņ׳ņŚłļŗż(Fig. 2A). ņŗØļÅä ņĀÉļ¦ē ņĪ░ņ¦ü Ļ▓Ćņé¼ņŚÉņä£ ĒŖ╣ņØ┤ ņåīĻ▓¼ņØĆ ņŚåņŚłņ£╝ļ®░, ņŗØļÅäņĪ░ņśüņłĀņŚÉņä£ ņŗØļÅä ņ▓┤ļČĆņØś ĒÖĢņן ļ░Å ņŚ░ļÅÖņÜ┤ļÅÖ ņåīņŗżĻ│╝ ņŗ¼ĒĢ£ ņøÉņ£äļČĆ ņŗØļÅäĒśæņ░®ņ£╝ļĪ£ ņØĖĒĢ£ ĒĢśļČĆ ņŗØļÅäņØś ņāłļČĆļ”¼(birdŌĆÖs beak) ļ¬©ņ¢æņØ┤ Ļ┤Ćņ░░ļÉśņŚłĻ│Ā(Fig. 2B), ņŗØļÅäļé┤ņĢĢ Ļ▓Ćņé¼ņŚÉņä£ ņŚ░ĒĢś ņŗ£ ĒĢśļČĆņŗØļÅäĻ┤äņĢĮĻĘ╝ņØś ļČłņØ┤ņÖäĻ│╝ ņŗØļÅä ņ▓┤ļČĆņØś ņŚ░ļÅÖņÜ┤ļÅÖņØś ņåīņŗż ļ░Å ļé«ņØĆ ņĢĢļĀźņØś ļÅÖņŗ£ņä▒ ņłśņČĢņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż(Fig. 2C). Ļ│ĀĒśĢņŗØņØä ņØ┤ņÜ®ĒĢ£ ļÅÖņ£äņøÉņåī ņŗØļÅäĒåĄĻ│╝ Ļ▓Ćņé¼ņŚÉņä£ Ļ▓Ćņé¼ 10ļČäņŚÉ 55%, 20ļČäņŚÉ 57%ņØś ņ×öļźśņ£©ļĪ£ ĒśäņĀĆĒĢ£ ĒåĄĻ│╝ ņŗ£Ļ░äņØś ņ¦ĆņŚ░ņØä ļ│┤ņśĆļŗż(Fig. 2D). Eckardt ņ”Øņāü ņĀÉņłśļŖö 10ņĀÉ(ņé╝Ēé┤Ļ│żļ×Ć 3, ņŚŁļźś 3, ĒØēĒåĄ 1, ņ▓┤ņżæ Ļ░Éņåī 3)ņ£╝ļĪ£ ņŗ¼ĒĢ£ ņŗØļÅäņØ┤ņÖäļČłļŖźņ”Øņ£╝ļĪ£ ņ¦äļŗ©ĒĢśĻ│Ā ĒÆŹņäĀĒÖĢņןņłĀņØä ĻČīņ£ĀĒĢśņśĆņ£╝ļéś ņŗ£ņłĀ ĒĢ®ļ│æņ”ØņŚÉ ļīĆĒĢ£ ļæÉļĀżņøĆņ£╝ļĪ£ ĒÖśņ×ÉĻ░Ć Ļ▒░ļČĆĒĢśņŚ¼ Ēć┤ņøÉĒĢśņśĆļŗż.
ĒÖśņ×ÉļŖö 2ņŻ╝ Ēøä ĒśĖĒØĪĻ│żļ×ĆĻ│╝ ĻĖ░ņ╣© ļ░Å ļåŹņä▒ Ļ░Øļŗ┤ņ£╝ļĪ£ ņØæĻĖēņŗżļĪ£ ļŗżņŗ£ ļé┤ņøÉĒĢśņśĆļŗż. ĒÖ£ļĀźņ¦ĢĒøäļŖö ĒśłņĢĢ 125/80 mmHg, ļ¦źļ░Ģņłś 71ĒÜī/ļČä, ĒśĖĒØĪņłś 26ĒÜī/ļČä, ņ▓┤ņś© 38.6ŌäāņśĆļŗż. Ļ▓Ćņé¼ņŗż ņåīĻ▓¼ņØĆ ļ¦Éņ┤łĒśłņĢĪ Ļ▓Ćņé¼ņŚÉņä£ ļ░▒ĒśłĻĄ¼ 10,990/mm3, Ēśłņāēņåī 15.0 g/dL, ĒśłņåīĒīÉ 254,000/mm3ņśĆļŗż. Ēśłņ▓Ł ņāØĒÖöĒĢÖ Ļ▓Ćņé¼ļŖö ņĢīļČĆļ»╝ 4.6 g/dL, ņÜöņåīņ¦łņåī 14.0 mg/dL, Ēśłņ▓Ł Ēü¼ļĀłņĢäĒŗ░ļŗī 0.95 mg/dL, ņ┤Ø ļ╣īļ”¼ļŻ©ļ╣ł 0.55 mg/dL, AST/ALT 28/24 IU/LņśĆņ£╝ļ®░, Ēśłņ▓Ł ņĀäĒĢ┤ņ¦ł Ļ▓Ćņé¼ļŖö ļéśĒŖĖļź© 137 mEq/L, ņ╣╝ļź© 4.1 mEq/L, ņ╣╝ņŖś 8.4 mg/dL, ļ¦łĻĘĖļäżņŖś 2.1 mg/dLņśĆņ£╝ļ®░, C-ļ░śņØæņä▒ ļŗ©ļ░▒ņ¦łņØĆ 178 mg/LļĪ£ ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ņŚłļŗż. ĒØēļČĆ ļŗ©ņł£ņ┤¼ņśüņŚÉņä£ ņ¢æņĖĪ ĒÅÉņĢ╝ņØś ņØīņśüņØ┤ ņ”ØĻ░ĆļÉśņ¢┤ ņ׳ņŚłņ£╝ļ®░, Ļ│ĀĒĢ┤ņāüļÅä ĒØēļČĆ ļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ ņ¢æņĖĪ ĒÅÉĒĢśļČĆ, ņÜ░ņżæņŚĮ ļ░Å ņóīņāüņŚĮ ĒÅÉļĀ┤ ņåīĻ▓¼ņØ┤ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░ ņŗØļÅä ĒĢśļČĆĻ░Ć ĒīĮņ░ĮļÉ£ ņåīĻ▓¼ņØ┤ņŚłļŗż(Fig. 3).
ĻĖēņä▒ ĒÅÉļĀ┤ņ£╝ļĪ£ ņ¦äļŗ©ĒĢśĻ│Ā ņ×ģņøÉĒĢśņŚ¼ 5ņØ╝Ļ░ä ĒĢŁņāØņĀ£ ņ╣śļŻī Ēøä ņ×äņāü ņ”ØņāüĻ│╝ ļ░®ņé¼ņäĀĒĢÖņĀü Ļ▓Ćņé¼ ņåīĻ▓¼ņØ┤ ĒśĖņĀäļÉśļŹś ņżæ, ņ╣©ņāüņŚÉņä£ ļīĆļ│ĆņØä ļ│┤Ļ│Ā ļé£ ņ¦üĒøä ĻĖēņ×æņŖżļ¤░ ĒśĖĒØĪĻ│żļ×Ć ļ░Å ņØśņŗØ ņåīņŗżņØ┤ ļ░£ņāØĒĢśņśĆņ£╝ļ®░, ņĢłĻĄ¼ĒÄĖņ£ä(eyeball deviation) ņåīĻ▓¼Ļ│╝ Ļ▓ĮļÅÖļ¦ź ļ░Å ņä£Ēś£ļČĆ ļ¦źļ░ĢņØ┤ ņ┤ēņ¦ĆļÉśņ¦Ć ņĢŖņĢä ņ”ēņŗ£ ĻĖ░ļÅäņéĮĻ┤Ć ļ░Å ņŗ¼ĒÅÉņåīņāØņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ņĢĮ 2ļČäĻ░äņØś ņŗ¼ĒÅÉņåīņāØņłĀ Ēøä ĒÖśņ×ÉļŖö ņØśņŗØņØä ĒÜīļ│ĄĒĢśĻ│Ā ņāØņ▓┤ ņ¦ĢĒøäĻ░Ć ņĢłņĀĢļÉśņŚłņ£╝ļ®░, ņ¦üĒøä ņŗ£Ē¢ēĒĢ£ ņŗ¼ņ┤łņØīĒīī Ļ▓Ćņé¼ņŚÉņä£ ĒÖĢņןļÉ£ ņŗØļÅäĻ░Ć ņóīņŗ¼ļ░®ņØä ņÖĖņĖĪņŚÉņä£ ņĢĢļ░ĢĒĢśļŖö ņāüĒā£ņśĆĻ│Ā ņØ┤ļĪ£ ņØĖĒĢ£ ņóīņŗ¼ļ░® ĒŚłĒāł ņåīĻ▓¼ņØ┤ Ļ┤Ćņ░░ļÉśņŚłļŗż(Fig. 4). ļćīĒīī Ļ▓Ćņé¼ ļ░Å ļæÉļČĆ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśü ļō▒ņØĆ ņĀĢņāüņØ┤ņŚłĻ│Ā, ņŗØļÅäņØ┤ņÖäļČłļŖźņ”ØņŚÉ ņØśĒĢ£ ņóīņŗ¼ļ░® ņĢĢļ░Ģņ£╝ļĪ£ ĒīÉļŗ©ĒĢśĻ│Ā ļ©╝ņĀĆ ļ╣äņ£äĻ┤ĆņØä ĒĢśļČĆ ņŗØļÅäņŚÉ ņéĮņ×ģĒĢśņŚ¼ Ļ░ÉņĢĢņØä ņŗ£Ē¢ēĒĢ£ Ēøä ļŗżņØī ļéĀ ĒÆŹņäĀĒÖĢņןņłĀņØä ņŗ£Ē¢ēĒĢśņśĆļŗż. ĒĢśļČĆņŗØļÅäĻ┤äņĢĮĻĘ╝ ļČĆņ£äņŚÉ 3.0 cm ņ¦üĻ▓ĮņØś Rigiflex┬« ĒÆŹņäĀ ņŗ£ņŖżĒģ£(Boston Scientific, Marlborough, MA, USA)ņØä ņØ┤ņÜ®ĒĢśņŚ¼ 12 psiņØś ņĢĢļĀźņ£╝ļĪ£ 90ņ┤ł Ļ░ä 2ĒÜī ĒÆŹņäĀĒÖĢņןņłĀņØä ņŗ£Ē¢ēĒĢśņśĆĻ│Ā, ņŗ£ņłĀ ļŗżņØī ļéĀ ņŗ£Ē¢ēĒĢ£ ņŗØļÅä ņĪ░ņśüņłĀņŚÉņä£ ņĪ░ņśüņĀ£Ļ░Ć ņל ĒåĄĻ│╝ļÉśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆņ£╝ļ®░ ņŗ£ņłĀ ņØ╝ņŻ╝ņØ╝ Ēøä ņŗ£Ē¢ēĒĢ£ ņŗ¼ņ┤łņØīĒīī Ļ▓Ćņé¼ņŚÉņä£ ņóīņŗ¼ļ░®ņØä ņĢĢļ░ĢĒĢśļŹś ņóģĻ┤┤ļŖö Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż(Fig. 5). ņŗ£ņłĀ Ēøä ņ”ØņāüņØĆ ĒśĖņĀäļÉśņ¢┤ ņĀĢņāü ņŗØņØ┤ Ēøä Ēć┤ņøÉĒĢśņśĆņ£╝ļ®░, 3Ļ░£ņøö Ēøä ņČöņĀü ņŗ¼ņ┤łņØīĒīī Ļ▓Ćņé¼ļŖö ņĀĢņāüņØ┤ņŚłĻ│Ā Eckardt ņ”Øņāü ņĀÉņłś 1ņĀÉ(ņé╝Ēé┤Ļ│żļ×Ć 0, ņŚŁļźś 1, ĒØēĒåĄ 0, ņ▓┤ņżæ Ļ░Éņåī 0), Ļ│ĀĒśĢņŗØņØä ņØ┤ņÜ®ĒĢ£ ļÅÖņ£äņøÉņåī ņŗØļÅäĒåĄĻ│╝ Ļ▓Ćņé¼ņŚÉņä£ Ļ▓Ćņé¼ 10ļČäņŚÉ 5.4%, 20ļČäņŚÉ 5.1%ņØś ņ×öļźśņ£©ļĪ£ ņØ┤Ēøä 5ļģäĻ░ä ņ”Øņāü ņŚåļŖö ņāüĒā£ļĪ£ ņÖĖļל ņČöņĀü ņżæņØ┤ļŗż.
ņŗØļÅäņØ┤ņÖäļČłļŖźņ”ØņØĆ ņøÉņØĖņØä ņĢī ņłś ņŚåļŖö ĒŖ╣ļ░£ņä▒ņØĖ Ļ▓ĮņÜ░Ļ░Ć ļīĆļČĆļČäņ£╝ļĪ£ ņŗØļÅäņØś ņŚ░ļÅÖņÜ┤ļÅÖĻ│╝ ĒĢśļČĆņŗØļÅäĻ┤äņĢĮĻĘ╝ņØś ņØ┤ņÖäņØä ņĪ░ņĀłĒĢśļŖö ĻĘ╝ņ£ĪņŗĀĻ▓ĮņĀł(myenteric plexus)ņØś ņØ┤ņāüņŚÉ ņØśĒĢ┤ ļ░£ņāØĒĢ£ļŗż[2]. ņ£ĀņĀä ļ░Å ļ®┤ņŚŁĒĢÖņĀü ņåīņØĖņØä Ļ░Ćņ¦ä ņé¼ļ×īņŚÉņä£ ļŗ©ņł£Ēżņ¦äļ░öņØ┤ļ¤¼ņŖż ļō▒ņŚÉ Ļ░ÉņŚ╝ļÉśļ®┤ ņØ┤ņāü ļ®┤ņŚŁļ░śņØæņØ┤ ņ£Āļ░£ļÉśņ¢┤ ĻĘ╝ņ£ĪņŗĀĻ▓ĮņĀłņØś ņŚ╝ņ”ØņØä ņØ╝ņ£╝ĒéżļŖöļŹ░, ņäĖĒżļÅģņä▒ ļ®┤ņŚŁļ░śņØæņØ┤ ņ¦ĆņåŹļÉśļ®┤ ņĀÉņ░©ņĀüņ£╝ļĪ£ ņŗĀĻ▓ĮņäĖĒżļōżņØ┤ Ļ░ÉņåīĒĢśņŚ¼ Ļ▓░ĻĄŁ ņåīņŗżļÉśĻ▒░ļéś ņŗĀĻ▓Į ĻĖ░ļŖźņØś ņןņĢĀļź╝ ņØ╝ņ£╝ĒéżļŖö Ļ▓āņ£╝ļĪ£ ņČöņĀĢĒĢ£ļŗż. ĒÖśņ×ÉņØś ņ×äņāüĻ▓ĮĻ│╝Ļ░Ć ļŗżņ¢æĒĢ£ Ļ▓āņØĆ ļ®┤ņŚŁļ░śņØæņØś ņóģļźśņÖĆ ņäĖĒżļÅģņä▒ ļ®┤ņŚŁļ░śņØæņØś ņĀĢļÅäņŚÉ ļö░ļØ╝ ņ¦äĒ¢ēņåŹļÅäņÖĆ Ēæ£ĒśäĒśĢņØ┤ ļŗżļź┤ĻĖ░ ļĢīļ¼ĖņØ┤ļŗż[8].
ņŗØļÅäņØ┤ņÖäļČłļŖźņ”ØņØĆ ņ¦äĒ¢ēņØ┤ ņĀÉņ¦äņĀüņ£╝ļĪ£ ņØ┤ļŻ©ņ¢┤ņ¦Ćļ»ĆļĪ£ ņ¦äļŗ© ņŗ£Ļ╣īņ¦Ć ņłśļģäĻ░ä ņ”ØņāüņØä Ļ▓ĮĒŚśĒĢ£ļŗż[9]. Adams ļō▒[10]ņØĆ ņ”ØņāüņØä 3ļŗ©Ļ│äļĪ£ ļČäļźśĒĢśņśĆļŖöļŹ░, 1ļŗ©Ļ│äļŖö ņé╝Ēé┤Ļ│żļ×Ć, ĒØēĒåĄ ļ░Å ņŚŁļźś ņ”ØņāüņØ┤ ņ׳ņ¦Ćļ¦ī ņĀĢņāü ņŗØļÅä ņ¦üĻ▓ĮņØä ļ│┤ņØ┤ļŖö Ļ▓ĮņÜ░, 2ļŗ©Ļ│äļŖö ņŗØļÅä ņ¦üĻ▓ĮņØ┤ ņ”ØĻ░ĆļÉśļ®┤ņä£ ņé╝Ēé┤Ļ│żļ×Ć ļ░Å ĒØēĒåĄņØ┤ ņØ╝ņŗ£ņĀüņ£╝ļĪ£ Ļ░ÉņåīļÉśļŖö Ļ▓ĮņÜ░, 3ļŗ©Ļ│äļŖö ņŗØļÅäĻ░Ć ļ¦żņÜ░ ņŗ¼ĒĢśĻ▓ī ĒÖĢņןļÉśņ¢┤ ņ”ØņāüņØ┤ ņ¦ĆņåŹņĀüņ£╝ļĪ£ ņĢģĒÖöļÉśĻ│Ā ņ▓┤ņżæĻ░ÉņåīĻ░Ć ļ│┤ņØ┤ļŖö Ļ▓ĮņÜ░ņØ┤ļŗż. ņŗØļÅäĻ░Ć ĒśäņĀĆĒ׳ ĒÖĢņןļÉśņ¢┤ ņ׳ļŖö ļ¦ÉĻĖ░ ņŗØļÅäņØ┤ņÖäļČłļŖźņ”Ø ļŗ©Ļ│äņØś ĒÖśņ×ÉļōżņØĆ ļīĆĻ░£ ĒśĖĒØĪĻĖ░ ņ”ØņāüņØä ņ×ÉņŻ╝ ĒśĖņåīĒĢśļŖöļŹ░, ņĀĆļźśļÉ£ ņØīņŗØ ļ░Å ļČäļ╣äļ¼╝ļĪ£ ņØĖĒĢ£ ņĢ╝Ļ░ä ĻĖ░ņ╣©Ļ│╝ Ļ▓ĮļÅäņØś ĒśĖĒØĪĻ│żļ×Ć, ĒØĪņØĖņä▒ ĒÅÉļĀ┤ ļ░Å ĒÅÉļåŹņ¢æ, ļō£ļ¼╝Ļ▓ī ĒÖĢņןļÉ£ ņŗØļÅäņŚÉ ņØśĒĢ┤ ĻĖ░Ļ┤ĆņØ┤ ņĢĢļ░ĢļÉ£ Ļ▓ĮņÜ░ ĻĖēņä▒ ĒśĖĒØĪļČĆņĀäņØ┤ ļ░£ņāØĒĢĀ ņłś ņ׳ļŗż[11]. ļ¦ÉĻĖ░ ņŗØļÅäņØ┤ņÖäļČłļŖźņ”Øņ£╝ļĪ£ ņØĖĒĢ£ Ļ▒░ļīĆ ņŗØļÅäņŚÉņä£ ņŗ¼ņĀĢņ¦Ć ļ░Å ĻĖēņé¼ņÖĆ Ļ┤ĆļĀ©ļÉ£ ĻĖ░ņĀäņ£╝ļĪ£ļŖö ņØīņŗØļ¼╝ ĒØĪņØĖ, ĻĖ░Ļ┤Ć ļ░Å ņŗ¼ņן ņĢĢļ░Ģ, ņØīņŗØņØś ņŗØļÅäĒåĄĻ│╝ļź╝ ņ£äĒĢ£ ļ░£ņé┤ļ░ö ņĪ░ņ×æņŗ£ ņ£Āļ░£ļÉ£ ļČĆņĀĢļ¦ź, ņŗØļÅäĻČżņ¢æ ņČ£Ēśł, ņŗØļÅäņ▓£Ļ│Ą ļō▒ņØ┤ Ļ░ĆļŖźĒĢśļŗż[12]. ļ│Ė ņ”ØļĪĆņŚÉņä£ļŖö ĒÖĢņןļÉ£ ņŗØļÅäņŚÉ ņØśĒĢ┤ ņóīņŗ¼ļ░®ņØ┤ ņĢĢļ░ĢļÉśņ¢┤ ĻĖēņä▒ ņŗ¼ņĀĢņ¦ĆĻ░Ć ļ░£ņāØĒĢ£ Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉśļ®░, ņóīņŗ¼ļ░®ņØĆ ņŗ¼ņןņØś Ēøäļ░®ņŚÉ ņ£äņ╣śĒĢśņŚ¼ ņŗØļÅä ļ░Å ĒĢśĒ¢ēļīĆļÅÖļ¦źĻ│╝ ĻĘ╝ņĀæĒĢśĻ│Ā ļ▓ĮņØ┤ ļ╣äĻĄÉņĀü ņ¢ćĻ│Ā ļé┤ļČĆ ņĢĢļĀźņØ┤ ļé«ņĢä ņŻ╝ņ£ä ĻĄ¼ņĪ░ļ¼╝ņŚÉ ņØśĒĢ┤ ņĢĢļ░ĢļÉĀ ņłś ņ׳ļŗż. D'Cruz ļō▒[13]ņØĆ ņóīņŗ¼ļ░® ņ×ÉĻĄŁ(impression)ņŚÉ ļīĆĒĢ┤ ĒĢ┤ļČĆĒĢÖņĀü ļ│ĆĒśĢņØś ņŗ¼ĒĢ£ ņĀĢļÅä ļ░Å ĒśłņŚŁĒĢÖņĀü Ļ▓░Ļ│╝ļź╝ ĒåĀļīĆļĪ£ ĻĘ╝ņĀæ(proximity), ņ╣©ļ▓ö(encroachment), ņĢĢļ░Ģ(compression)ņ£╝ļĪ£ ņäĖļČäĒĢśņśĆļŖöļŹ░, Ļ░Ćņן ņŗ¼ĒĢ£ ĒśĢĒā£ņØĖ ņóīņŗ¼ļ░® ņĢĢļ░ĢņØĆ ņóīņŗ¼ļ░® ņÜ®ņĀü ļ░Å ņŗ¼ļ░ĢņČ£ļ¤ēņØä Ļ░Éņåīņŗ£ņ╝£ ĒśĖĒØĪĻ│żļ×Ć, ņÜ┤ļÅÖ ļé┤ņä▒ Ļ░Éņåī, ĒśłņŚŁĒĢÖņĀü ļČłņĢłņĀĢņØä ņØ╝ņ£╝Ēéżļ®░, ņóīņŗ¼ļ░® ņĢĢļĀź ņāüņŖ╣ņ£╝ļĪ£ ņ”ØĻ░ĆļÉ£ ĒÅÉņĀĢļ¦źņĢĢņ£╝ļĪ£ ņØĖĒĢ┤ ĒÅÉļČĆņóģņØä ņ£Āļ░£ĒĢĀ ņłś ņ׳ļŗż[6]. ļ│Ė ĒÖśņ×ÉļŖö ļ░░ļ│Ć ņŗ£ ļ░£ņé┤ļ░ö ņĪ░ņ×æņ£╝ļĪ£ ĒØēĻ░Ģ ļé┤ ņĢĢļĀźņØ┤ ņāüņŖ╣ĒĢśņŚ¼ ĒÖĢņןļÉ£ ņŗØļÅäņŚÉ ņØśĒĢ£ ņóīņŗ¼ļ░® ņĢĢļ░ĢņØ┤ ņØ╝ņŗ£ņĀüņ£╝ļĪ£ ņ”ØĻ░ĆĒĢśĻ│Ā ņĀĢļ¦źĒÖśļźśĻ░Ć Ļ░ÉņåīĒĢśļ®┤ņä£ ņŗ¼ņĀĢņ¦ĆĻ░Ć ļ░£ņāØĒĢśņśĆņØä ņłś ņ׳ņ£╝ļ®░, ļ░£ņé┤ļ░ö ņĪ░ņ×æņ£╝ļĪ£ ņ£Āļ░£ļÉ£ ļČĆņĀĢļ¦źņØ┤ ņøÉņØĖņØ╝ Ļ░ĆļŖźņä▒ļÅä ņ׳ļŗż.
ņŗØļÅäņØ┤ņÖäļČłļŖźņ”ØĻ│╝ ļÅÖļ░śļÉ£ ĻĖēņä▒ ĒśĖĒØĪļČĆņĀä ļ░Å ņŗ¼ņĀĢņ¦ĆļŖö ļ¦żņÜ░ ļō£ļ¼Ė ņŗ¼Ļ░üĒĢ£ ĒĢ®ļ│æņ”Øņ£╝ļĪ£ ņåīņłśņØś ņ”ØļĪĆĻ░Ć ļ│┤Ļ│ĀļÉśņŚłĻ│Ā Ļ░ü ņ”ØļĪĆ ļ¦łļŗż ņŗØļÅä ņØ┤ņÖäļČłļŖźņ”ØņŚÉ ļīĆĒĢ┤ ļŗżļźĖ ņ╣śļŻī ļ░®ļ▓ĢņØä ņĀüņÜ®ĒĢśņśĆļŗż[7]. BruijnsĻ│╝ Hicks [14]ļŖö 79ņäĖ ņŚ¼ņ×É ĒÖśņ×ÉĻ░Ć ņŗØĒøä ĒśĖĒØĪņĀĢņ¦ĆļĪ£ ļé┤ņøÉĒĢśņŚ¼ ĻĖ░ļÅäņéĮĻ┤Ć ļ░Å ņØĖĻ│ĄĒÖśĻĖ░ ņāüĒā£ņŚÉņä£ ņŗØļÅäņØ┤ņÖäļČłļŖźņ”Ø ņ¦äļŗ© ĒĢśņŚÉ ļ╣äņ£äĻ┤ĆņØä ĒåĄĒĢ£ ņŗØļÅä Ļ░ÉņĢĢ Ēøä ļ│┤ĒŖżļ”¼ļŖä ļÅģņåī ņŻ╝ņ×ģ ņ╣śļŻīļź╝ ĒĢśņŚ¼ ņ╣śļŻīĒĢ£ ņ”ØļĪĆļź╝ ļ│┤Ļ│ĀĒĢśņśĆņ£╝ļéś ņØ┤Ēøä ĒÖśņ×ÉņØś ņČöņĀü Ļ▓Ćņé¼Ļ░Ć ņØ┤ļŻ©ņ¢┤ņ¦Ćņ¦Ć ņĢŖņĢä ņןĻĖ░ ņśłĒøäļź╝ ņĢī ņłś ņŚåņŚłļŗż. Altintoprak ļō▒[15]ņØĆ 18ļģä ņĀäļČĆĒä░ ņé╝Ēé┤Ļ│żļ×ĆņØ┤ ņ׳ļŹś 35ņäĖ ņŚ¼ņ×É ĒÖśņ×ÉĻ░Ć ņŗØĒøä ņŗ¼ņĀĢņ¦ĆļĪ£ ļé┤ņøÉĒĢśņŚ¼ ņŗ¼ĒÅÉņåīņāØņłĀņØä ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░ ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ ĒÖĢņןļÉ£ ņŗØļÅäļĪ£ ņØĖĒĢ£ ņŗ¼ņן ļ░Å ĻĖ░Ļ┤Ć ņĢĢļ░Ģ ņåīĻ▓¼ņØ┤ Ļ┤Ćņ░░ļÉśņ¢┤ ļ╣äņ£äĻ┤ĆņØä ĒåĄĒĢ£ ņŗØļÅä Ļ░ÉņĢĢ Ēøä ļ│ĄĻ░ĢĻ▓Į ĒŚ¼ļ¤¼ ĻĘ╝ņĀłņĀ£ņłĀļĪ£ ņ╣śļŻīĒĢ£ Ēøä 18Ļ░£ņøöĻ╣īņ¦Ć ņČöņĀü Ļ┤Ćņ░░ĒĢ£ ņ”ØļĪĆļź╝ ļ│┤Ļ│ĀĒĢśņśĆļŗż. ĻĘĖļ¤¼ļéś ļ│Ė ņ”ØļĪĆņØś ĒÖśņ×ÉņŚÉņä£ļŖö Ļ│ĀļĀ╣ ļ░Å ĻĖēņä▒ ĒÅÉļĀ┤ ļō▒ņØś ņĀäņŗĀņāüĒā£Ļ░Ć ņóŗņ¦Ć ļ¬╗ĒĢśņŚ¼ ņłśņłĀņĀü ņ╣śļŻīļź╝ ņäĀĒāØĒĢśĻĖ░ ņ¢┤ļĀżņøĀļŗż. Hifumi ļō▒[5]ņØĆ 13ļģä ņĀäļČĆĒä░ ņé╝Ēé┤Ļ│żļ×ĆņØ┤ ņ׳ļŹś 53ņäĖ ņŚ¼ņ×É ĒÖśņ×ÉņŚÉņä£ ņØ┤ņåĪ ņżæ ļæÉ ņ░©ļĪĆņØś ņŗ¼ĒÅÉņĀĢņ¦ĆļĪ£ ĒØēļČĆņĢĢļ░Ģ Ēøä ĻĖ░ļÅäņéĮĻ┤Ć ļ░Å ņĀĆņ▓┤ņś© ņ╣śļŻīļź╝ ļ│æĒ¢ēĒĢśļ®┤ņä£ ņŗØļÅäļé┤ņĢĢ Ļ▓Ćņé¼ ļ░Å ņĀäņé░ĒÖöļŗ©ņĖĄņ┤¼ņśüņŚÉņä£ Ļ▒░ļīĆ ņŗØļÅäļĪ£ ņØĖĒĢ£ ĻĖ░Ļ┤Ć ņĢĢļ░Ģ ņåīĻ▓¼ņØ┤ Ļ┤Ćņ░░ļÉśņ¢┤ ļ╣äņ£äĻ┤ĆņØä ĒåĄĒĢ£ ņŗØļÅä Ļ░ÉņĢĢ Ēøä ĒÆŹņäĀĒÖĢņןņłĀļĪ£ ņ╣śļŻīĒĢ£ ņ”ØļĪĆļź╝ ļ│┤Ļ│ĀĒĢśņśĆņ£╝ļéś ņ╣śļŻī Ēøä ĒĢ£ļŗ¼ ņØ┤Ēøä ņČöņĀü Ļ▓░Ļ│╝Ļ░Ć ņŚåņ¢┤ ņןĻĖ░ņśłĒøäļź╝ ņĢī ņłś ņŚåņŚłļŗż. ĒŖ╣Ē׳, Mabvuure ļō▒[7]ņØĆ Ļ▓░ņĀłņä▒ Ļ▓ĮĒÖöņ”Ø ļ░Å Ļ░äņ¦ł ļ│æļĀźņØ┤ ņ׳ļŖö 40ņäĖ ļé©ņ×ÉĻ░Ć ņŗØĒøä ĻĖ░Ļ┤Ć Ēśæņ░®ņØīņ£╝ļĪ£ ļé┤ņøÉĒĢśņŚ¼ ņŗØļÅäņØ┤ņÖäļČłļŖźņ”Øņ£╝ļĪ£ ņØĖĒĢ┤ ĒÖĢņןļÉ£ ņŗØļÅäĻ░Ć ĻĖ░Ļ┤ĆņØä ņĢĢļ░ĢĒĢśņŚ¼ ĒÆŹņäĀĒÖĢņןņłĀļĪ£ ņ╣śļŻīĒĢśņśĆņ£╝ļéś ņŗØļÅä ĒÖĢņןņØ┤ ņ×¼ļ░£ ļ░Å ņ¦äĒ¢ēļÉśņ¢┤ 2Ļ░£ņøö Ēøä ļŗżņŗ£ ņŗ¼ĒÅÉņĀĢņ¦ĆĻ░Ć ļ░£ņāØĒĢśņŚ¼ ņŗØļÅäņĀłņĀ£ņłĀļĪ£ ņ╣śļŻīĒĢ£ ņ”ØļĪĆļź╝ ļ│┤Ļ│ĀĒĢśņśĆļŗż.
ļ│Ė ņ”ØļĪĆņŚÉņä£ļŖö ĒÅÉļĀ┤ ļ░Å ĒÖśņ×ÉņØś ņĀäņŗĀņāüĒā£Ļ░Ć ņĀäņŗĀļ¦łņĘ©ņÖĆ ņłśņłĀņØ┤ ņ¢┤ļĀżņÜ┤ ņāüĒā£ņŚÉņä£ ņŗ¼ņĀĢņ¦ĆņØś ņżæņ”Ø ĒĢ®ļ│æņ”ØņØä ļÅÖļ░śĒĢ£ Ļ▓ĮņÜ░ļĪ£, ņČöĒøä ņ×¼ļ░£ņØ┤ ņŚåņ£╝ļ®┤ņä£ Ļ░ĆļŖźĒĢ£ ņĄ£ņåī ņ╣©ņŖĄņØś ņ╣śļŻīļ▓ĢņØä Ļ│ĀļĀżĒĢ┤ņĢ╝ Ē¢łļŗż. ņŗØļÅäņØ┤ņÖäļČłļŖźņ”ØņØ┤ ņ¦äĒ¢ēļÉśļ®┤ ņŗØļÅäĻ░Ć Ēü¼Ļ▓ī ĒīĮņ░ĮĒĢśĻ▓ī ļÉśļ®┤ņä£ ņČĢĒÄĖņ£ä ļ░Å ļ╣äĒŗĆļ”╝ņ£╝ļĪ£ Sņ×ÉĒśĢ ņŗØļÅäļĪ£ ļ│ĆĒśĢļÉśļ®░[16], ņØ┤ Ļ▓ĮņÜ░ ņŗØļÅäņĀłņĀ£ņłĀņØ┤ ĻĘ╝ļ│ĖņĀüņØĖ ņ╣śļŻīļĪ£ Ļ│ĀļĀżļÉśņ¦Ćļ¦ī ĒĢ®ļ│æņ”ØĻ│╝ ņłśņłĀ Ļ┤ĆļĀ© ņé¼ļ¦ØļźĀņØ┤ ļåÆļŗż. Inoue ļō▒[17]ņØĆ Ļ│ĀļĀ╣, ņØ┤ņĀä ņ╣śļŻī Ļ│╝Ļ▒░ļĀź, 6 cm ņØ┤ņāüņØś ņŗØļÅä ĒÖĢņן, Sņ×ÉĒśĢ ņŗØļÅäļź╝ ĒżĒĢ©ĒĢ£ 500ļ¬ģņØś ņŗØļÅä ņØ┤ņÖäļČłļŖźņ”Ø ĒÖśņ×ÉņŚÉĻ▓ī Ļ▓ĮĻĄ¼ ļé┤ņŗ£Ļ▓ĮņĀü ĻĘ╝ņĀłĻ░£ņłĀņØä ņĀüņÜ®ĒĢśņŚ¼ ņ╣śļŻī ĒÜ©Ļ│╝Ļ░Ć ņóŗĻ│Ā ņŗ£ņłĀ Ļ┤ĆļĀ© ĒĢ®ļ│æņ”ØņØĆ 3.2%ļĪ£ ņĢłņĀäĒĢśļŗżĻ│Ā ļ│┤Ļ│ĀĒĢśņśĆņ£╝ļéś ņĀäņŗĀņāüĒā£Ļ░Ć ņóŗņ¦Ć ņĢŖņĢä ņĀäņŗĀļ¦łņĘ©ļź╝ ĒĢĀ ņłś ņŚåļŖö ĒÖśņ×ÉļŖö ņĀ£ņÖĖĒĢśņśĆļŗż. Sņ×ÉĒśĢ ņŗØļÅäņŚÉņä£ ļ│ĄĻ░ĢĻ▓Į ĒŚ¼ļ¤¼ ĻĘ╝ņĀłņĀ£ņłĀ ļ░Å Ļ▓ĮĻĄ¼ ļé┤ņŗ£Ļ▓Į ņŗØļÅä ĻĘ╝ņĀłĻ░£ņłĀ ņ╣śļŻī ņŗ£ ņóŗņØĆ Ļ▓░Ļ│╝ļź╝ ļ│┤ņŚ¼ņŻ╝ļŖö ņŚ░ĻĄ¼ļōżņØ┤ ņ׳ņ¦Ćļ¦ī ņןĻĖ░ņĀüņØĖ ĒÜ©Ļ│╝ņŚÉ ļīĆĒĢ┤ņä£ļŖö ņČöĻ░Ć ņŚ░ĻĄ¼Ļ░Ć ĒĢäņÜöĒĢśļŗż[18]. Khan ļō▒[19]ņØĆ 9ļ¬ģņØś Ļ▒░ļīĆ ņŗØļÅä(7 cm ņØ┤ņāüņØś ņ¦üĻ▓Į) ĒÖśņ×ÉņŚÉņä£ ĒÆŹņäĀĒÖĢņןņłĀņØä ņŗ£Ē¢ēĒĢśņŚ¼ ĒĢ®ļ│æņ”ØņØ┤ ņŚåņØ┤ ņČ®ļČäĒĢśĻ▓ī ĒÖĢņןĒĢśņśĆĻ│Ā 12Ļ░£ņøö ņČöņĀü Ļ┤Ćņ░░ņŚÉņä£ ņ¦ĆņåŹņĀüņØĖ ņ”Øņāü ĒśĖņĀäņØä ļ│┤Ļ│ĀĒĢ£ ļ░ö ņ׳ļŗż. ļö░ļØ╝ņä£, ļ│Ė ņ”ØļĪĆņØś ĒÖśņ×ÉņŚÉņä£ļŖö ĒÆŹņäĀĒÖĢņןņłĀņØä ņĄ£ņåī ņ╣©ņŖĄņØś ņ╣śļŻīļ▓Ģņ£╝ļĪ£ ĒīÉļŗ©ĒĢśņŚ¼ ņŗ£Ē¢ēĒĢśņśĆņ£╝ļ®░, ņØ┤ņĀä ļ│┤Ļ│ĀņŚÉņä£ ņןĻĖ░ ņČöņĀü Ļ▓░Ļ│╝Ļ░Ć ņŚåņ¢┤ ļ│Ė ĒÖśņ×Éļź╝ 5ļģäĻ░ä ņČöņĀü Ļ┤Ćņ░░ĒĢśņśĆņ£╝ļéś ņ”ØņäĖ ļ░Å ļé┤ņŗ£Ļ▓Į, ļÅÖņ£äņøÉņåī ņŗØļÅäĒåĄĻ│╝ Ļ▓Ćņé¼, ņŗØļÅä ņĪ░ņśüņłĀ, ņŗ¼ņן ņ┤łņØīĒīī Ļ▓Ćņé¼ ļō▒ņŚÉņä£ ĒśĖņĀäļÉ£ ņāüĒā£ļĪ£ ņ£Āņ¦ĆļÉśĻ│Ā ņ׳ņ¢┤ ņłśņłĀņØ┤ ņ¢┤ļĀżņÜ┤ ĒÖśņ×ÉņŚÉņä£ ņןĻĖ░Ļ░ä ņĢłņĀäĒĢ£ ņ╣śļŻīļĪ£ Ļ│ĀļĀżĒĢ┤ ļ│╝ ņłś ņ׳ļŗż. ņĄ£ĻĘ╝ Ļ│ĀĒĢ┤ņāüļÅä ņŗØļÅäļé┤ņĢĢ Ļ▓Ćņé¼ļź╝ ĒåĄĒĢ┤ ņŗØļÅäņØ┤ņÖäļČłļŖźņ”ØņØś ņĢäĒśĢ ļČäļźśĻ░Ć Ļ░ĆļŖźĒĢ┤ņĪīĻ│Ā, IIĒśĢņØĆ ĒÆŹņäĀĒÖĢņןņłĀĻ│╝ ļ│ĄĻ░ĢĻ▓Į ĒŚ¼ļ¤¼ ĻĘ╝ņĀłņĀ£ņłĀņØś ņ╣śļŻī ĒÜ©Ļ│╝Ļ░Ć ļŹö ļåÆĻ│Ā IIIĒśĢņØĆ I, IIĒśĢņŚÉ ļ╣äĒĢśņŚ¼ ņśłĒøäĻ░Ć ļéśņüśļŗż[20]. Ļ│ĀĒĢ┤ņāüļÅä ņŗØļÅäļé┤ņĢĢ Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśņ¦ĆļŖö ļ¬╗ĒĢśņśĆņ£╝ļéś ļ│Ė ĒÖśņ×ÉļŖö ņ▓┤ļČĆņØś ļÅÖņŗ£ ņłśņČĢĒīīĻ░Ć Ļ┤Ćņ░░ļÉśļŖö IIĒśĢņ£╝ļĪ£ ĒÆŹņäĀĒÖĢņןņłĀņŚÉ ņóŗņØĆ ņןĻĖ░ ņ╣śļŻī ĒÜ©Ļ│╝ļź╝ ļ│┤ņØĖ Ļ▓āņ£╝ļĪ£ ņČöņĀĢĒĢĀ ņłś ņ׳ņ£╝ļ®░, IIIĒśĢņØś Ļ▓ĮņÜ░ļØ╝ļ®┤ ĻĘ╝ņĀłĻ░£ņłĀņØä ņŗĀņżæĒ׳ Ļ│ĀļĀżĒĢ┤ņĢ╝ ĒĢ£ļŗż.
ļ¦ÉĻĖ░ ņŗØļÅäņØ┤ņÖäļČłļŖźņ”ØņØś ņ╣śļŻīļŖö ņ¢┤ļĀżņÜ░ļ®░ ņŗ¼ĒÅÉņĀĢņ¦ĆņÖĆ Ļ░ÖņØĆ ņżæņ”Ø ĒĢ®ļ│æņ”ØņØä ļÅÖļ░śĒĢ£ Ļ▒░ļīĆ ņŗØļÅäņØś Ļ▓ĮņÜ░ Sņ×ÉĒśĢ ņŗØļÅä ņ£Āļ¼┤, ņŗØļÅäļé┤ņĢĢ Ļ▓Ćņé¼ņŚÉ ņØśĒĢ£ ņĢäĒśĢ, ņØ┤ņĀä ņ╣śļŻī Ļ│╝Ļ▒░ļĀź, ĒÖśņ×É ņāüĒā£, ņŗ£ņłĀņØśņØś ņłÖļĀ©ļÅä, ņØśļŻīĻĖ░Ļ┤ĆņØś ņŗ£ņäż, ņÖĖĻ│╝ņĀü ņĀäļ¼Ėņä▒ņØä ĒżĒĢ©ĒĢ£ ļ¦ÄņØĆ ņÜöņåīļź╝ Ļ│ĀļĀżĒĢśņŚ¼ ņ╣śļŻīļ░®ļ▓ĢņØä Ļ▓░ņĀĢĒĢśņŚ¼ņĢ╝ ĒĢ£ļŗż. ļ│Ė ņ”ØļĪĆņŚÉņä£ ņŗØļÅäņØ┤ņÖä ļČłļŖźņ”Øņ£╝ļĪ£ ņØĖĒĢ£ Ļ▒░ļīĆ ņŗØļÅäņØś ņóīņŗ¼ļ░® ņĢĢļ░Ģņ£╝ļĪ£ ļ░£ņāØĒĢ£ ĻĖēņä▒ ņŗ¼ņĀĢņ¦Ć ĒÖśņ×ÉņŚÉņä£ ĒÆŹņäĀĒÖĢņןņłĀļĪ£ ņä▒Ļ│ĄņĀüņ£╝ļĪ£ ņ╣śļŻīĒĢśĻ│Ā ņןĻĖ░Ļ░ä ņČöņĀü Ļ┤Ćņ░░ņŚÉņä£ ņóŗņØĆ ņśłĒøäļź╝ ļ│┤ņśĆĻĖ░ņŚÉ ļ│┤Ļ│ĀĒĢśļŖö ļ░öņØ┤ļŗż.
Fig.┬Ā1.
(A) Chest contrast CT shows diffuse wall thickening and marked distension with fluid retention in the esophagus. (B) Transverse CT image shows the presence of a dilated esophagus abutting the left atrium.
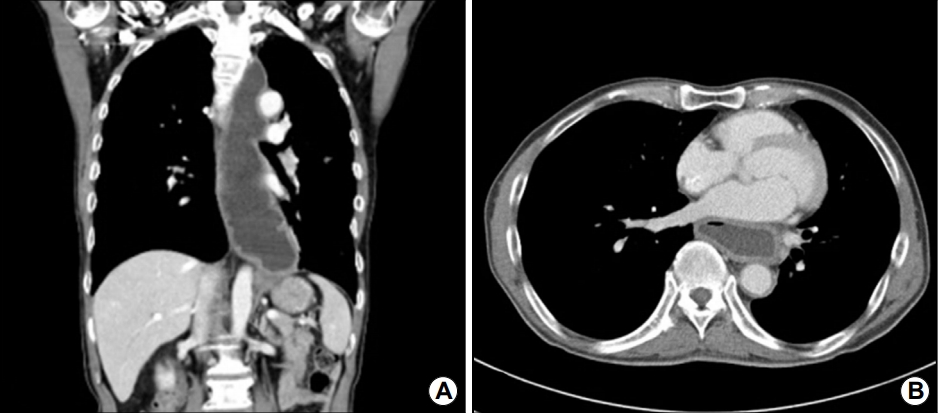
Fig.┬Ā2.
(A) Upper endoscopy reveals abnormal esophageal dilatation and food material with a contracted gastroesophageal junction. (B) Barium esophagram shows the dilated esophagus (maximal transverse diameter: 54 mm) and bird beak appearance. (C) Esophageal manometry shows a low amplitude simultaneous contraction. (D) Radionuclide esophageal transit study shows an adynamic esophageal transit pattern with 57% retention after 20 minutes.
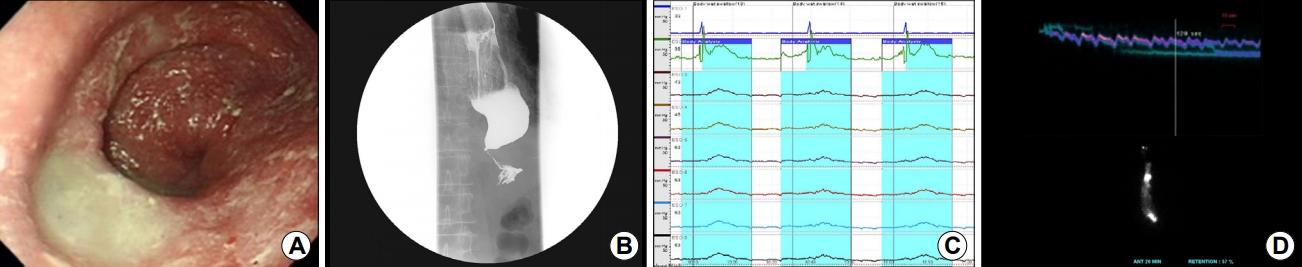
Fig.┬Ā3.
High resolution chest CT scan shows multifocal peribronchial distributed ill-defined small nodules and ground glass opacities in the left upper lobe, right middle lobe, and both lower lobes.

Fig.┬Ā4.
Transthoracic echocardiography shows a collapse of the left atrium by extrinsic compression due to an extracardiac mass lesion with heterogenous densities. The esophagus (*) is identified by echocardiographic appearance as a retrocardiac mass with air and a fluid level.
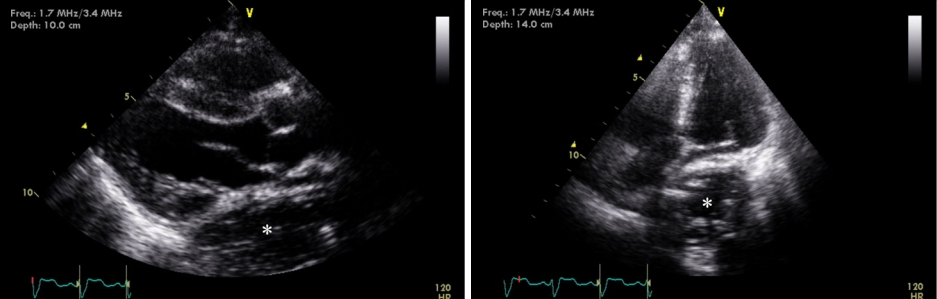
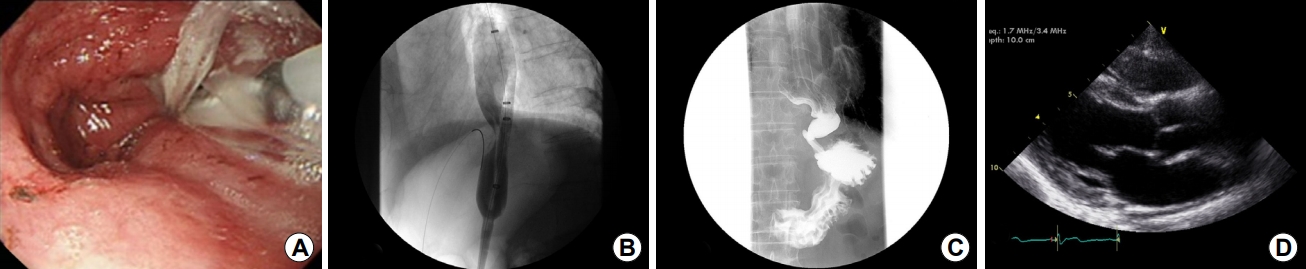
Fig.┬Ā5.
(A, B) After passage of a guidewire, a balloon is placed and inflated to dilate the narrowing of the esophagogastric junction (30 mm diameter) for 90 seconds. (C) After pneumatic dilatation, the contrast media shows good passage. (D) Transthoracic echocardiography shows a disappearance of the left atrial compression caused by the dilated esophagus.
REFERENCES
3. Eckardt VF, Hoischen T, Bernhard G. Life expectancy, complications, and causes of death in patients with achalasia: results of a 33-year follow-up investigation. Eur J Gastroenterol Hepatol 2008;20:956ŌĆō960.


4. Makharia GK, Seith A, Sharma SK, et al. Structural and functional abnormalities in lungs in patients with achalasia. Neurogastroenterol Motil 2009;21:603ŌĆōe20.


5. Hifumi T, Okada I, Inoue J, Koido Y. Cardiopulmonary arrest owing to oesophageal achalasia recovered completely with cardiopulmonary resuscitation followed by therapeutic hypothermia. BMJ Case Rep 2013;2013:bcr2012008378.



6. van Rooijen JM, van den Merkhof LF. Left atrial impression: a sign of extra-cardiac pathology. Eur J Echocardiogr 2008;9:661ŌĆō664.



7. Mabvuure NT, Hey SY, Forshaw M. Recurrent respiratory distress and cardiopulmonary arrest caused by megaoesophagus secondary to achalasia. Int J Surg Case Rep 2014;5:628ŌĆō632.



8. Kahrilas PJ, Boeckxstaens G. The spectrum of achalasia: lessons from studies of pathophysiology and high-resolution manometry. Gastroenterology 2013;145:954ŌĆō965.


9. Jeon HH, Kim JH, Youn YH, Park H, Conklin JL. Clinical characteristics of patients with untreated achalasia. J Neurogastroenterol Motil 2017;23:378ŌĆō384.




10. Adams CW, Brain RH, Ellis FG, Kauntze R, Trounce JR. Achalasia of the cardia. Guys Hosp Rep 1961;110:191ŌĆō236.

11. Eckardt VF. Clinical presentations and complications of achalasia. Gastrointest Endosc Clin N Am 2001;11:281ŌĆō292.


12. Schalinski S, Guddat SS, Tsokos M, Byard RW. Megaesophagus and possible mechanisms of sudden death. J Forensic Sci 2009;54:216ŌĆō219.


13. D'Cruz IA, Feghali N, Gross CM. Echocardiographic manifestations of mediastinal masses compressing or encroaching on the heart. Echocardiography 1994;11:523ŌĆō533.


14. Bruijns SR, Hicks A. Achalasia: an unusual cause of airway obstruction. Emerg Med J 2009;26:148.


15. Altintoprak F, Degirmenci B, Dikicier E, et al. A case of achalasia presented with cardiopulmonary arrest. Case Rep Surg 2012;2012:794858.




17. Inoue H, Sato H, Ikeda H, et al. Per-oral endoscopic myotomy: a series of 500 patients. J Am Coll Surg 2015;221:256ŌĆō264.


18. Zaninotto G, Bennett C, Boeckxstaens G, et al. The 2018 ISDE achalasia guidelines. Dis Esophagus 2018;31:1ŌĆō29.


-
METRICS

-
- 0 Crossref
- 3,018 View
- 66 Download
- Related articles in Korean J Helicobacter Up Gastrointest Res
-
A Case of Duodenal Volvulus Presenting with Recurrent Vomiting in Elderly2015 June;15(2)
A Case of Amyloidosis Presenting as Lymphadenopathy at the Porta Hepatis2018 September;18(3)






