위산분비 억제제의 역사 및 약리기전
History and Pharmacological Mechanism of Gastric Acid-suppressive Drugs
Article information
Trans Abstract
Gastric acid-related disorders are commonly encountered in clinical practice. Acetylcholine, gastrin, and histamine are physiological agonists that stimulate acid secretion from parietal cells. Histamine plays a decisive role in the transformation of parietal cells into acid-secreting forms. The H+, K+- ATPase proton pump, which represents the final step of acid secretion, translocates from cytoplasmic tubulovesicles to secretory canaliculi upon parietal cell stimulation and facilitates exchange of intracellular H+ with extracellular K+ in a 1:1 ratio. Histamine-2 receptor antagonists and proton pump inhibitors (PPIs) are widely used in clinical practice, and potassium-competitive acid blockers (P-CABs) have gained attention in recent times. P-CABs address the unmet needs of patients who receive conventional PPIs and have broadened the spectrum of drug choices; however, further research is warranted to confirm long-term safety of these drugs. Comprehensive understanding of the mechanisms of actions, characteristics, advantages and disadvantages, and the adverse effect profile is essential for appropriate prescription of gastric acid-suppressive drugs. In this review, we provide a developing history and outline the pharmacological mechanisms underlying various gastric acid-suppressive drugs used in clinical settings.
서 론
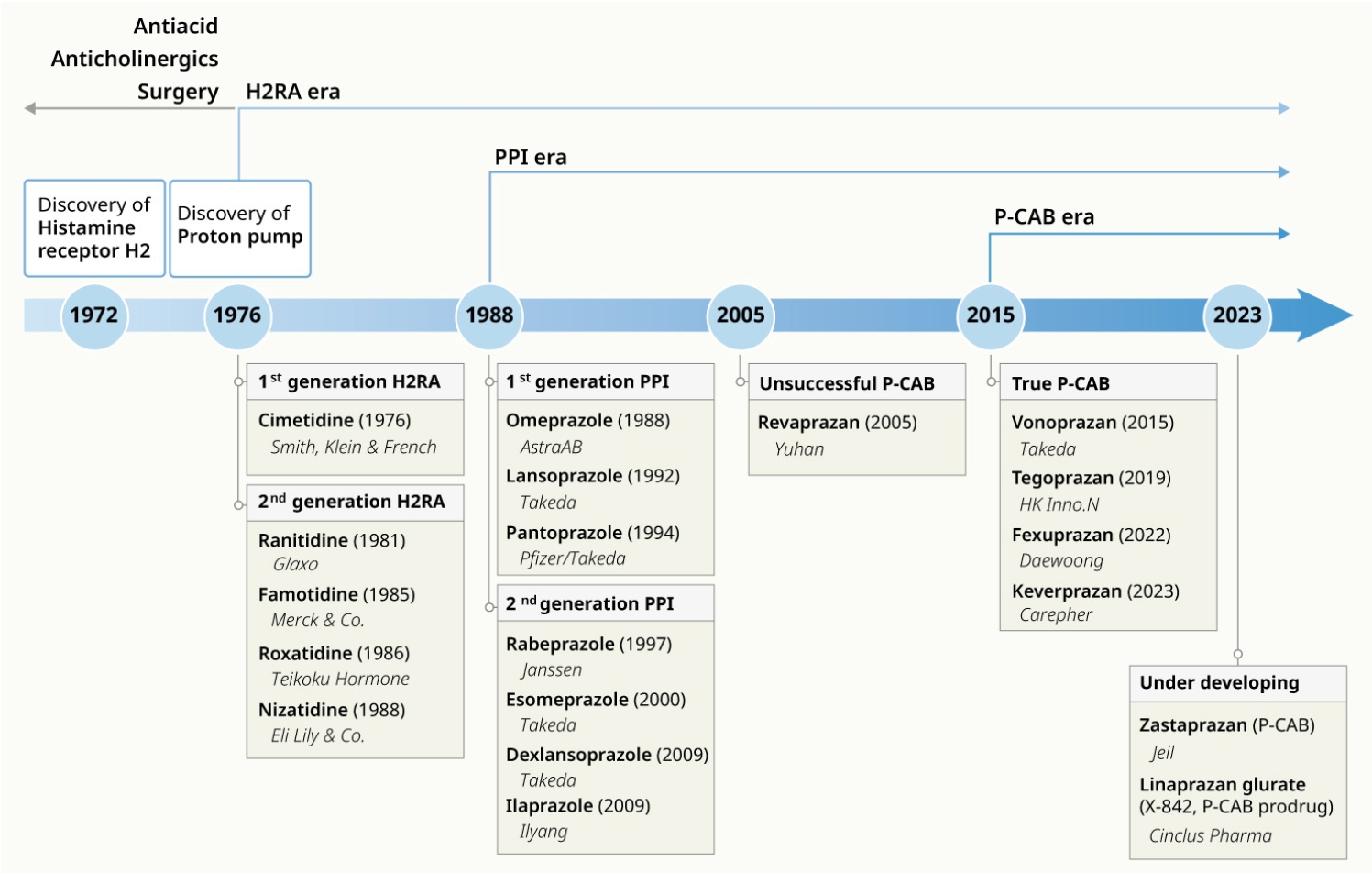
소화성 궤양, 위식도 역류질환과 같은 위산 관련 질환은 쉽게 접할 수 있는 대표적인 소화기 질환이며, 위산분비억제제는 이러한 질환에서 가장 중요하고 효과적인 치료 약제이다. 현재 임상에서는 고전적인 히스타민-2 수용체 길항제(histamine-2 receptor antagonist, H2RA)와 가장 널리 사용되어온 양성자 펌프 억제제(proton pump inhibitor, PPI), 그리고 최근 개발된 칼륨 경쟁적 위산분비 차단제(potassium-competitive acid blocker, P-CAB) 등이 사용되고 있다(Fig. 1). 본고에서는 임상에서 사용중인 다양한 위산분비 억제제의 역사 및 약리기전에 대해 정리해 보고자 한다.
본 론
1. 위산분비의 과정
위 벽세포에서 산분비를 촉진시키는 3가지 생리적 작용제(agonist)로는 (1) 미주신경의 조절을 받는 장신경계의 신경 말단에서 분비되는 아세틸콜린, (2) 전정부 G 세포에서 분비되는 가스트린, (3) 장크롬친화 유사세포에서 분비되는 히스타민이 있다[1]. 이 중 히스타민은 위산분비 과정에서 벽세포가 위산분비 형태로 변화하는 데 결정적인 역할을 한다. 히스타민은 벽세포에 위치한 히스타민-2 수용체에 결합하여 adenylate cyclase를 활성화시킴으로써 세포내 2차전령인 cyclic adenosine monophosphate (cAMP) 농도를 높이고, 이로 인해 cAMP 의존적 protein kinase A (PKA)가 활성화된다. PKA의 활성화는 양성자펌프(proton pump, H+, K+-ATPase)를 세포질내 관상소포(tubulovesicle)에서 분비소관(canaliculus)으로 이동시키는 데 관여하는 세포골격 단백질을 인산화 시키고, 인산화된 세포골격 단백질에 의해 양성자펌프가 분비소관으로 이동되어 활성화 된다[2]. 분비소관으로 이동한 활성형 양성자펌프는 위산분비의 최종단계로서 구조적 변화(conformational change)를 통해서 세포내 H+와 세포외 K+를 1:1로 교환하는 방식으로 위산을 분비한다(Fig. 2) [3]. 현재 개발되어 임상에서 사용중인 위산분비억제제는 모두 히스타민-2 수용체와 양성자펌프를 대상으로 하는 약물들이다.
2. 히스타민-2 수용체 길항제
1) 히스타민-2 수용체 길항제의 역사
과거 소화성 궤양의 치료는 병태생리의 중심에 있는 위산분비를 조절하기 위해 식이요법, 수술적 치료, 제산제 및 항콜린제 등을 사용하였으나 치료 효과가 다양하고 일부에서는 심각한 부작용을 초래하였다4]. 1972년에 위산분비에 관여하는 히스타민-2 수용체가 발견되었고 burimamide가 이 수용체를 길항하는 것을 확인되었다[5]. 그러나 burimamide는 경구섭취 시 흡수가 잘 되지 않아 치료 효과가 충분하지 않았기 때문에 화학구조를 변화시킨 metiamide가 연구되었는데 이 역시 신독성과 과립구감소증을 유발해 상용화에 실패했다. 1972년에 추가적인 화학구조 변경을 통해 cimetidine이 개발되었고, 독성평가 및 임상시험을 거쳐 1976년부터 임상에서 사용되기 시작했다[6]. 최초의 위산분비억제제인 cimetidine이 임상에 도입된 후 소화성 궤양의 치유율이 혁신적으로 향상되고 수술이 감소되면서 위산 관련 질환 치료의 새로운 시대가 시작되었다. 그러나 cimetidine은 임상적인 효과에도 불구하고 수용체 특이도가 낮아 theophylline, propranolol, warfarin과 같은 약물과의 상호작용, 발기부전, 여성형 유방, 고령에서 의식저하 및 말초혈액 림프구 증식 등의 부작용이 보고되었다[7]. 이에 더 강력하고 부작용이 적은 2세대 H2RA로서 ranitidine (1981년), famotidine (1985년), roxatidine (1986년), nizatidine (1988년)이 개발되 어 임상에서 사용되어왔다[8]. 이 중 ranitidine은 발암 추정물질인 N-니트로소디메틸아민(N-nitrosodimethylamine)이 미량 검출되면서 2019년 시장에서 퇴출되었다[9].
2) 약리기전
H2RA는 위 벽세포의 히스타민-2 수용체에 대한 히스타민의 경쟁적 억제제로서 기초 및 식사에 의한 자극성 위산분비를 억제하는 데 효과적이다[10]. 단일 투여로 4~8시간의 위산분비 억제 효과를 보이며, 자극에 의한 위산분비를 약 70%가량 감소시킨다. 저녁에 약제를 투여하면 야간 산분비를 억제하는 데 효과적이다[11]. 경구투여 시 잘 흡수되고 작용시간이 빨라 1~3시간 내에 최고혈청농도에 이르고, 음식 섭취에 영향을 받지 않는다[10]. H2RA는 혈액-뇌 장벽과 태반을 통과하며 전신에 분포된다[10]. 현재까지 개발된 H2RA들은 기본적인 약리작용은 동일하지만 흡수 및 대사 과정의 차이 때문에 나중에 개발된 약물일수록 부작용이 적고 제산능력이 강한 편이다. Cimetidine, ranitidine, famotidine은 간에서 1차 대사를 거치기 때문에 생체 이용률이 35~60%까지 감소되는 반면 nizatidine은 간 대사를 거치지 않아 생체이용률이 100%에 이른다[10]. 약물의 제거는 간대사와 신배설에 의해 이루어지고 크레아티닌 청소율이 50 mL/min 이하 시 투여용량을 감소시켜야 하지만 투석이나 간기능부전은 약동학에 영향을 미치지 않아 용량 조절은 불필요하다[10]. H2RA의 단점은 2주 이상 지속 사용 시 효과가 급속히 감소하는 내성(tachyphylaxis)의 발생이다[12,13]. 그 기전은 명확하지 않은데, 만성적인 수용체 억제로 인해 다른 위산분비 자극 작용제에 대한 벽세포 수용체의 발현 증가, 히스타민-2 수용체의 민감도 증가 및 발현 증가, 위산분비를 억제하는 신경내분비 조절기능의 장애 등이 추정되고 있다[13,14]. 그러나 내성이 발생하더라도 위산억제 효과가 완전히 사라지는 것은 아니며, 초기 효력 감소 후 더 진행하지 않는 것으로 보인다. 한 연구에 따르면 투여 1일에 비해 7일에 위내 pH가 낮아졌지만 28일에는 7일과 비슷하게 유지되었고, 위약보다는 높은 pH를 나타냈다[12]. 또 H2RA를 사용한 후 중단하면 3일까지 내성이 유지되는 것으로 보고되었는데, 이는 H2RA를 증상에 따라 간헐적으로 단기 사용하는 경우 최대 위산억제 효과를 얻을 수 있음을 시사한다[14]. Cimetidine과 ranitidine은 간 cytochrome P450 (CYP)의 효소에 결합하여 동일 효소계에 의해 대사되는 약물의 제거를 억제한다. 대조적으로 famotidine과 nizatidine은 CYP 시스템에 대한 유의한 결합력을 가지 않아 다른 약물과의 상호작용이 거의 없다[15].
3. 양성자펌프억제제
1) 양성자펌프억제제의 역사
H2RA 도입에도 불구하고 소화성 궤양의 재발과 위식도역류 질환에 대한 불충분한 치료 효과로 더 강력한 약제의 필요성이 제기되었는데, 1976년 위산분비 최종 단계인 양성자펌프 개념이 발표되면서 새로운 약제 개발의 가능성이 열렸다[16]. 1977년 스웨덴 웁살라에서 열린 위 이온 수송에 관한 심포지엄에서 Astra 제약의 Hässle 연구소는 benzimidazole 유도체인 H83/88이 H2RA와 달리 위 점막으로부터 히스타민 자극 산 분비를 비경쟁적으로 억제하고 세포내 cAMP에 의해 유도된 위산분비를 억제한다고 발표하였다[8]. 이후 timoprazole이 연구되었으나 갑상선 관련 부작용이 관찰되어 다른 후보물질인 picoprazole을 이용해 연구가 진행되었다[17]. 이 물질이 위 벽세포에서 양성자 펌프를 억제한다는 사실이 확인되어 PPI 개발의 중요한 토대가 되었고 계속적인 연구 개발을 통해 1988년 세계 최초의 PPI인 omeprazole가 출시되었다[18]. 이후 1세대 PPI인 lansoprazole (1992년), pantoprazole (1994년)이 출시되었고, 이어서 2세대 PPI인 rabeprazole (1997년), esomeprazole (2000년), dexlansoprazole (2009년)이 등장했으며, 2009년 국내에서도 PPI 중 가장 반감기가 긴 일양약품의 ilaprazole이 상용화되었다. PPI는 산에 불안정하여 위산에 노출되면 조기 활성화되거나 분해되므로 장용코팅, 젤라틴캡슐 등 위산을 견딜 수 있는 제형으로 출시된다[3]. 장용정의 경우 소장에서 체내로 흡수되어 위산억제 효과가 늦게 나타나기 때문에 장용 피복을 입히지 않고 omeprazole이나 esomeprazole에 중탄산염나트륨을 추가해 즉시 작용하게 한 속방형 제형이 개발되었다[19]. 또 dexlansoprazole처럼 이중 지연 방출캡슐로 용출 방식을 조절하여 효과지속 시간을 늘린 제형도 개발되었다[20].
2) 약리기전
PPI는 위산 분비의 최종단계인 양성자펌프를 차단하므로 강력한 위산분비억제 효과를 나타낸다[21]. PPI는 pKa가 5.1 이하 (omeprazole 4.09, lansoprazole 3.92, pantoprazole 3.89, rabeprazole 4.71, ilaprazole 5.1)인 약염기의 친유성(lipophilic) 물질로 쉽게 세포벽을 통과해 산성공간에 축적된다[22,23]. 그러므로 소장에서 흡수된 PPI는 혈액을 통해 벽세포로 이동해 체내 유일한 산성 환경인 분비소관(pH ~1.0)에 축적되는데, 이론적으로 pKa 4.09인 omeprazole의 경우 혈액보다 1,000배 이상의 농도로 분비소관에 축적된다. PPI는 전구약물이기 때문에 분비소관에서 H+와 만나 양성자화되면 3단계를 거쳐 활성형태 구조물인 sulfenamide 또는 sulfenic acids로 변환되어야 작용할 수 있다. 이 활성형이 양성자펌프의 cysteine 기에 비가역적 공유결합을 하면 양성자펌프의 구조적 변화가 억제되고 결과적으로 위산 분비가 차단된다[3]. 위산분비 억제효과는 활성형의 총량과 연관되는데, 활성형이 만들어지는 것은 PPI의 최고 혈중 농도보다는 혈중 약물농도-시간 곡선하 면적(area under the plasma concentration-time curve, AUC)과 연관된다. 또 위산분비 억제효과 유지기간은 PPI의 혈중 반감기보다는 ‘활성형 PPI-양성자펌프 결합체’의 반감기(24~48시간)에 의해 결정된다[22]. 이런 약동학적 특성과 산에 불안정하여 분비소관에서 오래 유지되지 않는 PPI의 특성을 고려할 때 PPI가 활성화되는 시점에 분비소관에 가능한 많은 활성형 양성자펌프가 있어야 위산억제 효과가 극대된다. 그러므로 식전 30~60분에 PPI를 복용해 분비소관에 축적된 상태에서 식사를 하면 양성자펌프 활성화에 의한 위산분비로 PPI가 활성형으로 바뀌고 즉시 활성화된 양성자 펌프를 억제할 수 있다. 하루에 공복시간이 가장 긴 때 인 아침 식후에 양성자펌프의 약 70%가 활성화되므로 PPI를 아침 식전에 복용하는 것이 가장 효과적이다[3]. 양성자펌프의 반감기는 54시간으로 추정되고 매일 약 20%가 새 펌프가 생성된다[3]. 그러므로 PPI 복용 첫날 약 24~43%의 양성자펌프가 억제되고 4~5일 복용 후 평형상태에 도달하면 80%가량이 억제되므로 PPI에 의한 최대 효과가 나타나는데 시간이 필요하다[3,22]. 이런 PPI의 짧은 반감기와 분비소관에서 쉽게 사라지는 특성 때문에 야간 속쓰림 개선을 위해 자기 전에 PPI를 투여하면 새벽의 산분비 시점에는 거의 사라져 효과적으로 야간 산분비를 억제하지 못한다.
PPI의 종류에 따라 증상 호전의 차이는 크기 않은 것으로 알려져 있지만, 작용하는 cysteine기의 target 부위, pKa 상수, 반감기, 그리고 sulfonamide 변환시간 등의 차이에 따라서 약리학적 특성은 다소 다르다[24]. PPI의 대사는 간의 CYP에 의존하는데 다형성 CYP2C19와 CYP3A4에 주로 관여하며, 각 효소에 대한 의존도는 약제마다 다소 차이를 보인다[3]. 또 개인 간 CYP2C19 다형성 차이가 1세대 PPI의 위산분비억제 활성에 영향을 미치는 것이 확인되었는데, 초신속 대사형(ultra-rapid metabolizer)인 경우 3~5배까지 PPI 용량을 올릴 것이 권고되었다[25]. 이에 반해 2세대 PPI는 CYP2C19 다형성의 영향을 덜 받아 용량조절이 필요없다[25]. 반면 CYP2C19의 지연 대사형 (poor metabolizer)에서는 혈중 반감기가 다른 표현형에 비해 지나치게 길게되므로 부작용이나 약물상호작용에 더 취약할 수 있다. CYP2C19 유전형의 차이로 인해 약물의 효과가 불충분하거나, 부작용, 약물상호작용이 우려되는 경우에는 PPI 계열 약제 중에서 CYP2C19의 대사를 적게 경유하는 약제 선택을 고려해야 한다.
4. 칼륨 경쟁적 위산분비 차단제
1) 칼륨 경쟁적 위산분비 차단제의 역사
PPI는 H2RA에 비해 더 강력하고 지속적인 위산억제효과를 가지고 있어 지난 30여 년간 위산 관련 질환의 치료에 효과적으로 사용되어 왔다. 그러나 여전히 느린 작용시간, CYP2C19의 유전자 다형성 영향과 약제 상호작용, 불만족스러운 야간 산분비 억제효과, 산성환경에서 불안정성, 식전복용과 같은 많은 제한점이 있었다. 이를 극복하고자 새로운 제형의 PPI가 개발되었으나 기존 PPI에 비해 아주 큰 장점을 보여주지 못했고 이에 대한 대안으로 새롭게 개발되어 수년 전부터 임상에서 사용되기 시작한 P-CAB의 역할이 주목받고 있다[26].
P-CAB은 PPI와 동일하게 양성자펌프를 억제하지만 K+ 유입을 경쟁적으로 억제하는 것이 차이점이다. 1982년에 최초의 P-CAB인 SCH28080이 Schering-Plough사에서 개발되었으나 심각한 간독성 부작용이 발생하여 상용화에 실패하였다[26,27]. AstraZeneca에서 개발한 linaprazan (AZD0865)은 임상시험에서 미란성 및 비미란성 위식도역류질환의 증상 완화에 esomeprazole과 유사한 효능을 보였지만, 역시 간독성 문제가 있었고 상대적으로 낮은 효과때문에 2002년 개발이 중단되었다[28]. 최초로 상용화된 P-CAB은 유한양행에서 2005년 개발한 revaprazan인데, 위산분비 억제효과가 기존 PPI와 비교 시 우월하지 않아 위식도역류질환에 대한 적응증을 획득하지 못했고 간기능 악화의 문제가 있었다[29]. 위산억제능 측면에서 진정한 의미의 P-CAB이라고 할 수 있는 것은 2015년 Takeda가 개발해 상용화한 vonoprazan으로 미란성 식도염, 소화성궤양, 헬리코박터 파일로리 제균치료에 사용되고 있다[30]. 이후 2018년 InnoN에서 tegoprazan을[31], 그리고 2022년 대웅제약에서 fexuprazan을 출시해 국내에서도 위식도역류질환과 소화성궤양 및 헬리코박터 제균치료에 사용되고 있다[32]. 중국 Carepher제약도 keverprazan을 개발해 2023년 2월에 허가를 받았고[33], 국내 제일약품에서도 zastaprazn을 개발하고 있어 P-CAB의 경우 아시아에서 약물 개발을 이끌어나가고 있는 실정이다[34]. 한편 AstraZeneca가 포기했던 P-CAB 후보 물질 linaprazan은 Cinclus Pharma가 전구약물인 linaprazan glurate (X-842)로 개발중이며 현재 3상연구를 진행중이다[35].
2) 약리기전
P-CAB은 분비소관에 축적된 후 즉시 양성자화되어 양성자 펌프 관강면(luminal side)의 K+ 부착부위에 이온결합을 함으로써 경쟁적으로 K+ 유입을 방해한다. P-CAB은 K+ 이온보다 분자가 크기 때문에 K+이 결합하는 부위를 직접 차지하기보다는 K+가 결합 부위에 접근하는 것을 방해하는 기전으로 생각된다[36]. K+ 유입은 위산분비의 필수요소이기 때문에 P-CAB으로 양성자펌프가 K+을 이용하지 못하면 결과적으로 위산분비가 차단된다[22].
P-CAB은 고유의 약동학 및 약력학 특성으로 PPI가 가지고 있던 여러 단점들을 극복할 수 있기 때문에 임상에서 유용성이 확인되었고(Table 1), P-CAB을 가장 오래 사용해 온 일본에서는 이미 위식도역류질환 가이드라인에서 표준치료로 자리잡았다[37]. 우선 PPI는 낮은 pH에서 불안정하고 작용을 위해서는 산에 의해 활성형된 후 여러 단계에 걸쳐 구조가 바뀌어야 하는 전구약물이기 때문에 활성형 양성자펌프만을 억제할 수 있다. 그러므로 복용 후에 효과 발현이 느리고 최고혈장농도 도달시간과 위내 pH의 변화가 일치하지 않는다[36,38]. 반면 P-CAB은 산성환경에서 안정적이고 활성화가 필요없기 때문에 활성형 및 휴지기 양성자펌프에 모두 결합할 수 있고, PPI와 비슷한 최고 혈장농도 도달 시간을 보이더라도 PPI보다 더 빠르게 위내 pH를 올릴 수 있다[30,38,39]. Tegoprazan 50 mg, vonoprazan 20 mg, esomeprazole 40 mg을 비교한 약력학적 연구에서 단회 투여 시 위내 pH가 4 이상으로 올라가는 시간은 tegoprazan이 약 1시간으로 vonoprazan이나 esomeprazole의 3~4시간에 비해 빨랐다[40]. Fexuprazan 20 mg은 esomeprazole 40 mg과 비슷한 pH 상승시간을 나타냈는데, fexuprazan이나 vonoprazan도 표준용량보다 높은 용량에서는 esomeprazole보다 더 빠 게 pH를 4 이상으로 상승시켰다[41,42].
두 번째로 PPI가 활성형 양성자펌프만 억제하기 때문에 평형상태에 도달해 최고 효과를 보이기 위해 4~5일이 필요한 반면, P-CAB은 투여 첫날부터 최고 효과를 나타낸다[39,41-43]. 세 번째로는 환자 순응도 면에서 가장 큰 장점으로서 P-CAB은 산에 의한 활성화가 필요 없기 때문에 식사와 관계없이 자유롭게 복용할 수 있고, 또 식사가 약물의 흡수에도 큰 영향을 미치지 않는다는 점이다[26,42,44]. 이러한 특성들은 P-CAB이 필요시(on demand) 요법에 가장 적합한 위산억제제로 이용될 수 있는 요인들이다.
네 번째 장점은 PPI에 비해 긴 위산억제 작용시간이다. P-CAB도 약염기의 친유성 약물이지만 pKa가 PPI보다 높고 산성환경에 안정적이어서 분비소관에 높은 농도로 축적될 수 있다. 이론적으로 pKa 6.0인 P-CAB은 혈중보다 분비소관에 약 100,000배 이상 축적되는 것으로 추정되는데[22] 현재 상용화된 P-CAB인 vonoprazan, tegoprazan, fexuprazan의 pKa는 각각 9.06, 5.1, 8.4다[30,43,45]. 또한 PPI보다 혈중 반감기가 긴 것도 위산억제 효과가 긴 요인 중 하나인데 표준 용량의 다회 투여 시 혈중 반감기는 vonoprazan과 tegoprazan이 6.85±0.80 시간[30], 5.22±1.35 시간임에[46] 비해 fexuprazan은 9.73±1.17 시간으로[47] 상대적으로 길다. 이렇게 분비소관에서 높은 농도로 오래 유지되는 것과 긴 반감기의 특성들로 PPI보다 야간 위산 분비 억제에 더 효과적이다[48,49].
대사의 측면에서도 CYP2C19이 아닌 CYP3A4에 의해 대사되므로 CYP2C19 유전자 다형성에 대한 개인차가 적고 상대적으로 약물상호작용이 낮아 다약제를 복용하는 환자들에게 사용할 때 장점으로 작용한다[26].
결 론
1970년대에 위산분비 생리에 관여하는 히스타민-2 수용체와 양성자펌프가 발견되었고, 이를 기반으로 H2RA가 개발되어 위산 관련 질환 치료의 새로운 시대를 열었다. 이후 위산분비의 최종단계를 억제하는 강력한 PPI가 개발되어 30년 이상 사용되어 왔고, 최근에는 복용의 편리성이나 위산억제 지속시간의 측면에서 장점을 가진 P-CAB이 상용화되면서 위산 관련 질환 치료가 한 단계 더 발전하였다. 가장 흔한 위산 관련 질환에 대해 다양한 약물을 선택할 수 있기 때문에 최선의 치료 효과를 얻기 위해서는 위산분비의 생리와 각 약제의 특성 및 장점에 대한 충분한 이해가 필요하다. 동시에 과다한 위산억제의 부작용도 고려해야 하며, 특히 새로 개발된 P-CAB의 경우 장기 안전성에 대한 결과를 지켜볼 필요가 있다.
Notes
AVAILABILITY OF DATA AND MATERIAL
Data sharing is not applicable to this article as no datasets were generated or analyzed during the study.
CONFLICT OF INTEREST
There is no potential conflict of interest related to this work.
AUTHOR CONTRIBUTIONS
Conceptualization: Yong Sung Kim. Data curation: Dong Han Yeom and Yong Sung Kim. Funding acquisition: Dong Han Yeom. Investigation: Dong Han Yeom. Writing - original draft: Dong Han Yeom. Writing - review & editing: Yong Sung Kim.
FUNDING STATEMENT
This work was supported by Wonkwang University 2023 (D.H.Y.).
ACKNOWLEDGMENTS
None.