헬리코박터 제균에 성공한 과거 감염자에 대한 접근
Approach to Patients after Successful Eradication of Helicobacter pylori
Article information
Trans Abstract
Helicobacter pylori (H. pylori) is a well-known gastrointestinal microorganism that causes chronic gastritis and peptic ulcers, which may evolve into gastric cancer. Previous studies have shown that H. pylori eradication inhibits the development of primary and metachronous gastric cancer. Therefore, the Kyoto global consensus recommends eradication therapy for both symptomatic and asymptomatic H. pylori-infected patients. Gastric cancer is detected even in patients after successful H. pylori eradication. Recent studies have reported the role of endoscopy in detection of primary gastric cancers after H. pylori eradication. Development of gastric cancer may be observed several months or even >10 years after successful H. pylori eradication. Therefore, identification of high-risk patients in whom extensive surveillance may prove beneficial represents a clinical dilemma. In this review, the characteristics of gastric cancer patients who have undergone successful H. pylori-eradication therapy are summarized.
서 론
헬리코박터 파일로리(Helicobacter pylori, H. pylori)는 인간에게 만성 위염, 소화성 궤양, 심지어 위암까지 유발시킬 수 있는 위장관 미생물로 잘 알려져 있다[1]. 1994년 세계보건기구(WHO) 산하 국제암연구소(International Agency for Research on Cancer)는 H. pylori를 위암에 대한 1군 발암물질로 분류하고 있다[2]. 위암은 전 세계적으로 5번째로 흔하고 4번째로 흔한 사망 원인이며 특히 동아시아에서 발병률이 높은 것으로 알려져 있는데[3], 이는 동아시아인과 서양인에서 H. pylori 감염률의 차이와 더불어 유전적 및 다양한 식생활 등이 위암 발생에 영향을 미친다고 할 수 있다. 일반적으로 만성 H. pylori 감염은 위축성 위염과 장상피화생을 유발하여 이형성과 위암으로 발전한다[4]. 여러 연구에서 성공적인 제균 치료 후에 위축성 변화의 개선을 보고하고 있으며 장상피화생의 경우 아직까지 논란의 여지가 있으나 일부 연구에서는 이 역시 개선을 보고하고 있고 더 나아가 H. pylori 제균 치료가 위암 발생의 예방에 효과가 있음이 알려져 있다[5-7]. 그러나 성공적인 H. pylori 제균 치료 후에도 원발성 또는 이시성 위암이 유발될 수 있음이 밝혀졌다[8,9]. 최근에 H. pylori 제균 치료가 광범위하게 이루어지면서 성공적인 제균 치료 후에도 발생하는 위암을 이전에 비하여 임상에서 빈번하게 접할 수 있게 되었다. 이에 본고에서는 제균 치료 후 발생하는 위암의 특성과 이와 관련된 위험인자를 알아보고자 한다.
본 론
1. H. pylori의 성공적인 제균 치료 전후의 내시경 소견
H. pylori 감염은 점막의 지속적인 염증으로 결정상(nodularity), 주름의 비후(rugal hypertrophy), 미만성의 발적(diffuse redness), 점상 홍반(spotty redness), 점막 부종(mucosal swelling)과 끈적한 점액(sticky mucus) 등의 내시경적인 위염을 유발하는 것으로 잘 알려져 있다. 여러 연구에서 H. pylori의 제균 치료가 조직학적 위염뿐만 아니라 H. pylori 관련 내시경적인 위염 소견을 개선하는 것으로 보고하고 있다[10-12]. 최근에는 위점막의 내시경 소견으로 H. pylori 감염 상태와 위암에 대한 위험성을 예측할 수 있는 Kyoto 분류가 소개되었다[13]. Kyoto 분류의 주요 내용은 국소 병변이 아닌 배경 위점막의 내시경 소견으로 H. pylori 감염 상태를 판단하여, 5대 전암성 병변인 위축, 장상피화생, 주름 비대, 결절, 광범위한 발적을 토대로 H. pylori의 현재 감염, 과거 감염(제균 후), 미감염을 위내시경 소견으로 감별하고 위암에 대한 위험성을 0~8점 사이로 점수화하여 예측하는 데 있다. 또한 Kyoto 분류에서는 광범위한 발적에 세정맥 집합(regular arrangement of collecting venules)의 소실도 포함하여 분류하고 있다. H. pylori 제균 후에는 위점막의 만성적인 염증이 개선되면서 조직학적으로는 다핵구 침윤은 저명하게 개선되어 거의 사라지게 되며, 단핵구 침윤도 제균 직후 크게 감소하고, 남아있는 단핵구 침윤은 제균 후 4~5년에 걸쳐 점진적으로 개선되게 된다[14,15]. 따라서 제균 후의 내시경 관찰 시기에 따라서 H. pylori 감염 소견 시의 점막 소견과 미감염 소견이 혼재되어 관찰될 수 있다. 제균 성공 후 단기간 내에 점상 발적, 미만성 발적, 점막 종창, 위 주름의 종대와 사행, 끈적한 점액은 개선되는 경우가 많으며, 점상 출혈의 개선이 가장 빈번한 것으로 보고되고 있다. 성공적인 제균 치료 후에는 위산 분비능의 회복으로 전정부에서 편평 미란이 관찰되기도 한다[16,17]. 또한 지도 모양의 발적(map-like redness)은 제균 후 내시경 검사에서 흔하게 관찰이 되는데 위축 영역의 장상피화생을 가진 점막은 발적으로, 반대로 위축이 없는 영역의 위저선 점막은 미만성 발적이 소실하기 때문에 백색조로 관찰되는 것으로 알려져 있다(Fig. 1) [18].
2. 성공적인 제균 치료 이후의 발견되는 위암의 특징
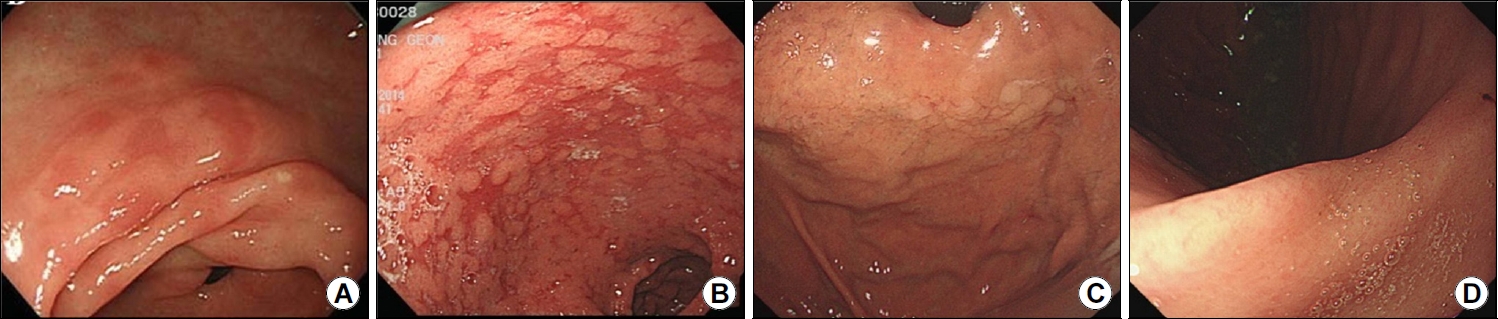
성공적인 H. pylori 제균 치료 후에 발생하는 위암은 내시경 검사에서 경계선이 명확하지 않거나 일반적인 위암의 특성이 소실되기 때문에 진단하기 매우 어려운 경우가 많은데 병변 크기가 20 mm 미만으로 대체로 작고, 얕은 함몰 또는 평탄한 형태이며, 세포 증식 패턴이 적고, 조직학적으로 분화된 형태를 띠고 있으면서 위암의 일부를 비신생물성 상피가 덮고 있다고 알려져 있다[8,19]. 또한 제균군에서 발생하는 조기 위암의 색조는 대체로 백색조보다는 발적을 띤 경우가 많으며 전체적으로 위염과 유사한 양상(gastritis-like pattern)을 보인다고 보고하고 있다(Fig. 2) [19-21]. 이러한 경향이 보이는 현상은 제균 치료에 성공한 후 암성 점막과 주변부 정상 점막 모두에서 염증 활성이 조절이 되면서 발생하고 특히 암성 점막의 maturation이라는 과정을 보이면서 조금 더 분화된 형태로 보이며 또 한편으로는 제균 치료에 의하여 암성 조직의 성장이 억제되면서 점막 간질(mucosal stroma)이 상대적으로 확장이 되고 점막 간질 내 혈관의 혈액이 더욱 시각화되는 것으로 설명하고 있다[21,22]. Ito 등[23]은 성공적인 제균 치료 후 발생하는 위암의 경우 납작하고 불분명한 형태로 보이며 특히, 불분명한 경계를 보이는 병변의 73%에서는 비종양성 상피가 종양을 덮고 있으며 위선종(gastric adenoma)의 경우에는 선와상피(foveolar epithelium)가 선종 조직을 일부 덮는 현상도 보고하였다. 이것은 H. pylori 제균 치료가 위 종양의 상향(팽창) 성장을 억제할 수 있음을 나타내고 이러한 이유로 성공적인 제균 치료 후에 발견된 대부분의 위암이 내시경에서는 평탄하고 함몰 형태를 띠게 된다고 설명하고 있다. Kitamura 등[24]은 성공적으로 제균 치료를 마친 환자들에서 발생한 조기 위암 28예 중 22예(81%)에서 일부 상피가 저도 이형성(low-grade dysplasia)으로 이어져 발견되는 현상을 발표하였고 저도 이형이 분포하는 형태는 점상(spotty)으로 배열하는 양상을 보이며 주변의 정상 점막과는 비연속성을 보인다고 발표하였다. 이러한 경향은 위점막 연관 림프조직림프종(mucosal-associated lymphoid tissue lymphoma)이 제균 치료 후 호전되는 것과 유사하게 위선암에서도 제균 치료 후에 종양 세포의 일부가 성숙한 위 상피의 원래 특성으로 전환되는 과정에서 발생하는 현상으로 설명하고 있다. 한편 H. pylori 제균 치료 후 발생하는 종양은 대체로 크기와 형태가 억제되었지만 침윤 깊이는 조금 더 공격적인 경향을 보인다. Hori 등[21]은 제균 치료군에서 종양이 더 깊고 더 빈번한 점막하 침윤을 보인다는 것을 발견하였다. 다기관 propensity score-matched 연구에서도 H. pylori 감염군보다 제균 치료군에서 점막하 침윤의 경향이 더 높은 것으로 나타났다[25]. 또 다른 연구에서는 유의미한 차이는 관찰되지 않았지만, 성공적인 제균 치료군에서 발생한 위암의 경우 점막하 침윤이 더 높은 경향을 보고하였다[26]. 이에 대한 근거는 명확하지 않으나 제균 치료군에서 발견되는 위암의 특성을 고려해 본다면 진단이 늦어짐으로 인하여 상대적으로 점막하 침윤이 진행한 상태에서 발견이 될 수있으며 또 다른 근거로는 제균 치료 후 점막 간질(mucosal stroma)의 염증이 호전되면서 암세포가 빠르게 점막하층으로 침윤하기 때문으로 설명하고 있다[21].

Images showing gastric cancer detected 5 years after successful Helicobacter pylori eradication. The cancer lesion appears flattened and is indistinct from the surrounding mucosa. Images are obtained using the following imaging techniques: white-light imaging (A), indigo carmine dye imaging (B), narrow-band imaging (C).
H. pylori 감염 여부에 있어서 일반 백색광 내시경에 비하여 확대 내시경과 narrow band imaging (NBI), linked color imaging (LCI)와 같은 영상 강화 내시경(image-enhanced endoscopy)이 유리하며 특히 확대된 NBI와 LCI는 일반 백색광 내시경에 비해 헬리코박터 감염 상태 예측에 있어서 진단 정확도가 더 높은 것으로 알려져 있다.27-30 최근에 앞서 언급한 다양한 영상 강화 내시경 검사를 이용하여 제균 치료 후 발생하는 위암의 진단의 유용성에 대한 보고가 있다. 특히 확대된 NBI 검사는 위염과 같은(gastritis-like) 형태의 제균 치료 성공 후에 발생하는 조기 위암의 진단에 유용한 것으로 알려져 있는데 그 특징적인 소견은 표면이 균일한 유두(papillae) 및/또는 흰색 테두리를 띠고 규칙적이며 미세혈관은 희미하고 경계는 불분명하면서 인접한 비암성 점막과 유사한 관 모양의 위소와(gastric pit)를 보인다고 알려져 있다[31]. 그러나 영상 강화 내시경이 제균 후 발생하는 조기 위암의 발견에 유용한지에 대한 연구가 아직까지는 제한적이고 이에 대한 더 많은 연구가 필요하겠다.
3. 성공적인 제균 치료 이후의 발생하는 위암의 발병 위험인자
위축성 위염은 H. pylori 감염 후 위암 발생의 중요한 위험인자로 잘 알려져 있다[32]. 심한 개방형 위축성 위염를 제외하고는 헬리코박터와 같은 위험인자를 제거하는 경우 위축성 변화는 대부분 개선됨을 보고하고 있다[33]. 하지만 Shichijo 등[34]은 제균 치료 후에도 위축성 위염의 정도에 따라 원발성 위암 발병률이 증가한다는 것을 보고하였다. 또 다른 연구에서는 중증의 개방형 위축성 위염(O-2, O-3)이 H. pylori 제균 후 발생하는 위암의 독립적인 위험인자임을 확인하였다[35]. 최근 발표된 또 다른 연구에서도 심한 위축성 위염은 제균 치료 후 발생하는 원발성 위암의 직접적인 위험 요소라고 밝히고 있다[36]. 장상피화생의 경우도 범위가 넓을수록 제균 치료 후 원발성 위암의 발생의 위험도를 높이는 것으로 보고하고 있다[37]. 제균 치료 후에 관찰되는 지도상 발적이 있는 군에서도 역시 원발성 위암의 발생이 유의하게 더 높았고(각각 60.5% vs. 31.1%, P=0.0010) [36], 또 다른 연구들에서도 지도 모양의 발적은 제균 치료 후 발생하는 원발성 위암의 양성 예측인자라고 보고하고 있다[30,38]. H. pylori 제균 치료 성공 후 남은 위저선(fundic gland)에 지도 모양의 발적과 세정맥 집합의 부재가 원발성 위암 발생과 관련된 중요한 내시경 소견으로 보고하였다[30]. 한편 Mori 등[39]은 내시경 치료를 통해 성공적으로 조기 위암을 제거하고 제균 치료까지 마친 후 발생하는 이시성 위암 발생의 위험인자로는 남성, 제균 성공 이전의 중증 위점막 위축, 다발성 위암이 독립적인 위험인자로 밝혔다. 실제로 많은 전문가들은 H. pylori 제균 치료가 위축성 위염 및 장상피화생이 발생하기 전에 시행되었을 때 위암 예방에 더 효과적이며 이미 전암성 병변이 진행된 환자에서는 H. pylori 제균 치료만으로는 위암 발병을 완전히 예방할 수는 없다고 밝히고 있다. 하지만 다른 한편으로는 중국 산동 지역에서 시행한 무작위 배정 연구에서는 정상 점막이나 만성 위축성 위염이 있는 환자에서보다 오히려 장상피화생 및 이형성이 있는 환자에서 제균 치료 시 위암 예방 효과가 우수하다고 보고하고 있다(OR, 0.56; 95% CI, 0.34~0.91) [7]. 따라서 H. pylori 감염에 따른 위염의 침범 범위와 위산 분비능의 정도가 향후 위암 발생과 연관이 많기 때문에 이전에 조기 위암 및 선종 등으로 내시경 치료를 시행받은 경우를 포함하여 위궤양 과거력, 체부를 포함한 위축성 위염 및 장상피화생이 심한 고위험군의 경우[40] 제균 치료 후에도 조금 더 세심한 내시경 추적 관찰이 필요하다고 할 수 있다[8].
4. 성공적인 제균 치료 이후의 추적 검사
국내 전향 연구에서 H. pylori 제균 치료가 이시성 위암의 발생을 감소시킨다고 보고하였다. 그러나 제균 성공한 437명의 환자에서 18건(4.1%)의 이시성 위암이 발생하였고[41] 같은 저자의 또 다른 전향적, 이중 맹검, 무작위 연구에서도 H. pylori 제균 치료군에서 위암 발병률이 7.2% (14/194) 발생하는 것으로 발표하고 있다[42]. Kamada 등[8]은 성공적으로 제균 치료를 받은 환자에서 연간 위암 발병률이 0.24%이고 80%의 환자가 제균 치료가 완료된 지 48개월 내에 진단이 되었고 20%의 환자가 48개월 이후에 위암이 진단되었다고 하였다. Toyoshima 등[35]도 성공적으로 H. pylori 제균 치료를 달성하고 주기적으로 상부위장관 내시경 검사를 받은 1,232명의 환자 중 15명에서 위암이 발생하였고 누적 발생률은 2년 1.0%, 5년 2.6%, 10년 6.8%라고 보고하였다. 한편 임상에서는 제균 치료가 성공한 경우에도 진행성 위암으로 진단이 되는 경우를 드물지 않게 접하게 된다. 제균 치료 후에 발생한 원발성 진행성 위암 환자 48명의 임상 경과를 모아 발표한 연구에서는 제균 치료에 성공한 군에서 발생한 진행성 위암의 크기가 제균하지 못한 군에서 발생한 진행성 위암에 비하여 종괴의 평균 중간값이 더 작고 R0 절제율이 더 높았으며 제균이 성공한 후에 진행성 위암으로 진단이 된 환자의 약 66.7%가 5년 이내에 발견되었다고 밝히고 있다[43]. 더불어 이 연구에서는 제균 후 진행성 위암이 발견된 환자군에서 통계적으로 흡연이 중요한 위험인자라고 보고하였다.
Haruma 등[44]은 점막암의 배가 시간(doubling time)이 약 16.6개월이고 단일 위암세포가 내시경적으로 진단이 가능한 10 mm 정도의 크기까지 성장하는데 적어도 10년이라는 기간이 소요됨을 보고하였다. 한 후향적인 연구에서는 제균 후 5년까지 조기 위암 발생에 주의가 필요하다고 보고하고 있으며[45] 또다른 연구에서는 제균 치료 후에도 내시경 검사를 통한 추적 검사가 10년 이상 지속되어야 함을 밝히고 있다[46]. 실제 임상에서 내시경 검사는 비용 효율적인 측면에서 위암의 진단에 높은 민감도와 특이도를 보이며 위암의 조기 발견으로 내시경 치료 및 수술 기회가 증가하고 위암으로 인한 사망률이 감소한다. Kowada [47]는 위축성 위염이 있는 H. pylori 제균 치료에 성공한 환자에서 내시경 검사를 시행한 경우가 추적 검사를 하지 않은 경우에 비해 비용 효과적임을 입증하였고 더불어 경증에서 중등도까지의 위점막 위축 환자에서는 격년의 내시경 검사가, 중증 위점막 위축 환자에서는 매년 내시경 검사가 가장 비용 효과적이라고 보고하였다. 따라서 성공적인 제균 치료 후에 환자의 위암 발생 위험인자에 따라 최소한 5년에서 10년 동안, 1년 또는 2년 간격의 면밀한 추적 내시경 검사가 필요하다고 할 수 있다[43,47]. 한편 펩시노겐(pepsinogen, PG) 방법은 위암 검진 프로그램에서 광범위하게 사용되고 있다. 낮은 PGI 수치와 낮은 PGI/II 비율은 점막 위축과 관련이 있기 때문에 위암의 고위험군을 식별하기 위한 추적 검사 방법으로의 효용성에 대하여 여러 코호트 연구에서 보고되었다. 하지만 H. pylori의 성공적인 제균 후의 점막의 병리학적인 변화 여부와 PGI과 PGI/II ratio 및 gastrin의 수치의 변화 정도 간의 연관성에 대한 연구가 많지 않으며 제균을 마친 환자에서 위암 발생의 추적 검사에 있어서의 PG 방법의 유용성은 아직까지는 많은 연구가 없어 제한적이다[22].
결 론
H. pylori의 성공적인 제균 치료 후에도 원발성 또는 이시성 위암 발생이 가능하다는 점을 유의해야 한다. 고위험군 특히 제균 당시 체부의 기저 점막에 심한 위축성 변화와 장상피화생이 있는 경우 정기적인 추적 검사가 반드시 필요하다. 그리고 성공적인 제균 치료 후에 발생하는 위암의 내시경 특성인 작고 평탄 또는 얕은 함몰을 띠면서 마치 위염과 같은 소견으로 관찰되는 점을 고려하여 사소한 점막 변화에도 주의를 기울여야 한다. 성공적인 제균 치료 후 위암 발생까지의 시간은 수개월에서 10년 이상까지 다양하였다. 따라서 정기적인 추적 검사로 이득을 얻을 수 있는 고위험군을 식별하는 것이 중요하며 추적 검사의 간격과 기간에 대한 연구가 거의 없는 실정으로 이에 대한 장기간의 전향적인 연구가 필요하겠다.
Notes
There is no potential conflict of interest related to this work.