십이지장의 선천적 이상으로 인한 해부학적 질환
Anatomical Diseases Caused by Congenital Duodenal Abnormalities
Article information
Trans Abstract
Disorders of duodenal anatomy are rare and originate during the early embryological development of the foregut. These disorders are associated with significant morbidity in children; however, they may remain undetected during childhood and present during adolescence or adulthood. Duodenal atresia or web, annular pancreas, Ladd’s bands associated with midgut volvulus, and preduodenal portal vein represent duodenal anomalies that may cause partial or complete duodenal obstruction. Duodenal atresia and web occur secondary to incomplete recanalization of the duodenal lumen during the 8th to 10th week of gestation. These anomalies usually require surgical correction; however, the role of endoscopic interventions using innovative equipment is being investigated. Duodenal duplication cysts are an extremely rare congenital anomaly. Most abut the second or third portion of the duodenum and histologically show the normal duodenal wall layers. These lesions clinically present with abdominal pain, weight loss, vomiting, pancreatitis, or features of biliary tract obstruction. Imaging studies including transabdominal ultrasonography, computed tomography, MRI, and endoscopic ultrasonography are useful for detection of the cystic structure. Surgery is the conventional therapeutic modality used for management of duodenal duplication cysts; however, marsupialization (endoscopic intervention to establish communication between the cyst cavity and the duodenal lumen to facilitate duodenal drainage of cystic contents) is increasingly being performed in clinical practice. Duodenum inversum and duodenal diverticula are congenital duodenal disorders that require endoscopic or surgical management in symptomatic patients.
서 론
십이지장의 해부학적 이상으로 인해 발생하는 질환은 빈도가 매우 드물며, 발생 초기의 앞창자(foregut)의 발달 이상에서 기원한다[1]. 영유아 시기에 흔히 증상이 발생하나 이따금 청소년 시기나 성인이 되어 나타나기도 하며 소아에서와는 다른 진단과 치료적 접근을 요하기도 한다[2]. 질환에 따라 폐색에 의한 복통, 구토, 복부 종괴, 혹은 위장관 출혈 등 다양한 증상과 임상 양상을 유발할 수 있으며 영아기뿐만 아니라 청소년이나 성인에서도 중요한 임상적 문제를 일으킬 수 있다[3]. 본고에서는 십이지장의 해부학적 혹은 구조적 이상으로 발생할 수 있는 질환들의 원인, 증상 및 진단과 치료에 대하여 기술하고자 한다.
본 론
1. 폐색성 질환
십이지장 폐색을 일으킬 수 있는 질환은 십이지장 폐쇄증(duodenal atresia)과 십이지장 물갈퀴막(duodenal web), 고리췌장(annular pancreas), 중간창자 꼬임(midgut volvulus)에 동반된 Ladd 밴드, 십이지장 앞 문맥(preduodenal portal vein) 등이 있으며, 폐색의 정도에 따라 십이지장의 완전 혹은 부분 폐색을 유발한다[4].
1) 십이지장 폐쇄증과 물갈퀴막
십이지장은 발생 8~10주에 십이지장 벽을 구성하는 세포의 증식으로 인하여 내강이 막혔다가 그 후에 재개통(recanalization)되는 과정을 거친다[5]. 십이지장이 확대되고 길어지면서, 내부에서 공포(vacuole)들이 형성되고 합쳐져서 공간이 형성된다. 이어서 상피의 물질들이 유문에서 공장까지 연속적으로 제거되는 과정을 거쳐서 배아 12주째에는 완전히 열린 관강을 형성하게 된다. 상피 물질의 제거와 재개통 단계가 완전히 일어나지 못하고 남아있으면 십이지장 어느 부위라도 십이지장 폐쇄증 혹은 물갈퀴막이 발생한다[1]. 십이지장 물갈퀴막은 다운증후군이나 선천성 심장 질환 등 다른 선천성 이상과 흔히 동반되지만[6,7] 후천적으로 장기간에 걸친 비스테로이드성 소염제나 아스피린 사용의 합병증으로 인해 고령에서 발생한다는 보고도 있다[8].
십이지장 물갈퀴막은 막힌 정도에 따라 완전 십이지장 폐쇄증 혹은 열림이 없는 물갈퀴막(imperforate webs), 편측 혹은 중심 열림이 있는 물갈퀴막(perforate webs with eccentric or central apertures)으로 분류된다[2]. 십이지장 폐쇄증이나 구멍이 없는 물갈퀴막은 완전 폐색을 일으켜, 출생 직후에 구토나 복부 팽만의 증상을 나타내고 장기간 생존이 어렵다[1,2]. 그러나 불완전 폐쇄나 협착을 일으키는 십이지장 물갈퀴막은 비교적 나이가 들어서 학동기나 청소년기에 증상이 나타나기도 하고, 폐색이 거의 없는 미미한 협착의 경우는 성인이 될 때까지 무증상으로 있다가 우연한 기회에 발견되기도 한다[4,9]. 중등도 폐색으로 위와 근위 십이지장이 팽창하더라도 보상적 연동운동으로 배출 항진이 가능하고, 환자도 협착부 통과가 가능한 유동 식이를 장기간 지속하여 증상 발생이 지연되다가 20~30대 성인이 되면서 이런 보상 작용이 부족해지면 비로소 증상이 나타나는 것으로 추정하고 있다[1,2].
주요 임상 증상은 십이지장 폐색으로 인한 식후 복부 팽창, 구역, 구토, 체중 감소, 발달장애, 식이 거부 등이며[2], 흑색변이나 토혈 등의 출혈로 인한 증상도 보고된다[10,11]. 토사물의 색은 폐색의 위치에 따라 다른데, 바터팽대부 아래의 폐색이면 담즙 색을 띌 수 있다[4]. 성인 십이지장 물갈퀴막 환자 22명을 분석한 Ladd와 Madura [1]의 보고에 의하면 바터 팽대부 상방에 위치한 예가 90%였고, 성별은 여성(60%)이 남성보다 많았으며, 평균 진단 나이는 51.1세, 증상 지속 기간은 평균 93.6개월이었다. 증상은 구역과 구토가 85%에서 보고되었으며, 상복부 통증(65%)과 포만감(60%) 순으로 보고되었다[1]. 궤양이 동반되어 있는 경우도 60%에 달했으며 위식도 역류 현상과 체중 감소가 40%에서, 위장관 출혈 증상이 30%에서 동반되었다[1].
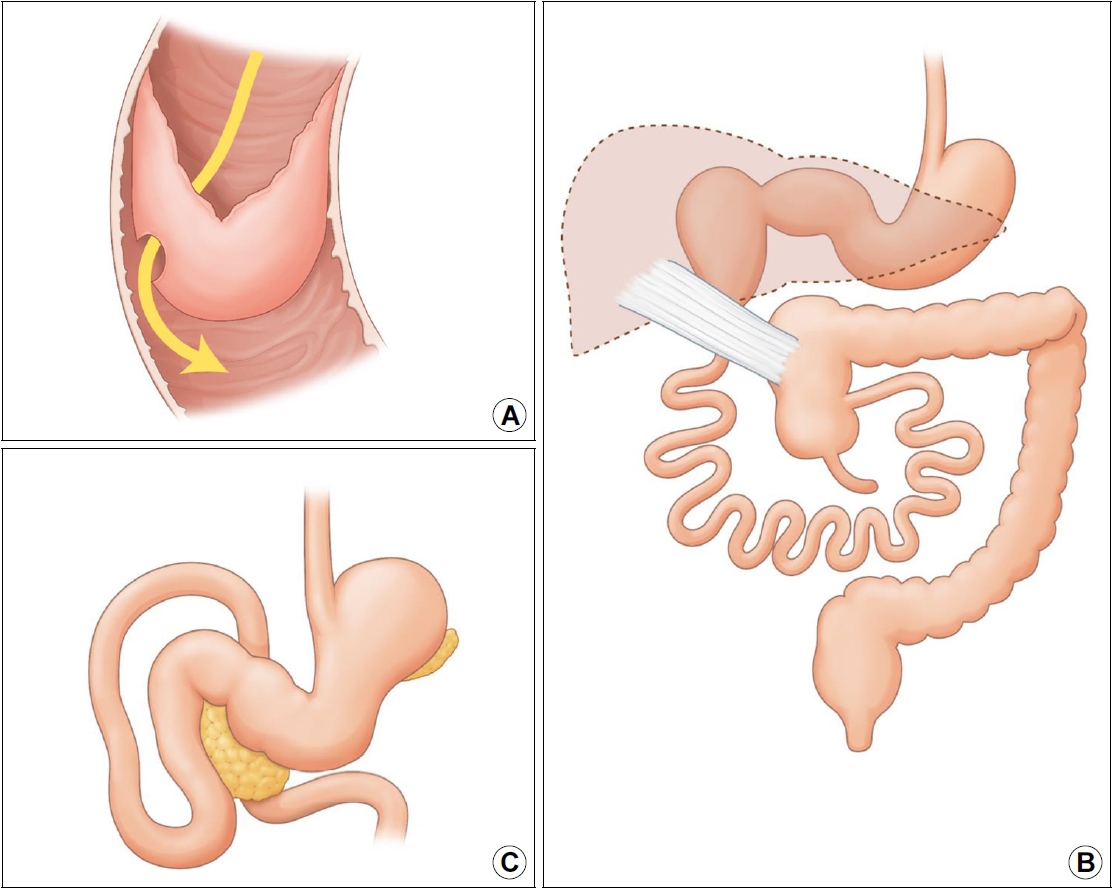
완전 십이지장 폐쇄증은 첫 수유 이후에 심한 구토와 복부 팽만을 일으키는 특징적인 증상과 함께 단순 복부 촬영 및 초음파에서 보이는 특징적인 이중 기포 음영을 바탕으로 진단할 수 있다[4]. 완전 폐색이 아닌 십이지장 물갈퀴막의 경우 여러 가지 영상학적 혹은 내시경적 진단 과정이 필요할 수 있다[1]. 상부위장관조영술에서는 편측성 혹은 중심성 열림이 있는 십이지장 물갈퀴막의 경우 십이지장 하행부에서 가로방향의 격막 구조물이 보이고[1,2], 원위부로 늘어진 특징적인 바람양말 징후(windsock sign)가 관찰될 수 있다[1,4]. 모식도로 그려보면 쉽게 이해할 수 있다(Fig. 1A). 복부 컴퓨터단층촬영을 통해 폐색 부위 상부의 확장과 함께 십이지장 물갈퀴막으로 인해 좁아진 부위를 직접 관찰해 진단한 보고들이 있다[8,12]. Ladd와 Madura [1]는 십이지장 물갈퀴막 환자 20명 중 9명에서 상부위장관 내시경 검사가 정확한 진단에 도움이 되었다고 보고한 바 있다. 이후 여러 증례에서 내시경 검사를 통한 진단을 보고하였는데, 특징적인 소견은 좁아진 십이지장 내강과 함께 다양한 크기의 개구부가 관찰되고, 협착부위 상부에 음식이나 이물질이 관찰되기도 하였다[7,12-21].
Images of duodenal anomalies. (A) Duodenal web showing a hole at its center and distal stretching secondary to peristalsis (referred to as a typical wind sock appearance). (B) Ladd's band. Small bowel loops are observed on the right with an absent ligament of Treitz; the appendix, cecum, and ascending colon are visualized on the left in cases of midgut volvulus. A fibrous peritoneal band, also referred to as a Ladd’s band compresses the duodenum to cause duodenal obstruction. (C) Duodenum inversum. Image showing reversal of the normal duodenal curve; the duodenum is observed to travel superiorly to the level of the duodenal bulb and thereafter posteriorly, and the 3rd portion of the duodenum crosses the midline superior to the pancreas.
완전 십이지장 폐쇄증이 진단되면 비위관을 삽입하여 위내 감압 및 흡인을 예방하고 수액 치료를 시작하고 임상적으로 안정되면 고전적으로는 개복 혹은 복강경을 통한 십이지장-십이지장 문합술 혹은 십이지장-공장 문합술을 시행하였다[3]. 수술 이후의 장기 생존율은 90% 후반으로 좋은 편이다[22]. 십이지장 물갈퀴막의 수술적 치료는 현재 세로 십이지장 절개(longitudinal duodenotomy) 이후 물갈퀴막을 완전 혹은 부분 절제하고 점막을 근접시킨(approximation) 후, 십이지장을 가로 방향으로 봉합하는(transverse closure) 것이 가장 타당하다고 받아들여지며, 과거에 행해졌던 십이지장 물갈퀴막을 우회하는 위-소장 문합술, 십이지장-십이지장 문합술 혹은 십이지장-공장 문합술은 더 이상 시행하지 않는다[1,2]. 과거에는 궤양이 동반된 경우 미주신경 절제술과 유문성형술, 날문방 절제술과 위-공장 문합술도 시행된 바 있으나, 물갈퀴막을 절개해 주는 수술적 교정 만으로도 십이지장 폐색이 호전되면서 전정부 감압과 가스트린 분비 감소로 위 산도가 정상화되어 자연스럽게 궤양이 치유될 수 있다[1]. 개복 수술과 복강경 수술에 대해서는 이견이 있어 앞으로 대규모의 비교 연구가 필요하겠다[3]. 최근 성인과 소아에서 십이지장 물갈퀴막을 다양한 절개도나 풍선을 이용하여 내시경 시술로 치료하려는 시도들이 있어 왔고, 일부에서는 출혈이나 협착의 재발이 있기도 하였으나 많은 예에서 성공적인 치료를 보고하고 있다[7,8,13,17-21,23-26]. 그러나 아직 내시경 치료와 수술의 치료 성적을 비교한 연구는 없는 상황이다[3].
2) 고리췌장
고리췌장은 발생 빈도가 1/20,000 정도로 알려져 있다. 정상 발생 과정에서는 발생 5주째에 배쪽 이자싹(ventral pancreatic bud) 두 엽(lobe)이 이동해 서로 합쳐져서 등쪽 이자싹(dorsal pancreatic bud)의 바로 밑으로 가지만, 배쪽 이자싹의 왼쪽 부분이 반대 방향으로 이동해 이자 조직이 십이지장을 둘러싸게 되면 고리췌장이 발생한다[1,6]. 십이지장 폐색의 정도가 심하면 신생아기에 증상이 발생하여 진단되지만 폐색이 심하지 않다면 간헐적인 구토의 형태로 지속되다가 20~50대에 진단되기도 한다[27]. 상부위장관내시경, 복부 CT나 MRI 등을 통해 진단할 수 있으며 십이지장을 둘러싼 고리췌장을 절제하는 수술적 치료를 요한다[27].
3) 중간창자 꼬임에 동반된 Ladd 밴드
중간창자는 발생 4~12주에 3단계에 걸친 회전 과정을 거친다. 위창자간막 동맥(superior mesenteric artery)을 축으로 반시계 방향으로 270도 회전해 그 결과로 십이지장은 복강의 좌측에 트라이츠 인대에 의해 후복막에 고정되고, 맹장은 우·하복부에 위치하게 된다[6]. 이 회전이 완전히 혹은 부분적으로 일어나지 않으면 소장이 우측에 자리 잡게 되고 맹장, 충수돌기와 상행결장은 좌측에 자리잡게 된다. 이 과정에서 Ladd 밴드라고 알려진 복막의 섬유성 밴드가 십이지장을 압박해 폐색을 일으킬 수 있다(Fig. 1B) [2]. 대부분 출생 한 달 이내의 신생아에서 발견되고 성인에서의 발생은 드물다[2,28]. 성인에서는 증상이 모호해 간헐적 복통, 구역, 구토가 수개월에서 수년간 지속될 수 있고, 무증상인 경우도 있다. 대부분 CT를 통해 진단되는데 소장이 주로 우측에 있으면서 맹장의 공기 음영이 없는 경우 의심할 수 있다[28]. 증상이 발생한 경우에는 Ladd 밴드를 절제하고 중간창자 꼬임을 풀어주는 Ladd 수술을 시행해야 한다는 의견에는 이견이 없지만, 무증상 성인에서 수술을 할 것인가에 대해서는 논란이 있다[2,3,28].
4) 십이지장 앞 문맥
정상적으로 십이지장 뒤쪽을 지나는 문맥이 발생학적 이상에 의해 십이지장 앞쪽으로 지나게 되면 십이지장 폐색을 일으킬 수 있다. 십이지장 앞 문맥은 단독으로 존재하기도 하지만 대부분 회전 이상이나 좌우바뀜증(situs inversus), 십이지장 폐쇄증 등의 다른 선천적 이상과 동반되는 경우가 더 흔하다[29]. 완전 폐색을 일으키면 신생아기에 구토나 수유를 못하는 증상으로 대부분 발생하지만, 부분 폐색의 경우 반복적인 구토와 발달 지연 등이 수개월 내지 수년 지속되기도 한다[30]. 십이지장 폐색을 유발하는 십이지장 앞 문맥은 수술적 치료를 요한다[30].
2. 비폐색성 질환
십이지장 병변의 폐색 유발은 병변의 크기와 정도에 따르며 대체적으로 초기에는 폐색이 없는 상태로 발견될 수 있는 질환들이 여기에 포함된다. 십이지장 중복낭(duodenal duplication cyst), 십이지장 역위(duodenal inversion), 십이지장 장관내 게실(duodenal intraluminal diverticulum) 등을 들 수 있다.
1) 십이지장 중복낭
십이지장 중복낭은 발생이 드문 편으로 전체 소화관 중복낭의 2~12%를 차지한다[3,31,32]. 발생 기전은 한 가지 가설로 명확히 설명되지 않아 재개통(recanalization) 과정의 이상, 혈관 손상(vascular insult), 배아기 게실(embryonic diverticuli)의 지속 등이 제시되고 있다[3,31,33]. 조직학적으로 위장관 점막, 점막하층, 고유근층과 장신경층으로 구성되는데, 점막은 반드시 십이지장 점막일 필요는 없으며, 위, 췌장, 호흡기 상피로 구성될 수 있다[31,32]. 크기는 다양하고, 모양은 구형의 낭성(cystic) 혹은 관강(tubular) 구조로, 낭성 형태가 80%로 보고된다. 대부분 십이지장 제1, 2부위의 장간막측에 위치하며 인접 소화관과 통해 있지 않은(noncommunicating) 형태가 통해 있는(communicating) 형태보다 흔하다[2-4,31,34].
Chen 등[32]은 문헌 고찰을 통해 47예의 십이지장 중복낭을 분석하여 임상적 특징을 보고한 바 있다. 남녀의 성별 차이에 따른 발생 빈도 차이는 없었으며, 증상 발생 나이는 신생아에서 72세까지 다양하지만, 19명(40.4%)은 10세 이전에, 10명(21.3%)은 10~20세 사이에 발병하였다. 일부 환자들은 성인이 될 때까지 무증상이었으며, 38%가 20세 이후에 진단되었다. 임상 증상은 병변의 크기와 주변 장기와의 관계, 내부 상피의 종류에 따라 다르게 나타난다. 크기가 큰 중복낭은 내부에 분비물이 고이고 점차 늘어나서 종괴 효과에 의한 폐쇄성 증상을 일으킬 수 있고, 위 상피로 둘러싸이고 인접 소화관과 교통이 있는 십이지장 중복낭은 궤양에 의한 출혈이나 천공을 일으킬 수 있다[3,31]. 그 외에도 만성 복통, 구역이나 구토, 복부 종괴, 체중 감소, 장중첩증 등의 증상을 일으킬 수 있다[3,31]. Chen 등[32]의 보고에서는 복통이 가장 흔해 80%에서 관찰되었으며, 췌장염 53%, 구역 구토 43%, 담즙정체 42% 등으로 관찰되었다. 이외에 장중첩증, 위장관 출혈, 낭종 감염, 체중 감소, 천명음 발생 등이 동반되었다. 췌장염이 가장 흔히 보고되는 합병증인데, 그 발생 기전으로는 중복낭에 의해 주 유두의 일시적인 십이지장 운동성 관련 유출장애 발생, 직접적인 담관이나 췌관의 압박 등이 제시되고 있다[32]. 또한 중복낭 안의 담즙 슬러지 혹은 미세결석, 점액물질, 혈액 등이 이동하여 췌관 폐색을 일으킬 수 있다[32,33]. 중복낭의 크기는 약 절반 가량이 2~4 cm였으나, 최대 13 cm 까지 보고되었다. 드물지만 십이지장 중복낭에서 선암이나 신경내분비 종양 같은 악성 종양의 발생을 보고한 문헌도 있었다[35-37].
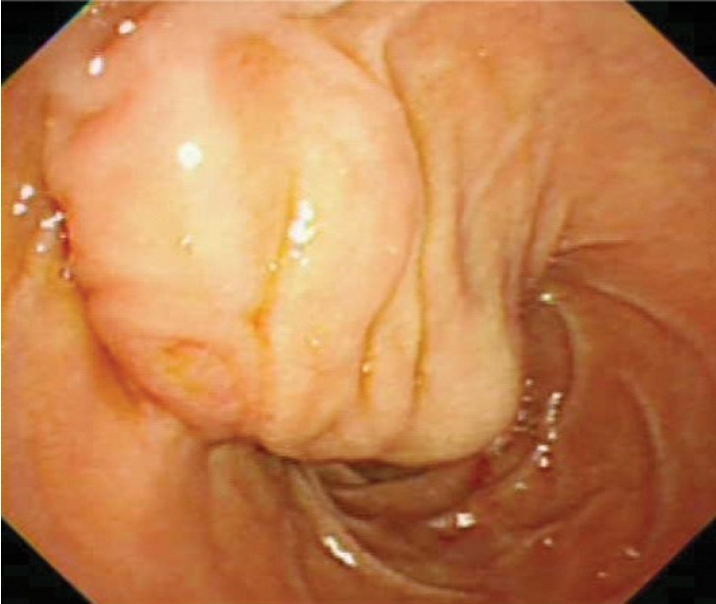
진찰 소견이나 단순 복부 촬영에서는 대개 별다른 이상이 없으므로[32] 십이지장 중복낭이 의심이 되면 복부 초음파, CT, MRI 등이 진단에 이용될 수 있다[32-34]. 초음파에서는 무에코의, 연동운동이 있는 이중벽(double wall sign)의 낭종이 특징적이다[33]. 초음파내시경에서는 3~5층의 벽을 가진 장 기원의 낭종으로 보이며, 낭종의 고유근층은 십이지장의 고유근층과 연속되어 있다[34]. 고에코의 안쪽 점막층과 저에코의 바깥 근육층이 관찰될 수 있다. 십이지장 중복낭 진단에 있어서 초음파내시경을 이용한 세침흡인술의 유용성은 아직까지는 연구된 바가 없다[34]. 조영증강 컴퓨터단층촬영이나 자기공명영상을 통해 병변의 위치와 크기, 인접 췌담도계와의 연관성 등을 알 수 있으며, 주로 경계가 명확하고, 액체로 채워진 구조로 관찰된다[33]. 자기공명쓸개이자조영술 혹은 내시경역행쓸개이자조영술은 담도나 췌관과의 연결성을 확인하는 데 유용하다[32,33]. 내시경 검사에서는 정상 점막으로 덮힌 상피하 병변의 모양을 흔히 보인다(Fig. 2).
감별진단은 십이지장이나 췌담도 주위에 발생하는 가성낭종이나 낭성 종양들이며, 특히 Todani III형의 총담관낭(choledochal cyst)과의 감별이 어려울 수 있는데, 십이지장 중복낭은 정상 십이지장벽으로, 총담관낭은 담도 혹은 담낭의 상피로 구성되어 있고 평활근 층이 없으므로 최종 진단은 병리학적으로 가능하다[32]. 드문 질환이고 초음파와 복부 컴퓨터단층촬영의 위음성률이 각각 23%와 9%로 높아[32] 수술 전 정확한 진단이 어렵기 때문에 수술 이후 병리 결과에 의해서 진단되기도 한다[32,33].
복통, 구역, 구토 등의 증상이나 담도 폐색, 췌장염, 위장관 출혈 등의 합병증을 유발한 십이지장 중복낭에는 전통적으로 수술적 치료를 해 왔다[32-34]. 수술을 통한 중복낭의 완전 절제는 증상을 없애고 재발을 막아준다. 병변의 크기와 위치, 주변 해부학적 구조물과의 연관성에 따라 수술 방법이 달라지는데, 췌장 두부나 담도와 밀접한 경우는 췌장-십이지장 절제술 같은 광범위한 절제가 필요한 경우도 있어 수술에 따른 부담이나 합병증 위험이 커질 수 있다[33,34]. 이런 이유로 인해 유두 절개도, 괄약근 절개도, 절제용 올가미 등의 다양한 도구를 사용하여 내시경적으로 절제 혹은 절개하는 개창술(marsupialization)로 병변 내 감압을 유도하는 시도들이 근래에 점점 많아지고 있으며, 성인뿐 아니라 소아에서도 성공적인 치료 결과들을 보여주고 있다[33,38,39]. 내시경 시술은 수술로 인한 합병증과 수술 흉터가 없고, 시술 이후 통증이 적고 입원 기간이 짧아진다는 장점이 있지만, 내시경 치료를 시행한다면 반드시 시술 실패 시 수술적 치료가 필요할 수 있음을 반드시 고려해야 한다[38]. 저자들은 문헌 고찰을 통해 십이지장 중복낭에 대해 내시경 치료를 시행했던 영어와 국문 문헌 27건에 소개된 37예[38-64]를 분석하여 임상적 특징 및 내시경 치료 방법 및 결과를 Table 1에 정리하였다. 유두 절개도와 괄약근 절개도를 이용한 낭종의 절개 혹은 절제 방법이 가장 많이 이용되었고, 지혈 가능한 출혈 이외의 심각한 부작용은 보고되지 않았다. Antaki 등[51]은 8명의 십이지장 중복낭 환자를 내시경으로 치료한 경험을 보고하였으며, 모두 중대한 합병증 없이 성공적으로 치료 가능하였고, 5~160개월까지 추적 관찰하였을 때 재발의 보고는 없었다. 또한 Romeo 등[65]은 6명의 소아 십이지장 중복낭 환자에서 수술적 치료(2명)와 내시경 치료(4명) 성적을 보고하였고, 내시경 치료가 수술적 치료에 비해 치료시간과 재원 일수를 단축시킬 수 있었으며, 안전하고 효과적인 치료 방법이라고 주장하였다. 그러나 십이지장 중복낭에서 암 발생의 가능성이 있고 재발 등의 장기적 예후가 충분히 알려져 있지 않아 수술적 치료가 가장 적절하다는 주장도 있다[66]. 따라서 십이지장 중복낭 환자에서 치료 방법의 선택은 환자의 기저 질환, 병변의 해부학적 위치와 임상 양상, 내시경 접근의 용이성 등을 고려해 결정해야 하며, 내시경 치료를 한 이후에도 장기적인 추적 관찰이 필요하겠다.
2) 십이지장 역위
십이지장 역위는 십이지장의 3부위가 Treitz 인대를 향해 왼쪽으로 내려가지 않고 역방향인 후상방으로 주행하는 선천적 이상이다(Fig. 1C) [67]. 발생이 매우 드물어 1950년 이래로 20예 이하의 보고가 있고, 발생 기전은 정확히 알려져 있지 않다[68]. 대체로 성인에서 발견되며 복통, 구역, 복부 팽만 등의 비특이적 증상을 일으키지만 드물게는 근위부 십이지장 폐색을 일으킬 수 있고, 고리췌장이나 불완전 회전 등의 다른 이상과 동반될 수 있다[68]. 십이지장 폐색이 없는 십이지장 역위는 대부분 궤양 치료제나 진경제를 투여하며 십이지장 폐색이 동반된 경우는 수술을 시행한다[68].
3) 십이지장 장관내 게실
십이지장은 소화기관에서 대장 다음으로 게실이 호발하는 부위로 알려져 있다[69]. 십이지장 게실은 근육층에 결손이 생겨 점막과 점막하층이 빠져나가 발생하는 후천적 장관외(extraluminal) 게실, 선천적으로 발생하는 장관내 게실로 나눌 수 있는데, 전자가 대부분을 차지하고 후자는 매우 드물다[69]. 선천성 십이지장 장관내 게실은 십이지장 내강 안으로 장갑의 손가락 부위처럼 길게 돌출된 병변으로 관찰되는데, 상피하 종양처럼 보이지만 근위부에 입구가 있고 출구 없이 게실낭이 점막하층에 위치하는 형태이다. 발생 기전은 십이지장 물갈퀴막이 있다가 점차적으로 기계적 연동운동에 의해 연장되는 것으로 생각된다[70,71]. 비특이적인 복통이나 구역, 구토 이외에 간헐적인 십이지장 부분 폐색, 급성 췌장염, 위장관 출혈, 드물게는 급성 담관염을 일으킬 수 있으며 대부분 30~50세의 성인에서 발생하였다[69-71]. 내시경을 통해 십이지장 점막으로 구성된 막힌 주머니(blind pouch)를 관찰할 수 있으며 상부위장관조영술을 통해 장관내 바륨으로 둘러싸인 주머니 구조를 관찰할 수 있다[69]. 증상이 발생한 경우 우선적으로 내시경 치료를 고려할 수 있고, 실패하거나 불가능한 경우 십이지장 절개와 게실 절제술을 시행할 수 있다[69].
결 론
십이지장 폐쇄증, 물갈퀴막, 윤상 췌장, 중간창자 꼬임, 십이지장 앞 문맥, 중복낭, 십이지장 역위, 십이지장 관강내 게실 등의 해부학적 질환들은 발생 원인이 명확히 알려져 있지는 않지만, 대부분 태아기 발생 단계의 이상에서 기원할 것으로 생각된다. 따라서 대부분 소아기에 증상이 나타나지만 청소년기나 성인이 되어 증상이 발생하기도 한다. 발생 빈도가 높지 않아 임상에서 자주 마주치지는 않겠지만 이러한 질환들의 임상 양상과 영상학적 특징에 대하여 알아 두고, 의심되는 환자가 있을 시 복부 CT, MRI, 자기공명쓸개이자조영술, 내시경역행쓸개이자조영술, 초음파내시경 등의 검사를 통하여 정확히 진단해 내는 것이 중요하겠다. 과거에는 수술적 치료가 주를 이루었으나 해부학적으로 췌담도 주요 구조물들과 인접하여 수술의 범위가 넓어질 수 있고 수술로 인한 이환율 및 합병증이 우려될 수 있어 다양한 내시경 치료들이 성공적으로 시도되고 있다. 그러나 내시경 치료의 장기적인 예후에 관한 연구 결과가 아직은 부족한 실정으로, 환자의 상태와 병변의 특징에 따라 적절한 치료법을 신중히 선택해야 할 것이다.
Acknowledgements
This work was supported by the 2022 education, research and student guidance grant funded by Jeju National University.
Notes
No potential conflict of interest relevant to this article was reported.