Proton Pump Inhibitor 사용과 위암
Proton Pump Inhibitors and Gastric Cancer
Article information
Trans Abstract
Concerns have been raised regarding the long-term use of proton pump inhibitors (PPIs) as an important risk factor for gastric cancer in clinical practice. PPIs can cause hypergastrinemia at clinical doses, and hypergastrinemia has been reported to induce malignant neoplasms in the stomach in previous animal studies. In humans, the proliferation of enterochromaffin-like (ECL) cells induced by hypergastrinemia is suspected as a potential mechanism of gastric cancer. Meanwhile, persistent Helicobacter pylori (H. pylori) infection causes gastric atrophic change, which itself is a major cause of gastric cancer, and it can further increase the risk of gastric cancer by strengthening corpus atrophy through interaction with PPIs. Recent epidemiologic studies have reported an important link between long-term PPI intake and gastric cancer risk even after successful eradication of H. pylori. However, due to the methodological limitations of observational clinical studies, the causal relationship is still not clear, and a recent big data-based study reported that long-term PPI use was not related to gastric cancer incidence. Taken together, despite the potential detrimental effects of PPIs, it is currently difficult to draw a definite conclusion about its association with gastric cancer. To minimize the possibility of gastric cancer in H. pylori-infected patients or precancerous lesions in long-term PPI users, long-term PPI administration should be limited to the minimum effective dose, and antibacterial treatment for H. pylori should be considered.
서 론
Proton pump inhibitor (PPI)는 1980년대 말 소개된 이래로 위산 분비와 관련된 광범위한 질환에 대한 가장 효과적인 치료제로 전 세계에서 가장 널리 쓰이는 약제이다[1]. PPI는 강력한 산 억제제 중 하나로서 벽세포의 H+/K+ ATPase를 차단하여 작용하며 위식도역류질환, 소화성 궤양질환, Helicobacter pylori (H. pylori) 감염, 소화불량을 포함하는 상부위장관질환의 치료에 기초가 되었다[1]. PPI의 장기간 사용은 식도 협착과 같은 심각한 합병증을 보이는 위식도역류질환의 관리를 용이하게 할 수 있으며, 실제로는 PPI의 장기 처방이 단순 위식도역류 질환을 가진 환자에게도 유지 요법으로 선호되는 경우가 많다[2]. 그러나 이러한 명성과 함께 PPI의 장기간 사용에 따른 합병증의 목록 역시 점차 증가되었다. 최근의 연구에서 장기간의 PPI 사용이 골절, Clostridium difficile 감염, 폐렴, 심근경색, 뇌졸중, 신장 손상을 포함하는 수많은 부작용과 관련이 있다는 것이 제시되었다[3-6]. 그러나 많은 부분에서 PPI와의 관련성은 혼란변수들의 존재와 상세 기전에 대한 불충분한 설명으로 인해 명확한 근거에 기초하고 있지 않으며, 관찰 연구의 한계점으로 인해 논란의 여지가 있었다.
한편, PPI의 장기 사용이 위암 발생을 증가시킬 것이라는 우려가 제기되어 왔다. 최근의 역학 연구에서 H. pylori를 성공적으로 제균한 후에도 장기적인 PPI 복용과 위암 발생 사이에 중요한 연관성이 있다고 보고하였다[7]. H. pylori 감염과 별개로 PPI의 사용은 위점막의 위축성 변화(gastric atrophy)의 잠재적 위험인자가 될 수 있다[8,9]. 위산 억제와 함께 PPI는 고가스트린혈증(hypergastrinemia), enterochromaffin-like (ECL) 세포의 증식을 포함하는 위 내부 환경의 변화를 유도할 수 있다[8,10]. 즉, PPI는 위점막의 위축성 변화를 악화시키고 위암의 위험을 증가시킬 수 있다는 논란이 꾸준히 제기되어 왔다[11]. 이러한 경향을 반영하여 최근 전문가 의견은 장기 PPI의 투여량을 주기적으로 재평가해야 하며 가능한 가장 낮은 유효량을 처방해야 한다고 제안하였다[12]. 본 리뷰에서는 위암 발생에서 PPI의 역할에 대해 검토해 보고자 한다.
본 론
1. PPI의 잠재적 발암 기전
PPI와 위암 사이의 관계를 설명하는 몇 가지 기전이 있다. 강력한 산 억제는 고가스트린혈증을 동반한 위점막 내 분비선(gland)의 위축성 변화와 위 내 박테리아 과다성장에 의해 위암의 위험인자로서 오랜 기간 의심받아 왔다. 설치류를 이용한 연구에서 omeprazole [13] 및 H2-receptor antagonist (H2RA)인 loxtidine [14,15]에 의한 산 억제가 위 점막의 신생물을 유도하는 것을 시사하였다. 장기간의 고가스트린혈증 후 위 신경내분비종양이 발생한다는 보고가 있으며[16] 사람에서도 지난 수십 년간 신경내분비종양의 유병률이 증가해왔고[17] 이것은 위산 분비 억제제의 사용 증가와 관련이 있을 수 있다. 그러나 아직까지 인간에서의 증거는 논란의 여지가 있다[18,19]. 이에 본 저자들은 위암 발생에 PPI의 발암 효과의 추정 기전들을 살펴보고자 한다.
1) 고가스트린혈증
장기 PPI 사용과 위암 발생 사이의 관계를 설명하는 가장 널리 알려진 가설은 위산의 분비가 감소하면서 발생한 고가스트린혈증에 의한다는 가설이다[8,20]. PPI에 의해서 감소된 산도는 차례로 위 콜레시스토키닌-2 수용체를 발현하고 oxyntic mucosa에서 가스트린의 표적 세포인 ECL 세포의 증식을 유발한다[21]. 이는 벽세포의 증식과 비대라는 구조적 변화를 동반하며[22] 장기간 PPI 치료를 받는 환자에게서 가장 흔히 나타난다[8,23]. 한 연구에서는 정상적인 위산 분비의 차단으로 인해 조직병리학적 변화가 발생하여 위 점막의 과다 증식을 유발할 수 있는 고가스트린혈증, 만성 저염소증, 만성 염증 및 정상점막 gland의 소실과 위축성 위염, 장상피화생이 일어나게 된다고 주장하였다[24].
이전 동물 연구 결과 설치류에서 위산 분비의 과도한 억제가 위암을 유발한다는 것을 보였는데[13,15], 고가스트린혈증으로 인한 이차적인 자극이 ECL 세포의 증식으로 이어지며 이것이 발암 효과의 일반적인 기전으로 받아들여졌다[13,14,16]. 또한 이전 연구에서 선암의 일부가 ECL 세포에서 유래하였다는 것을 발견한 바 있으며[25,26] 특히 위암 중 미만형 위암의 signet ring cell subtype에서 높은 비율로 신경내분비/ECL 세포 마커가 발현되므로 이는 ECL 세포에서 암세포가 유래되었을 가능성을 시사한다고 볼 수 있다[26-28]. 그러나 만성 역류성 식도염 환자에서 장기 PPI 사용의 효용성과 안정성을 평가하기 위해 수술적 치료 그룹을 대조군으로 하여 무작위 배정으로 시행된 2개의 연구를 살펴보면, 두 연구 모두 PPI 투약 환자군을 추적한 첫해에는 가스트린 수치가 증가하였지만 이후에는 안정화되는 것이 관찰되었고 최소 5년에서 최장 12년까지 추적하였을 때 PPI의 장기 투약과 위암 발생과의 관련성은 관찰되지 않았다. 저자들은 인간에서 동물실험에서 밝혀진 것보다 임상적으로 현저한 ECL 세포의 증식이 드문 것은 혈청 가스트린 수준이 동물실험에서 암컷 쥐에서 보고된 것보다 10배 이상 낮고 표적 내분비 세포의 민감도 측면에서도 종간 차이가 있다는 것을 반영한다고 주장하였다[29].
한편, 장기간 PPI를 사용한 일부 환자들에서 낭성 선(cystic gland)의 발달로 인한 위저선 용종(fundic gland polyp, FGP)이 종종 발생한다[30]. FGP는 일반 인구의 2% 정도에서 발견되나 장기적으로 PPI를 사용하는 환자에서는 2~4배 더 자주 발견되며 FGP와 PPI 노출 기간 사이에는 양의 상관관계가 있다는 보고들이 있다[31,32]. 메타분석을 통한 systemic review에서는 FGP가 발생하려면 최소 12개월은 PPI를 사용해야 한다고 주장하였다[19]. 그러나 PPI 관련 FGP는 위암으로 발전하지 않으며, PPI의 사용과 상관 없이 가족성으로 β-catenin의 유전적 변이를 동반할 때에 악성화 진행의 위험이 있다고 보고하였다[33,34].
2) H. pylori 감염과의 상호작용
H. pylori는 전형적으로 위 전정부에서 군집화하고 대부분의 감염자들에서 전정부 우세의 위염(antrum-predominant gastritis)을 야기한다[35-37]. 전정부 점막의 염증은 위산 분비를 자극하여 정상 혹은 고산의 환경을 유지한다. 그러나 장기간 PPI의 사용으로 산 분비 억제가 지속되면 벽세포 기능의 손상으로 위염의 패턴이 체부 우세(corpus-predominant gastritis)로 전환된다. 이 현상은 H. pylori 음성의 환자들에서는 발생하지 않는다[35]. PPI의 산 억제 효과는 H. pylori에 의한 체부 위염에 의해 한층 더 강화되는 것으로 보인다[38,39]. 장시간 동안 이러한 과정은 oxyntic gland의 소실을 가속화하고 위축성 위염을 발달시키며 산 분비를 손상시키고 위 내에 다른 박테리아에 의한 군집화(주로 구강 세균)와 위 호르몬의 조절 장애를 유발한다[35,40]. 한 코호트 연구에서 5년의 추적 기간 동안 PPI로 치료받은 역류성 식도염 환자 105명 중 위축성 위염은 H. pylori에 감염된 경우에 유의미하게 높은 유병률을 보였고, H. pylori 음성 환자에서는 거의 발생하지 않았다(유병률 31% vs. 4%) [41]. 16개 연구에 포함된 총 1,920명의 환자를 대상으로한 메타분석 연구에서도 체부 위축의 위험은 H. pylori 양성인 경우에 H. pylori 음성인 경우보다 더 높았다(상대위험도[OR], 11.45; 95% CI, 6.25~20.99) [8]. 이러한 근거를 토대로 European Maastricht V/Florence consensus report는 장기 PPI 치료가 요구되는 환자들에서 H. pylori 감염으로 인해 위 점막 이상의 발전과 위축성 위염이 진행하는 것을 예방하기 위해 H. pylori 제균 치료를 권고하였다[42].
3) H. pylori 외 다른 세균의 과성장
PPI에 의한 위산 분비의 억제는 세균에 대항하는 생리적 방어 기전을 약화시킬 수 있고[43] 만성 염증을 악화시킬 수 있는 위 내의 non-H. pylori 세균의 과성장을 유발할 있다[44]. 예를 들면 설사는 잘 알려진 PPI의 부작용인데 이것은 종종 C. difficile, non-typhoid Salmonella species 혹은 Campylobacter jejuni와 같은 박테리아 감염에 기인한다고 알려져 있다[43]. 위 내의 산도가 감소하여 pH가 상승하면 위 외에서 상재하는 미생물을 포함하여 위 내부의 증가된 세균총의 군집화로 이어지고, 이는 음식의 질산염으로부터 위암 발암물질로 알려진 N-니트로소 화합물(N-nitroso compounds)을 생산하는 질산염 환원 효소를 보유하는 비위 미생물(주로 구강 세균)을 포함한 박테리아에 더 많이 노출될 수 있음을 의미한다[45,46]. 또한 이전 연구에서 H. pylori 외 세균총의 과성장 역시 위축성 위염의 위험인자이며 H. pylori와 non-H. pylori 세균의 동시 감염은 cytokine (interleukin [IL]-1, IL-8)의 수치를 상승시키고 위축성 위염의 위험을 증가시키는 시너지 효과를 가진다고 주장하였다[47].
2. PPI와 위암 사이의 관계에 대한 임상 연구들
이전 연구 중 PPI를 장기간 사용하여도 비교적 안전하다는 연구들은 대부분 추적 기간이 상대적으로 짧았고 대상 환자수도 상대적으로 적었다[48,49]. PPI와 전암성 위 병변을 평가하기 위한 무작위 임상시험에 기초한 두 개의 메타분석이 있는데[24,50] 후속 연구 기간이 짧아 PPI와 위암 사이의 관계를 제대로 밝혀낼 수 없었다. Song 등[24]의 연구는 포함된 7개의 무작위 임상시험 연구에서 총 1,789명의 환자에 대해 분석하였고 6개월 이상 PPI를 투여한 군과 대조군으로는 치료를 받지 않았거나 수술 혹은 내시경적 치료를 받은 경우, 혹은 다른 종류의 제산제 치료를 받은 경우를 비교하였다. 각 무작위 임상시험은 PPI 유지가 위축성 위염, 장상피 화생, ECL 세포의 증식을 포함하는 전암성 병변에 미치는 영향을 확인하는 기간이 상이하였고 대부분 6개월, 12개월로 짧았으며 가장 긴 경우도 5년에 불과하였기 때문에 장기 PPI 사용이 전암성 병변의 발생 위험을 높이는지 명확한 결론을 도출할 수 없었다. 또한 포함된 연구의 수가 적어 계획하였던 하위그룹 분석을 시행하지 못한 경우가 많았으며 대부분의 연구에서 H. pylori 감염 상태라는 주요 교란요인이 누락되었다는 한계점이 있었다. 또 다른 메타분석[50]에서는 6개의 무작위 임상시험에서 785명의 환자를 포함하였는데, 역시 포함된 연구들의 추적 기간이 짧아 최소 12개월이라고 기간에 제한을 두고 장기 PPI 투여가 전암성 병변의 발생과 관련성이 없다고 주장하였다. 그러나 최근에는 잘 디자인된 전자의료기록 데이터베이스를 이용한 총 218,196명을 대상으로 한 빅데이터 연구 결과가 발표되었는데 PPI 용량, 사용 기간별로 위장관 암 위험도를 평가하였을 때 2년 이상의 PPI 사용과 위, 대장, 간, 췌장암의 위험도 사이에 관계가 없음을 보고하였다[51]. 이 연구에서는 각 암과 관련된 잠재적 혼란요인을 사전에 평가하였고 위암의 경우, H. pylori 감염 상태, 전암성 병변들, 소화성 궤양질환 등을 포함하였으며 PPI 노출을 2년 이상으로 정의하여 적응증에 의한 혼란 역시 최소화하였다는 강점이 있다. 위암 발병 위험이 높은 우리나라에서 국민건강보험 데이터베이스를 활용하여 PPI 혹은 H2RA의 사용과 위암 위험을 분석한 연구[52]를 살펴보면 H2RA 사용자와 비교할 때 PPI 사용자의 위암 발생률이 크게 다르지 않았다(조정된 위험비율 [adjusted hazard ratio], 1.01; 95% CI, 0.88~1.16; P=0.89). 민감도 분석에서도 두 군 간에 위암 발병률에 차이가 없음이 확인되었다.
PPI 사용자에서 FGP 또는 위암 발생 위험도를 관찰한 12개의 연구를 포함한 메타분석 연구에서, 위암 발생률을 본 1개의 코호트 연구와 3개의 관찰 연구에 대한 위암 위험도(pooled risk ratio)는 1.43 (95% CI, 1.23~1.66)으로 PPI가 위암 발생 위험을 높이는 것과 관련이 있었다[19]. 그러나 포함된 연구의 수가 적고 H. pylori 감염 상태, 식이 패턴, 위암 가족력 등 여러 교란요인이 누락되어 비뚤림을 피할 수 없었으며, PPI의 사용 기간에 따른 영향에서 일관성 없는 결과가 관찰되었다. 저자는 충분히 긴 기간 동안 추적한다면 PPI를 3년 이상 사용하는 경우에 PPI와 H. pylori 감염이 위암의 위험을 증가시키는 시너지 역할을 할 것이라고 주장하였다.
이전 연구의 제한점으로 우선 일부 연구[7,18,51]를 제외하면 대부분의 연구[53-55]에서 H. pylori 감염 상태 또는 제균 여부를 고려하지 않았다. H. pylori는 위암 발병에 가장 중요한 교란요인이므로 PPI와 위암 사이의 인과 관계 입증이 더욱 어려워졌다. 또한 García Rodríguez 등[53]의 연구만이 등록한 환자들에서 PPI 치료를 시작하게 된 원인질환별(위식도역류질환, 소화성 궤양질환 및 소화불량 등)로 위암 발생 위험을 분석하였고 다른 연구에서는 이러한 PPI 사용의 적응증에 따른 위암 발생 위험에 대해 분석하지 않았기 때문에 적응증 비뚤림이 발생하였을 수 있다. 한편 위암 진단 전 증상이 발생하면서 PPI를 사용하게되는 역인과관계(reverse causality)에 의한 비뚤림(protopathic bias)의 가능성도 있다.
이러한 제한점 중 가장 중요한 H. pylori라는 교란요인을 해결하기 위해 Cheung 등[7]은 H. pylori에 대해 제균 치료를 받은 환자에 대한 지역 전체의 후향적 코호트 연구를 시행하였다. 홍콩 건강 데이터베이스를 포함하는 이 대규모 인구기반 연구에서 저자는 clarithromycin 기반 3제요법이 처방된 63,000명 이상의 성인 환자를 등록하였고 연구 시작부터 6개월, 또는 H. pylori 제균 치료 후 12개월 이내에 위암을 진단받은 환자는 제외하였다. 7.6년의 중앙 관찰 기간 동안, PPI 사용(적어도 매주 1회 이상 사용으로 정의)은 위암 위험 증가와 관련이 있었다(위험비율[hazard ratio], 2.44; 95% CI, 1.42~4.20). 반면에 음성 대조군 노출로 사용된 H2RA는 암 위험 증가와 관련이 없었다. 이 연구는 H. pylori를 성공적으로 제균한 후에도 PPI를 장기간 사용하면 위암 위험이 증가한다는 점에서 중요하였다. 그러나 이 연구 역시 몇 가지 중요한 제한점이 존재한다. 첫째, 관찰 연구의 근본적인 한계로 인해 연령과 대사질환, 주요 동반 질환 등의 기본 특성이 PPI 사용군과 비사용군 사이에 유의하게 달랐다. 따라서 위암 발병과 관련된 위 위축, 짠 음식 섭취 또는 비만 등은 통계적으로 정교한 성향 점수 일치 후에도 PPI 사용자 그룹에서 더 자주 발생하였을 수 있다[56]. 둘째, 위점막 위축, 장상피화생과 같은 위암의 전암성 병변 여부가 포함되지 않았다[57]. 셋째, 저자는 처방 이력만으로 H. pylori 제균의 성공 여부를 판단하였으나 등록된 환자의 일부는 제균 치료 후에도 H. pylori 감염 상태가 지속되었을 수 있으며 따라서 H. pylori의 발암 효과가 완전히 제거되지 않을 수 있다.
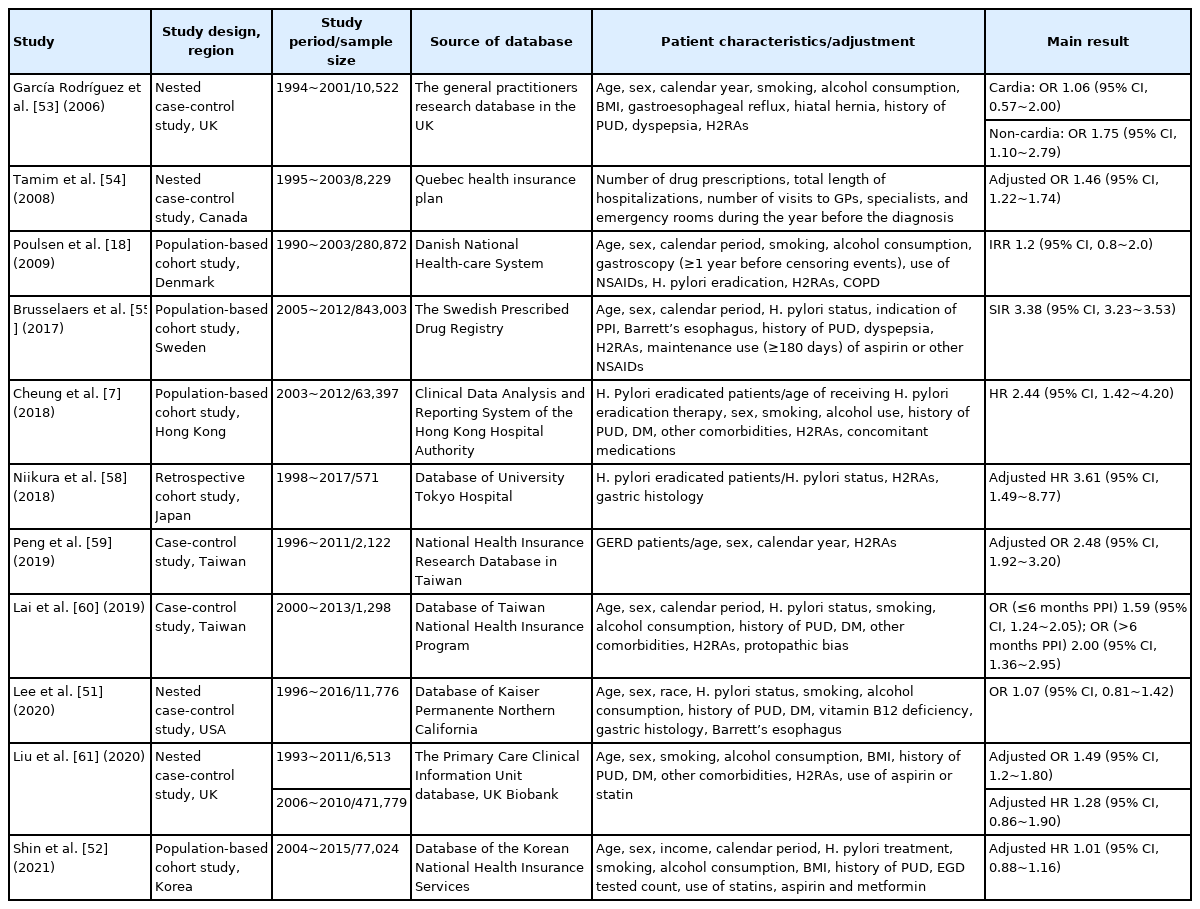
스웨덴 전국 인구기반 코호트 연구[55]에서는 797,067명의 PPI 유지 요법을 받고 있는 성인을 같은 기간 내 성별과 연령이 일치하는 대조군과 비교하였다. 위암의 표준화 발생비(standardized incidence ratio)는 3.38 (95% CI, 3.23~3.53)이었고 성별, 연령, PPI에 대한 적응증, 아스피린 또는 non-steroidal anti-inflammatory drugs (NSAIDs)와 같은 항염증제의 병용 사용 및 유문부/비유문부 등의 위치에 관계 없이 일관되었다. 그러나 이 연구는 위암의 발생이 기간 의존적이지 않아 위암과 PPI의 장기 사용 사이의 인과 관계를 확립하지 못하였고, H. pylori 감염 여부가 포함되지 않았다. Table 1에 여러 관찰연구들의 특성 및 결과를 요약하였다.
결 론
그동안 임상에서 장기 PPI의 사용이 위암의 중요한 위험요소가 될 수 있다는 우려가 제기되어 왔으나 이러한 연관성을 입증할 수 있는 임상 연구를 실질적으로 수행하기 어려운 제한점이 있다. 그럼에도 그동안 여러 연구에서 장기간 PPI 사용과 위암 위험 사이에 중요한 관계가 있음을 보여왔다는 것은 무시할 수 없다. 비록 연구 설계의 한계와 몇 가지 주요 교란요인의 누락으로 인해 증거가 확정적이지 않고 충돌하는 데이터가 존재하지만 고가스트린혈증이 ECL 세포의 과증식을 유발하여 신경내분비종양의 발생을 유도하고 미만형 선암으로 발달할 수 있다는 가능성을 제시한 점, H. pylori 감염력이 있는 환자군에서 PPI 사용 시 체부 위축의 발생 비율이 현저히 높다는 점은 PPI와 위암과의 인과성에 대해 특히 재고해야 할 부분이다.
PPI의 잠재적인 유해한 영향에도 불구하고 PPI는 현재까지 소화성 궤양질환들, 위식도역류질환, 아스피린 및 NSAIDs 관련 상부위장관 출혈 예방에 가장 효과적인 치료법이다. 따라서 PPI의 이용을 비합리적으로 회피하기보다는 장기 사용과 관련된 잠재적인 부작용을 최소화하기 위해 치료 기간 내에 가능한 최저 유효 용량의 PPI를 사용하는 것이 권고된다. 적절한 시점에 H2RA와 같은 덜 강력한 산 억제제로의 단계적 낮춤도 고려해야 한다. 향후에는 장기간 PPI 사용이 필요한 경우에는 H. pylori 감염 상태를 확인하고 제균 치료도 고려해볼 수 있겠다.
Notes
No potential conflict of interest relevant to this article was reported.