양성자펌프억제제는 제균 치료에 영향을 줄 수 있는가?
Can Proton Pump Inhibitors Affect Helicobacter pylori Eradication Therapy?
Article information
[Related article:]
Helicobacter pylori (H. pylori)는 전 세계적으로 가장 흔한 박테리아 감염 중 하나이며, 위암을 포함한 만성 활동성 위염, 소화성 궤양, 점막관련림프조직(mucosa-associated lymphoid tissue) 림프종 등의 소화기 질환을 일으키는 위험인자로 알려져있다. 세계보건기구(World Health Organization) 산하의 국제암 연구 기관(International Agency for Research on Cancer)에서는 H. pylori를 위암의 1급 발암인자로 규정하였는데[1], 2018년 업데이트된 GLOBOCAN 보고에 따르면 우리나라는 2012년에 이어 인구 10만 명당 위암의 발생률이 남녀 모두 전세계에서 1위인 것으로 확인되어[2], 위암의 발생률을 감소시키기 위한 대책이 더욱 필요해진 상황이다. 위암의 발생을 감소시키기 위한 여러 방안들 중 임상에서 시행할 수 있는 대표적인 것으로는 H. pylori 제균 치료가 있다. 조기 위암이나 고도 선종(high grade adenoma)으로 내시경 점막하 박리술을 시행받은 환자들을 대상으로 제균 치료를 처방한 군과 위약을 처방한군을 비교한 국내 전향적 무작위 대조군 연구에서도 제균 치료군(7.2%)에서는 위약군(13.4%)에 비하여 이시성(metachronous)위암의 발생률이 유의하게 낮았음을 보고하여 이를 뒷받침하였다(hazard ratio, 0.50; 95% CI, 0.26~0.94; P=0.03)[3].
하지만 실제 임상에서 경험해보면 H. pylori 제균 치료 약제를 처방하는 것과 제균에 성공하는 것은 다른 문제라고 할 수 있다. 1998년 대한 Helicobacter 및 상부위장관 연구학회에서 H. pylori 의 진단과 치료에 대한 합의 도출을 발표한 이후로 지금까지 우리나라에서 H. pylori 에 대한 일차 치료법은 양성자펌프억제제(proton pump inhibitor, PPI)를 기반으로 한 표준 삼제요법을, 그리고 일차 치료에 실패한 경우에는 bismuth를 기반으로 한 사제요법을 권고하고 있다[4,5]. 그러나 표준삼제요법은 2000년대 들어 제균율이 의미 있게 감소하고 있으며[6], 이차 치료로 사용하는 사제요법의 경우에는 여전히 높은 제균율을 보이고 있기는 하나 연도별로 분석해보면 제균율이 통계적으로 감소하였다는 국내 보고도 있다[7].
H. pylori 의 제균율에 영향을 미치는 요인에는 여러 가지가 있겠지만 가장 중요한 원인들에는 제균 치료 약제에 대한 환자의 순응도와 H. pylori 가 가지고 있는 항생제 내성이 있다[7,8]. 그 외에도 약물유전학적 측면에서는 cytochrome P (CYP) 2C19유전형 차이가 H. pylori 제균 치료에 사용되는 PPI의 효과에 영향을 주는 것으로 알려져 있다. 우리가 사용하는 약물의 90%이상은 50여 개의 CYP 효소들 중 6개를 통하여 주로 대사되는데, 그중에서도 CYP2C19과 CYP3A4가 70% 이상을 관여한다[9]. CYP2C19 유전자는 대립유전자의 차이에 따라 약물 대사 속도가 달라지기 때문에, CYP2C19 유전형에 따른 표현형을 크게 4가지인 1) 지연대사형(poor metabolizer, PM), 2) 중간대사형(intermediate metabolizer, IM), 3) 신속대사형(extensive metabolizer, EM), 4) 초신속대사형(ultra-rapid metabolizer, UM)으로 나눈다[9]. 일반적으로 PM인 환자들은 약물의 대사 속도가 느리기 때문에 약물 부작용이 증가할 위험이 있고, 이와 반대로 EM인 환자들은 약물의 대사 속도가 빠르기 때문에 약물의 치료 효과가 감소할 여지가 있다.
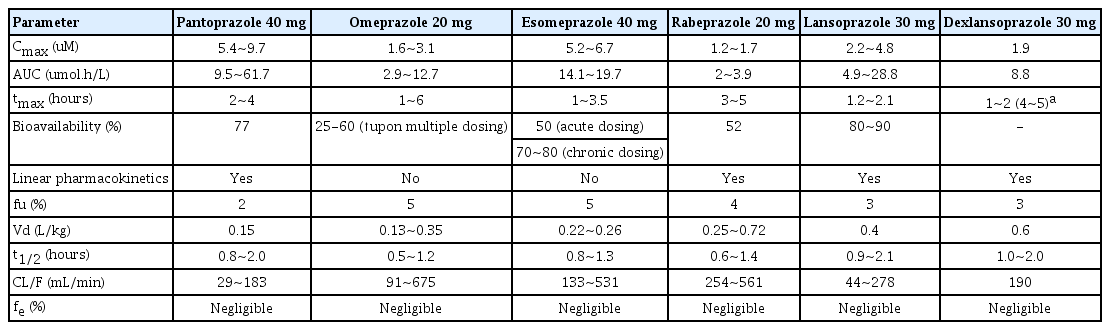
PPI 역시 대부분의 대사가 CYP2C19과 CYP3A4에서 이루어진다. 하지만 PPI의 종류에 따라 대사되는 경로의 비율이 다르고 CYP2C19에서 대사되는 다른 약물들과의 상호작용 여부도 차이가 있다. 예를 들어, CYP2C19의 대사 의존도가 가장 높은 PPI로 알려진 omeprazole은 CYP2C19을 통하여 대사되는 다른 약물들에도 영향을 주기 때문에 warfarin이나 clopidogrel 등의 심혈관계 약물을 복용하는 환자들에서는 사용함에 있어 주의가 필요하다. 하지만 rabeprazole의 경우에는 대부분의 대사가 CYP2C19이 아닌 경로(non-enzymatic pathway)로 이루어지기 때문에 여러 PPI들 중에서도 환자들의 CYP2C19유전형에 가장 영향을 적게 받으며, 다른 약물과의 상호작용도 적은 것으로 알려져 있다.
따라서, 환자들의 CYP2C19 표현형에 따른 제균율의 차이가 있는지 그리고 각각 다른 PPI를 사용하였을 때 CYP2C19 표현형에 따른 제균율은 어떻게 달라지는지 등에 대한 여러 연구들이 보고되고 있다. 그중에서도 20개의 연구를 대상으로 한 Zhao 등[10]의 메타분석 연구에서는 CYP2C19 표현형에 따라 제균율의 차이가 있음을 보고하였는데, 전체적으로는 PM군이 heterozygous EM군에 비하여 1.73배(P=0.002), homozygous EM군에 비해서는 2.79배(P<0.001) 제균율이 더 높은 것으로 나타났다. 그리고 PM군의 제균율이 통계적으로 의미 있게 높았던 omeprazole과 lansoprazole과는 달리 rabeprazole은 PM군, heterozygous EM군, homozygous EM군 사이에 통계적인 차이가 관찰되지 않아 CYP2C19 표현형에 영향을 덜 받는 PPI임을 보여주었다. 하지만 그 이후에 발표된 McNicholl 등[11]의 연구에서는 CYP2C19 표현형에 따른 제균율의 차이를 보여주지 못하였다. 그럼에도 불구하고, 2세대 PPI인 esomeprazole과 rabeprazole은 1세대 PPI인 omeprazole, lansoprazole, pantoprazole에 비하여 EM군에서 더 높은 제균율을 보여주어(OR, 1.37; 95% CI, 1.02~1.84), 2세대 PPI들이 1세대 PPI들에 비하여 제균 효과가 높을 것임을 시사하였다. 현재 사용되고 있는 PPI들의 약동학적 특성(pharmacokinetic property)을 정리하면 Table 1과 같다.
PPI의 효과와 관련하여, PPI를 식전에 투약하는 것은 식후에 투여하는 것에 비하여 위 내의 산도를 의미 있게 높이는 것으로 알려져 있다[12]. 따라서, 소화성 궤양이나 위식도역류질환 등의 치료에 있어서는 PPI를 식전에 투여할 것을 강력히 권고하고 있으나 제균 치료를 시행할 때에도 PPI를 식전 투여를 해야 하는지에 대해서는 고민해볼 수 있는 여지가 있다. 물론, 이론적으로 제균 치료의 효과만을 생각한다면 PPI를 식전에 투여하고 나머지 항생제를 식후에 따로 투여하는 것이 맞겠지만, 실제 임상에서는 PPI와 항생제를 같이 투여하는 것이 환자들의 순응도를 높일 수 있기 때문이다. 이를 확인하기 위하여 PPI를 식전 복용군, 식후 복용군으로 나누어 투여한 후 제균율을 평가한 국내 연구에서는 양 군 간에 제균율의 차이는 없는 것으로 보고하였으나(식전 72.5% vs. 식후 75.0%, P=0.719)[13], 이를 평가한 다른 연구는 거의 없는 실정이므로 향후 PPI 투약 시점과 연관된 추가적인 연구들이 필요하다.
이 외에도 제균율을 향상시키는 방법 중 하나로 위 내의 산도를 5.0 이상 높이는 것이 제안되었는데, 이는 위 내의 산도가 중성화될수록 항생제의 활성도 증가한다고 알려져 있기 때문이다. 2015년 일본에서 칼륨 경쟁적 위산분비억제제(potassium-competitive acid blocker, P-CAB)인 vonoprazan이 출시된 이후, PPI 대신이보다 더 강력히 위산 분비를 억제하는 P-CAB를 사용한 다수의 제균 치료 연구들이 시행되었다. 표준삼제요법에서 PPI와 P-CAB를 비교하였던 10개의 연구, 10,644명을 대상으로 시행한 메타분석 연구 결과, P-CAB를 사용한 군은 PPI를 사용한 군에 비하여 통계적으로 높은 제균율을 보여주었다(pooled risk ratio, 1.19; 95% CI, 1.15~1.24)[14]. 또한, 이차 제균 치료에서 PPI와 P-CAB를 비교한 16개의 연구를 대상으로 한 메타분석 연구에서도 P-CAB를 사용한 군은 PPI를 사용한 군에 비하여 제균율이 의미 있게 높은 것으로 나타나(OR, 1.51; 95% CI, 1.27~1.81)[15], 향후 제균 치료를 시행함에 있어 PPI 대신 P-CAB를 사용하는 것도 제균율을 높일 수 있는 방법이 될 것으로 생각된다.
지난 호에 실린 Kim 등[16]의 연구에서 저자들은 2009년 1월부터 2018년 12월까지 1차 제균 치료로 표준삼제요법을 시행 후 실패한 환자들 중 2차 제균 치료로 bismuth를 기반으로 한 사제요법을 받은 환자 675명을 대상으로 제균율을 확인하고, 환자들에게 처방한 PPI 종류가 1차와 2차 치료가 동일한 군과 1차와 2차 치료가 달라진 군을 비교하여 PPI 종류가 CYP2C19 유전자 다형성에 영향을 줄 수 있는지를 조사하였다. 연구 기간 동안 사제요법의 제균율은 80.4% (543/675)였고, 2009년부터 2013년까지에 비하여 2014년부터 2018년까지의 제균율이 통계적으로 감소하고 있음을 확인하였다(85.2% vs. 78.7%, P=0.03). 그중에서도 2013년부터 2018년까지 사제요법을 시행한 479명의 환자들이 처방받았던 PPI 종류를 분석하였는데, 1차와 2차 치료에 동일한 PPI를 사용한 군이 26.5% (127/479), 1차와 2차 치료에 다른 종류의 PPI를 사용한 군(PPI switching군)은 73.5% (352/479)였고, PPI switching군과 PPI switching을 하지 않은 군 사이의 제균율은 각각 81.0% (285/352)와 74.8% (95/127)로 양 군 사이에는 통계적인 차이가 없었다(P=0.14). 하지만 2차 제균 치료에 사용한 PPI들 중 rabeprazole 또는 esomeprazole로 PPI를 바꾸어 처방한 군과 PPI switching을 하지 않은 군을 비교하였을 때에는 rabeprazole 또는 esomeprazole PPI switching군의 제균율은 84.6% (143/169), PPI switching을 하지 않은 군에서는 76.5%(237/310)인 것으로 확인되어 rabeprazole 또는 esomeprazole PPI switching군의 제균율이 의미 있게 높은 것으로 나타났다(P=0.03). 따라서, 저자들은 2차 제균 치료를 시행하는 환자들에게 CYP2C19 표현형에 영향을 덜 받는 rabeprazole이나 esomeprazole로 PPI를 바꾸어 투여하는 것이 2차 제균 치료의 성공률을 높일 수 있는 방안이라고 제안하였다.
이번 연구는 CYP2C19 표현형에 영향을 받는 여러 PPI들을 이용하여 각각의 제균율을 비교한 연구였음에도 불구하고 환자들의 CYP2C19 표현형을 직접적으로 검사하지 않았다는 제한점이 있다. 하지만 실제 임상에서 모든 환자들을 대상으로 CYP2C19 표현형을 확인하는 것은 현실적으로 어렵다는 점을 감안한다면, CYP2C19 표현형에 영향이 적은 것으로 알려진 PPI들을 따로 분석하여 간접적으로 CYP2C19 표현형과의 연관성을 확인해보고, 이를 이용하여 향후 1차 제균 치료에 실패하고 2차 제균 치료를 시작하는 환자들에게는 2세대 이상의 PPI를 사용하는 것은 도움이 될 수도 있다는 근거를 제시하였다는 점에서는 주목할 만하다. 또한, 전체적인 제균율 측면에서는 2차 제균 치료로 시행하고 있는 bismuth 기반 사제요법의 제균율 역시 감소하고 있음을 다시 확인할 수 있어, 2차 사제요법이 실패한 환자들에 대한 대책을 마련하기 위한 노력이 필요할 것으로 생각된다. 향후 2차 제균 치료를 받아야 하는 환자들에게 다양한 항생제의 조합을 통한 제균 치료법뿐만 아니라 환자들의 CYP2C19 표현형까지 고려한 효과적인 맞춤 치료법과 같이 제균율을 높이기 위한 잘 디자인된 연구들이 가까운 시일내에 이루어지기를 기대해본다.
Notes
No potential conflict of interest relevant to this article was reported.