항암 치료 후 완치된 십이지장의 점막관련림프조직 림프종 1예
Duodenal Mucosa-associated Lymphoid Tissue Lymphoma Treated with Chemotherapy
Article information
Trans Abstract
Mucosa-associated lymphoid tissue (MALT) lymphomas most commonly occur in the stomach and rarely in the duodenum. Gastric MALT lymphoma is usually associated with Helicobacter pylori (H. pylori) infection that may be cured by eradication. However, duodenal MALT lymphoma is not associated with H. pylori infection. Moreover, the pathophysiology and treatment methods for duodenal MALT lymphoma have not yet been established because the disease is rare. Here, we report a case of duodenal MALT lymphoma. A 58-year-old man was treated for a refractory duodenal ulcer. Based on repeated biopsy, a diagnosis of MALT lymphoma was made. The patient achieved complete remission after chemotherapy and was followed up without recurrence for three years.
서 론
점막관련림프조직(mucosa-associated lymphoid tissue, MALT) 림프종은 점막연관 림프조직에서 발생하는 저등급 종양으로, 1983년 Isaacson과 Wright[1]에 의하여 처음으로 보고되었다. MALT 림프종은 위장관에서 가장 호발하는데, 50~60%는 위에서 발생하고 그 외 30% 미만에서 소장 및 대장에서 발생을 하며, 십이지장에서는 드물게 발생한다[2]. 위 MALT 림프종은 Helicobacter pylori (H. pylori) 감염에 의하여 CD4 림프구와 B 림프구가 위점막의 고유판에 축적이 되어 B 림프구 증식 및 림프소포를 형성하게 된다. 조직검사 및 면역화학검사를 통하여 진단할 수 있고 제균 치료가 치료의 핵심이다[3,4].
십이지장 MALT 림프종은 H. pylori 감염과 직접적인 관련이 없는 경우가 많아 제균 치료에 반응하지 않을 수 있으며, 아주 드물게 발병을 하기 때문에 병태생리 및 치료 방법에 대하여 정립된 바가 없는 실정이다[5]. 또한 십이지장 궤양은 조직학적 생검을 진행하지 않고 양성자펌프억제제(proton pump inhibitor)를 투여하는 것이 일반적이기 때문에 십이지장에서 발병한 궤양형 MALT 림프종은 진단하기가 쉽지 않다. 저자들은 십이지장 궤양으로 치료 중 반복적인 내시경 및 조직학적 생검을 시행하여 진단된 십이지장 MALT 림프종에 대하여 항암 치료를 하여 성공적으로 치료한 1예를 경험하여 문헌 고찰과 함께 보고하는 바이다.
증 례
58세 남자가 본원 외래에 내원하기 2년 6개월 전에 타 병원에서 만성 십이지장 궤양을 진단받고 양성자펌프억제제 약물 복용 중이었으나 호전이 없어 본원으로 의뢰되었다. 환자는 당뇨, 고혈압, 심근경색 병력을 가지고 있었으며 아스피린과 클로피도그렐을 복용 중이었다. 타 병원 상부위장관 내시경에서 십이지장 구부에 궤양 소견이 있었고(Fig. 1A), 조직검사를 시행하였으나 특이 소견이 없어 양성자펌프억제제로 판토프라졸(pantoprazole)을 복용하던 중이었다. 본원 외래에서 상부위장관 내시경을 재시행하였고 십이지장 구부 같은 부위에 지도상 궤양이 관찰되었다(Fig. 1B). 본원에서 시행한 조직검사에서 이상 소견은 보이지 않았다. 난치성 십이지장 궤양으로 생각되어 라베프라졸(rabeprazole)로 약물을 변경하며 복용하기로 하였다. 이후 5개월간 외래에서 라베프라졸을 복용하던 중에 흑색변을 주소로 응급실로 내원하였다. 응급실 내원 시 활력징후는 혈압 148/57 mmHg, 맥박 108회, 호흡수 18회/분, 체온은 37.1℃였다. 급성 병색을 보였고, 의식은 명료하였다. 신체 검진에서 결막이 창백하였고, 직장수지검사에서 흑색변이 관찰되었다. 말초혈액검사에서 백혈구수 83,700/mm3, 혈색소 9.4 g/dL, 혈소판수 175,000/mm3, 프로트롬빈시간 12.1초, 생화학검사에서 혈액요소질소 42.3 mg/dL, 크레아티닌 1.1 mg/dL였다.
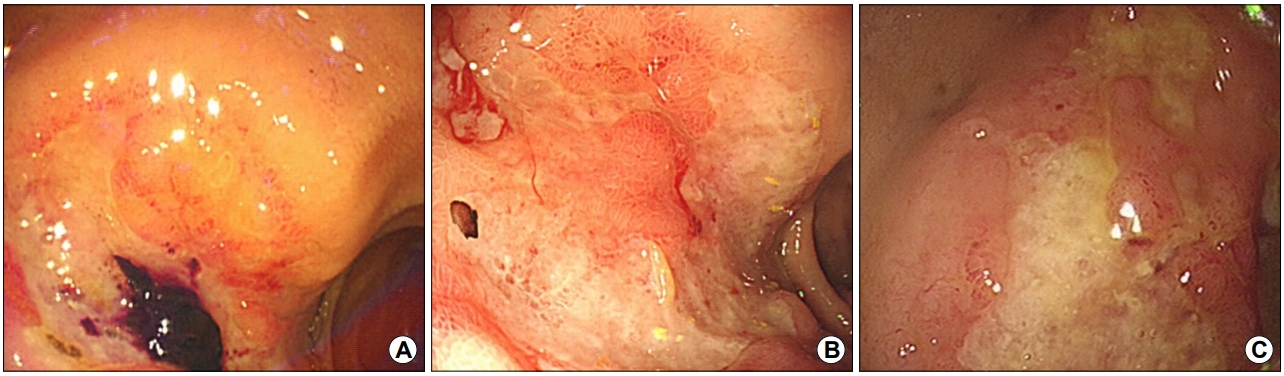
Endoscopic findings. (A) Initial endoscopy shows acute duodenal ulcer of Forrest IIb with an adherent blood clot at the bulb. (B) Proton pump inhibitor was administered, and follow-up endoscopy shows a refractory geographic duodenal ulcer. (C) Emergency endoscopy for melena shows slightly improved duodenal ulcers.
환자는 상부위장관 출혈을 감별하기 위하여 상부위장관 내시경을 시행하였고, 십이지장 구부에 지도상 궤양이 관찰되었으나 현성 출혈은 없었다. 이전에 외래에서 시행한 내시경 검사와 비교하여 호전된 양상이었다(Fig. 1C). H. pylori 감염 여부 확인을 위하여 위점막 조직검사를 시행하였으나 음성으로 나왔고 십이지장 조직검사에서는 만성 염증 소견 이외에 특이 소견은 없었다. 5일간 입원하여 금식, 양성자펌프억제제 정맥 투여 등 보존적인 치료 후 퇴원하였으며 외래 추적 관찰을 하였다.
환자는 이후에도 간헐적인 흑색변을 보았다고 하여 퇴원 3개월 뒤에 외래에서 상부위장관 내시경을 시행하였다. 이전과 동일한 위치에 십이지장 궤양이 전과 비교하여 악화된 소견이었다. 이에 대하여 추가적 검사로 시행한 복부 전산화단층촬영에서 십이지장 구부가 거대하게 비후되어 균질한 종괴 형태가 발견되었고(Fig. 2), 조직검사를 추가적으로 시행하였다. 검사 결과 점막층의 림프 상피성 병변이 관찰되었으며 CD20은 양성이었으나 CD3, bcl6, cyclin D1은 음성이었다(Fig. 3).
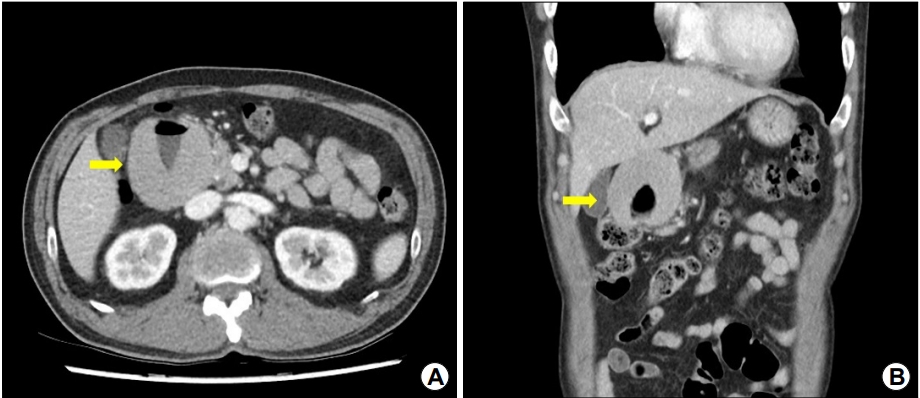
Abdominal CT shows massive wall thickening of the duodenal bulb with homogeneous enhancement. (A) Coronal section (yellow arrow) and (B) transverse section (yellow arrow).

Histopathologic examination of the endoscopic biopsy. (A) A dense infiltrate of mononuclear cells that are extensively involved with the duodenal mucosa (H&E, ×40). (B) The lymphoepithelial lesion can be seen (H&E, ×100). (C) Atypical lymphoid cells and monotonous proliferation of small mature lymphocytes are seen (H&E, ×400). (D) Immunohistochemistry for B-cell antigen CD20 shows strong positivity in most lymphocytes (Immunohistochemical stain, ×100).
조직 소견으로 MALT 림프종으로 진단하였고, PET-CT 및 골수검사를 진행하여 다른 장기에 침범이 없는 것을 확인하였다(Fig. 4). 십이지장에 국한되어 있고 타 장기에는 전이가 없어 병기는 IE에 해당하였으며, cyclophosphamide, adriamycin, vincristine, prednisolone을 6차까지 투여 후 완전 관해 되어 현재 3년째 재발 없이 외래 경과 관찰 중이다(Fig. 5).
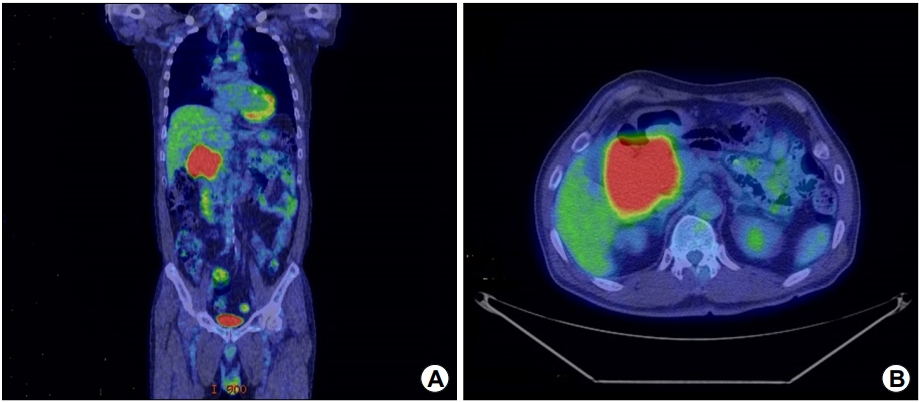
PET-CT shows increased fluorodeoxyglucose uptake in the duodenum only, suggesting duodenal lymphoma and no other organ invasion. (A) Coronal section and (B) transverse section.
고 찰
위장관의 원발성 림프종은 위에서 흔하게 발병하며 non-Hodgkin lymphoma의 4~12%를 차지하는 것으로 알려진다[2]. MALT 림프종은 위장관 림프종의 가장 흔한 조직학적 유형이다[4]. 위의 MALT 림프종의 내시경적 소견은 특징적인 것이 없이 다양하게 나타나는데 발적, 미란, 궤양을 동반하는 경우가 있고 미만성으로 침윤하기도 한다[5]. MALT 림프종은 조직학적으로 세 개 이상의 종양 세포가 위샘상피로 침윤하여 모여 있는 림프상피 병소(lymphoepithelial lesion)가 관찰되는 것이 특징이다[6,7].
십이지장 MALT 림프종은 드물게 발병하며 국내에서는 7예 만이 보고되고 있다(Table 1). 따라서 임상 양상, 자연 경과 및 치료에 대해서는 제한적으로 알려져 있다. 몇몇 증례에 따르면 무증상부터 시작하여 비전형적인 복통 및 흑색변 그리고 위출구 폐쇄(gastric outlet obstruction) 등의 증상을 일으킬 수 있다고 한다[5,8-13]. 소장에서 발생하는 MALT 림프종은 내시경에서 윤상주름(circular fold)의 소실, 조약돌 및 결절성 모양, 다수의 무경성 용종 형태, 궤양형 및 미만성 침윤 형태를 보일 수 있다. 십이지장 MALT 림프종도 이와 비슷할 수 있으며 실제로 내시경 소견에서 십이지장에 병변이 없었으나 무작위로 조직검사를 시행한 후 십이지장 MALT 림프종을 진단한 경우도 보고된 바가 있다[5,12].
위 MALT 림프종은 H. pylori 감염과 연관성이 있기 때문에 제균 치료로 완전 관해를 기대해볼 수 있다. 그러나 십이지장을 포함한 소장 MALT 림프종에 대한 치료 가이드라인은 정립되어 있지 않다[13]. 치료는 위와 같이 제균 치료를 하는 것, 수술적 절제, 항암 치료 및 방사선 치료로 나뉠 수가 있다[14]. 십이지장 MALT 림프종도 H. pylori가 십이지장에 있는 이소성 위점막이나 장상피화생 부위에 감염되어 발생한다는 가설이 있다. 그러나 실제로 십이지장의 조직검사에서 H. pylori 감염 증거 없이 십이지장 MALT 림프종이 보고되는 경우가 많다. 따라서 십이지장 MALT 림프종과 H. pylori 감염과의 연관성은 명확하지가 않다[13,15]. 하지만 위에서 H. pylori 감염이 확인되어 제균 치료 후에 십이지장 MALT 림프종이 완전 관해된 예도 보고된다. 이는 H. pylori 감염이 십이지장 MALT 림프종의 발생과 본질적인 관련성이 있을 수 있음을 시사한다[15]. 제균 치료 후에 성공적으로 반응할 수 있는 예측인자로는 림프절의 침범 여부 및 병변의 깊이가 있는데 내시경 초음파를 통하여 유용하게 알아낼 수 있다[16]. 또한 과거에는 대부분 수술적 절제를 시행하였으나[14] 지금까지 보고된 소장의 MALT 림프종은 천천히 진행을 하고 예후가 치명적이지 않았기 때문에 최근에는 침습적인 수술보다는 항암 치료와 같은 비수술적 치료가 선호되는 추세이다. 항암 치료제는 cyclophosphamide, vincristine, prednisolone 또는 cyclophosphamide, hydroxydaunomycin, oncovin, prednisolone을 투여할 수 있으며 CD20에 대한 rituximab을 병합하기도 한다[17-19].
십이지장 MALT 림프종은 드물게 발병을 하고 다양한 임상소견을 보여 쉽게 진단하기 어렵다. 이번 증례와 같이 양성자펌프억제제를 투여하여도 호전되지 않는 난치성 십이지장 궤양소견이 있을 때에는 십이지장 MALT 림프종을 의심해 보아야하고, 일차적인 조직검사에서 림프종이 진단되지 않더라도 추적 내시경 및 반복적인 조직검사가 필요하다.
Notes
No potential conflict of interest relevant to this article was reported.