난치성 소화성 궤양
Refractory Peptic Ulcer Disease
Article information
Trans Abstract
The eradication of Helicobacter pylori and the widespread use of effective antisecretory therapies, including proton pump inhibitors, have improved the management of peptic ulcer disease. However, in some patients, peptic ulcer disease is refractory to 8 to 12 weeks of standard antisecretory drug treatment. For refractory peptic ulcer disease, further evaluation of the risk factors and causes of refractory peptic ulcer disease, including patient risk factors and noncompliance (smoking, nonsteroidal anti-inflammatory drug use, and noncompliance with medical treatment), persistent H. pylori infection, and non-H. pylori-related factors (giant ulcer, gastrinoma, infections other thanH. pylori, and malignancy), is essential. The treatment should focus on the cause of the refractory peptic ulcer disease, avoiding smoking and nonsteroidal anti-inflammatory drug, the treatment of persistent H. pylori, use of high-dose proton pump inhibitors, or surgical excision of gastrinomas. Surgery should be considered in patients who are at high risk for complications and recurrent peptic ulcer disease despite medical treatment. In this review, I describe the diagnosis and treatment of refractory peptic ulcer disease.
서 론
소화성 궤양(peptic ulcer)은 Helicobacter pylori 치료와 강력한 위산분비억제제인 양성자펌프억제제(proton pump inhibitor)의 사용으로 이전에 비하여 높은 치료 성공률을 보이고 있다. 하지만, 소화성 궤양 환자의 5∼10%에서 충분한 치료에도 불구하고 소화성 궤양의 완전한 치료가 이루어지지 않는 경우가 있는데, 이를 난치성 소화성 궤양(refractory peptic ulcer)이라고 한다. 난치성 소화성 궤양의 정의는 표준화되어 있지 않지만, 일반적으로 8∼12주의 표준치료에도 불구하고 완전한 치유가 이루어지지 않는 경우로 정의한다[1]. 소화성 궤양이 위산분비억제제 치료와 같은 내과적 치료에도 계속되거나 악화되는 경우 국내외 가이드라인에서는 난치성 소화성 궤양이 발생할 수 있는 환자 관련 위험인자, 부정확한 투약, 지속적인 H. pylori 감염, 특발성 위산과분비(idiopathic gastric hypersecretion) 또는 졸링거-엘리슨 증후군(Zollinger-Ellison syndrome)과 같은 기저 질환 등의 원인 인자가 있는지 확인하고 이에 대한 치료를 권고하고 있다[1-3].
본고에서는 난치성 소화성 궤양이 발생할 수 있는 원인 인자, 진단 및 치료에 대해 문헌고찰을 통해 알아보고자 한다.
본 론
1. 난치성 소화성 궤양의 원인 및 진단
난치성 소화성 궤양을 치료하는 데 있어 가장 중요한 것은 소화성 궤양의 치유 경과에 영향을 미칠 수 있는 인자 및 원인들을 분석하는 것이다. 난치성 소화성 궤양을 일으키는 원인 인자는 크게 환자 관련 인자와 순응도(compliance), H. pylori 감염 및 비 H. pylori 관련 인자로 나눌 수 있다(Fig. 1).
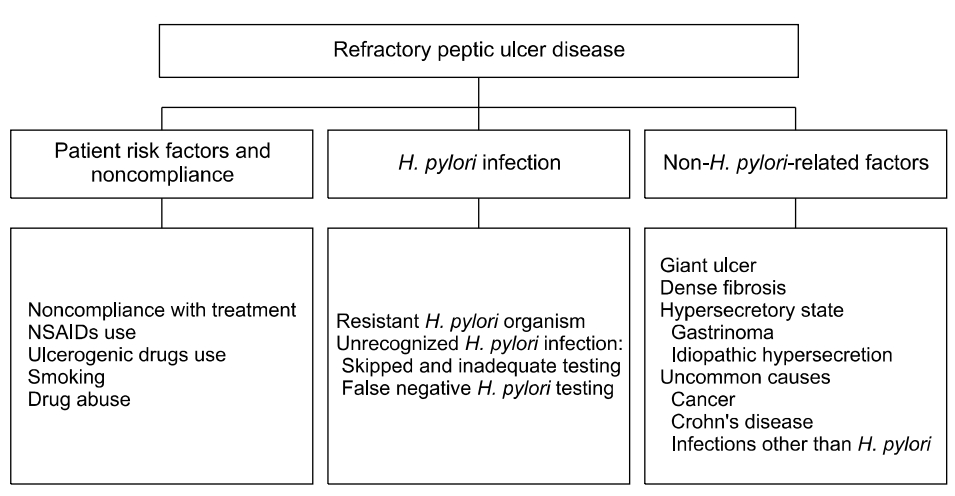
Causes of refractory peptic ulcer disease. H. pylori, Helicobacter pylori; NSAIDs, nonsteroidal antiinflammatory drugs.
1) 환자 관련 인자와 순응도
장기간 약제 투약이 필요한 환자들은 증상이 좋아지면 질병이 호전된 것으로 생각하고 약제 복용을 스스로 중단하는 경우가 많다[4]. 소화성 궤양 환자도 궤양의 위치에 따라 다르지만 일반적으로 적어도 4∼8주간의 치료를 필요로 하며 증상이 호전되면 중간에 약제 복용을 중단할 가능성이 있다[2]. 따라서, 난치성 소화성 궤양이 의심되는 모든 환자에 대해 추가적인 검사를 진행하기 전에 문진을 통해 약제 복용 순응 여부에 대해 반드시 확인해야 한다.
소화성 궤양 유발 약물의 지속적 사용은 난치성 소화성 궤양의 중요한 요인이다. 대표적인 소화성 궤양 유발 약물인 비스테로이드소염제(nonsteroidal anti-inflammatory drugs)는 위 점막의 방어와 유지에 필수적인 프로스타글란딘 생성을 억제시켜 소화성 궤양의 치유를 지연시키며 난치성 소화성 궤양을 유발시킬 수 있다. 이전 연구에서는 난치성 소화성 궤양의 40%에서 비스테로이드소염제의 사용과 관련이 있었다[5,6]. 난치성 소화성 궤양의 모든 환자에서 철저한 문진을 통해 지속적으로 비스테로이드소염제를 포함한 소화성 궤양 유발 약물 등의 사용 유무를 확인해야 하며, 환자가 이러한 약제의 사용을 숨기거나 인지하지 못하는 경우에는 국내에는 아직 상용화되어 있지 않지만 혈청 cyclooxygenase (COX) 활성, platelet adherence assay, salicylate 농도를 측정하면 간접적으로 최근의 비스테로이드소염제 사용여부를 확인할 수 있다.
흡연, 코카인 등의 약물 남용은 소화성 궤양을 유발하고 치유를 방해한다[7-9]. 담배에 포함된 니코틴 성분은 위 안의 펩신 분비, 담즙산염 역류, 활성산소 생성을 증가시키고, 프로스타글란딘 합성과 위 점막 혈류, 점액 분비를 감소시켜 소화성 궤양의 치료를 지연시킨다[10]. 국내에서 사용은 드물지만 코카인은 도파민, 에피네프린, 노르에피네프린의 재흡수를 차단하고 교감신경을 자극하여 점막 허혈을 유발시켜 소화성 궤양을 발생시킬 수 있다[8]. 따라서, 난치성 소화성 궤양 환자에서 흡연 유무를 확인하여 금연을 유도해야 하며, 원인 미상의 경우에 국내에 드물기는 하지만 코카인 등의 약물 남용도 의심해야 한다.
2) H. pylori 감염
H. pylori 감염은 비스테로이드소염제와 더불어 소화성 궤양 발생의 가장 중요한 원인으로 십이지장궤양의 약 90%, 위궤양의 약 70%에서 H. pylori 감염과 연관성이 확인되고 있다. 국내에서 H. pylori 감염률은 지속적으로 감소하고 있지만, 소화성 궤양 환자에서 H. pylori 감염률은 56.8%로 H. pylori 감염은 여전히 중요한 원인 인자이다[11]. H. pylori의 성공적인 제균 치료는 H. pylori 감염이 확인된 대부분의 소화성 궤양의 신속한 치유를 가능하게 하지만, 지속적인 H. pylori 감염은 궤양의 치료를 지연 또는 재발시킬 수 있다[6]. 난치성 소화성 궤양 환자에서 H. pylori 감염은 처음부터 검사를 시행하지 않아 감염 유무를 모르거나, 위음성으로 치료를 시행하지 못한 경우, 내성균에 의해 항균제 치료 후에도 제균이 되지 않은 경우 등을 고려해 볼 수 있다.
H. pylori는 위 전체에 고르게 분포하지 않으며, 위축의 정도나 약제의 사용 등에 의해 서식 분포의 변화가 발생할 수 있다. 따라서, 위 전정부와 체부를 모두 포함하여 가급적 많은 부분에서 조직을 채취하면 H. pylori 감염의 위음성률을 줄일 수 있다. 출혈 위험성이 높아 많은 조직 채취가 어려운 경우는 진단 당시에 요소호기검사를 시행하는 것도 고려해 볼 수 있겠다. 또한, H. pylori 감염 검사 전 정확도에 영향을 줄 수 있는 약제의 종류, 사용 기간 등을 주의 깊게 살펴보아야 하며 이를 바탕으로 검사 시기 및 검사 결과를 판정하면 위음성의 가능성을 줄일 수 있다. 항생제나 양성자펌프억제제의 경우 40%까지 위음성을 보일 수 있어, 이러한 위음성률을 줄이기 위해 검사 14일 전에 양성자펌프억제제의 사용을 중단하고, 제균 치료 종료 후에는 적어도 4주 후에 제균 확인 검사를 시행하는 것을 권장하고 있다[2,12]. 하지만, 이러한 노력에도 불구하고 현재 H. pylori 감염을 진단하는 검사방법들은 100% 정확하지 않다. 국내 보험 현실을 고려할 때 제한은 있지만 난치성 소화성 궤양 환자에서 감염을 확실히 배제하기 위해서는 임상에서 사용하고 있는 방법 중 적어도 두 종류 이상 시행하여 모두 음성인 경우에 H. pylori 음성으로 판단하는 것이 필요하다[2].
내성균에 의해 제균에 실패한 경우 Maastricht IV/Florence 가이드라인에서는 항생제 내성 검사 결과를 바탕으로 약제 선택을 권고하고 있다[13]. 하지만, 배양 검사를 통한 항생제 감수성 검사법은 국내에서 일부의 3차 의료기관에서 연구 목적으로만 사용할 수 있는 현실을 고려했을 때 이러한 권고안을 실제 임상에 적용하기에는 제한점이 있다. 최근에는 중합효소연쇄반응(polymerase chain reaction)을 이용해서 H. pylori의 clarithromycin 내성을 비교적 간단하게 알아낼 수 있는 검사법이 상품화되어 일부 진료현장에서 사용하고 있고, 이를 이용하면 배양 검사 없이도 항생제 내성 여부를 판정하여 제균율을 높일 수 있다[14].
3) 비 H. pylori 관련 인자
비 H. pylori 관련 인자는 환자 관련 인자 및 순응도와 H. pylori 감염만큼 흔한 원인은 아니지만, 난치성 소화성 궤양 환자에 영향을 미치는 중요한 요인이며 다양한 인자들이 존재한다.
궤양의 크기는 소화성 궤양의 치유에 중요한 요인이다. 일반적으로 3 cm 이상의 위궤양, 2 cm 이상의 십이지장궤양의 경우 거대 궤양(giant ulcer)이라고 말하며, 모든 궤양의 10∼24%가 이에 해당된다.15 위궤양의 경우 궤양의 크기와 무관하게 위산분비억제제로 주마다 3 mm 가량 치유되므로 큰 궤양은 치유되는데 더 많은 시간이 필요하다는 보고가 있으며, 십이지장궤양의 크기도 궤양 치유 속도에 영향을 미치는 것으로 알려져 있다[16]. 따라서, 거대 궤양의 경우 위산분비억제제를 일반적인 소화성 궤양보다 좀 더 길게 사용한 후에 난치성 소화성 궤양 여부를 판정할 필요가 있다.
위와 십이지장은 많은 혈관이 분포해 있어 만성 허혈로 인한 소화성 궤양은 드물다. 하지만, 반흔이 심하거나 동맥 경화증 및 색전술로 인한 혈관 손상으로 인해 점막으로 혈류가 저하되면 혈관재생과 조직 복구가 저해되어 난치성 소화성 궤양이 발생할 수 있다[17].
선암, 위장관기질종양, 림프종, 전이성 종양 등을 포함하는 위 또는 십이지장의 악성 종양은 정의상 난치성 소화성 궤양에 해당하지 않지만, 내시경 검사에서 궤양성 병변으로 흔히 발견되고 위산분비억제제 투여 후에도 반응이 없는 경우가 많아 난치성 소화성 궤양으로 오인될 수 있다. 이전 연구에서 초기 조직검사에서 악성 종양이 확인되지 않은 소화성 궤양 환자를 추적 관찰하였을 때 0.9∼4.5% 환자에서 악성 종양이 확인되었다는 보고도 있다[18]. 따라서, 모든 난치성 소화성 궤양은 반드시 궤양의 변연부를 포함한 조직검사를 시행하여야 하며, 악성 종양 역시 위산분비억제제 투여 후 형태적 변화나 궤양의 치유가 가능하므로 난치성 소화성 궤양이 발견되면 추적 내시경 검사와 반복적인 조직검사를 통해 악성 종양을 배제하기 위해 노력이 필요하다.
졸링거-엘리슨 증후군은 가스트린 분비 종양(gastrinoma)에 의한 위산 과다분비 때문에 생긴 심한 소화성 궤양을 특징으로 하며 난치성 소화성 궤양의 드문 원인이다[19]. 심한 소화성 궤양, 궤양을 동반한 식도염, 다발성 소화성 궤양, 특이한 부위에 생긴 궤양, 난치성 소화성 궤양, 합병증을 동반한 궤양, 설사를 동반한 궤양, 1형 다발성 내분비 종양(multiple endocrine neoplasia type 1)의 가족력이 있는 경우 반드시 의심해 보아야 한다. 상부위장관 내시경에서 위벽 주름이 비후되어 있는 소견도 졸링거-엘리슨 증후군 진단의 중요한 실마리가 된다. 졸링거-엘리슨 증후군은 혈중 가스트린과 위의 기저 산분비능(basal acid output) 측정으로 진단이 가능하다. 식전 혈중 가스트린이 1,000 pg/mL 이상이면서, 기저 산분비능이 15 mEq/h 이상이거나 고가스트린혈증과 함께 위가 pH 2 이하인 경우 진단이 가능하다[20]. 양성자펌프억제제는 가스트린 분비를 촉진시켜 위양성의 결과를 보일 수 있어 검사 전에 양성자펌프억제제 중단이 필요하며, 치료를 위해 약제 중단이 불가능한 경우 단기간 고용량의 히스타민 제2형 수용체 길항제로 변환하여 사용하고 혈액 검사 전에 히스타민 제2형 수용체 길항제를 중단하는 방법을 사용해 볼 수 있다[21].
크론병은 하부위장관뿐만 아니라 0.3∼5%에서는 위, 십이지장을 포함한 상부위장관에 병변을 동반하는 경우가 있으므로, 크론병 환자에서 난치성 소화성 궤양이 발생하면 크론병의 상부위장관 침범을 의심하고 위궤양뿐만 아니라 십이지장궤양의 경우도 조직검사를 시행해야 한다. 하지만, 내시경적 조직검사상에 크론병 진단에 도움이 되는 육아종이 발견된 경우는 7%로 매우 낮은 것으로 알려져 있다[22].
드물지만 결핵, 매독, 분선충증, 거대세포 또는 헤르페스 바이러스, 곰팡이 질환 등의 다양한 감염성 질환이 난치성 소화성 궤양의 원인이 될 수 있다[3]. 감염성 질환의 경우 진단만 되면 완치가 될 수 있으므로 위, 십이지장에 발생할 수 있는 감염성 질환의 내시경적인 소견을 익히고 항상 이에 대한 가능성을 두고 조직검사를 통한 확인을 위해 노력해야 한다.
2. 난치성 소화성 궤양의 치료
1) 원인 인자 교정
난치성 소화성 궤양의 치료는 궤양의 치유를 지연시키는 원인에 대한 임상 평가를 통해 앞서 언급된 원인 인자를 찾아내어 교정을 시행하는 것이 시작이다. 궤양 치유에 영향을 미칠 수 있는 약제 복용 순응도, 흡연 여부, 비스테로이드소염제 등의 약제 복용 여부를 철저한 문진을 통해 자세히 알아보는 것이 매우 중요하며, 환자가 약제 복용을 숨기거나 약제 복용 여부를 모르는 경우도 있어 주의를 요한다. 환자 교육을 통해 소화성 궤양은 증상 호전이 되어도 적어도 4∼8주 이상의 위산분비억제제의 투여가 필요하고, 흡연이 궤양 치유를 저해할 수 있음을 교육시켜야 한다. 비스테로이드소염제 복용이 확인된 경우는 가능하면 비스테로이드소염제 사용을 중지하고 양성자펌프억제제 혹은 히스타민 제2형 수용체 길항제 등의 위산분비억제제를 사용한다. 비스테로이드소염제 중단이 어려운 경우 양성자펌프억제제를 사용하고, 선택적 COX-2 저해제로 비스테로이드소염제를 교체하는 것도 치료에 도움이 될 수 있다[23,24].
항생제 내성에 의한 H. pylori 제균 실패가 의심되는 경우 배양 검사에 의한 항생제 감수성 검사가 가능한 기관에 의뢰를 하거나, 기존 치료법에 비하여 높은 제균율을 보이는 순차치료, 동시치료, 양성자펌프억제제와 amoxicillin을 포함한 삼제요법 등을 시도해 볼 수 있다[25]. 치료 전에 시행한 H. pylori 검사가 음성인 경우라도 난치성 소화성 궤양 환자의 경우 위음성을 고려하여 추가적인 검사가 필요하다. 서로 다른 두 가지 이상의 검사를 통해 결과를 비교하고 약제에 의한 위음성 결과를 보일 수 있는 경우(양성자펌프억제제 복용, 항생제, 항생제 사용, 치료 후 검사 시기)를 고려하여 위음성을 배제하여야 한다[2]. 이전에 H. pylori 치료 기왕력이 없는 환자의 경우는 H. pylori 혈청 검사가 도움이 될 수 있다. H. pylori 감염은 한번 감염되면 저절로 치료될 가능성이 거의 없으므로, 치료 기왕력이 없고 H. pylori 혈청검사가 양성이라면 H. pylori 양성으로 간주해서 제균 치료를 시도할 수 있다.
난치성 소화성 궤양과 악성 종양과의 감별을 위해 내시경 소견에서 양성 궤양처럼 보이고 조직검사에서 악성 소견이 없더라도 반복적으로 궤양 변연과 기저부에서 다수의 생검을 해야 한다. 또한 감염성 질환이나 염증성 장질환도 난치성 소화성 궤양의 소견을 보일 수 있으므로 이에 대해 의심이 필요하며 생검을 통해 감별을 하고 확인된 경우 각 질환에 대한 치료가 필요하다.
환자 관련 인자 및 순응도와 H. pylori 감염이 배제되면 가스트린종에 의한 졸링거-엘리슨 증후군인지 감별하기 위해 반드시 공복시 혈청 가스트린치를 측정하여야 한다. 가스트린종이 진단된 경우 수술적 치료가 최선의 치료이며, 위산분비 억제를 위해서는 양성자펌프억제제가 가장 효과적인 약제이며 기저 산분비능이 10 mEq/h 이하가 되도록 충분한 용량을 사용한다[26].
2) 위산분비억제제 치료
H. pylori 감염, 비스테로이드소염제 약제 사용 등을 포함한 이차적인 원인에 의한 난치성 소화성 궤양의 가능성이 배제되는 경우 위산분비억제제 등의 약제를 사용하는 내과적 치료를 먼저 시행하며 양성자펌프억제제는 위산분비억제제 중 가장 효과적 약제이다. 소화성 궤양 치료를 위해 히스타민 제2형 수용체 길항제를 사용한 경우 치료에 반응하지 않더라도 양성자펌프억제제 치료에는 반응하는 경우가 많으므로 히스타민 제2형 수용체 길항제를 사용한 경우 양성자펌프억제제로 변경하여 투여하는 것이 권장된다[27]. 양성자펌프억제제를 일차 약제로 사용하여 반응이 없는 경우 다른 양성자펌프억제제로 변경하거나, 표준용량보다 높은 용량의 투여를 고려할 수 있으며, 난치성 소화성 궤양 환자의 90%는 양성자펌프억제제 투여로 치유에 도달할 수 있다[28]. 아직 국내에서 시판 중이지 않지만 칼륨 경쟁적 위산 분비 억제제(potassium-competitive acid blocker)는 새로운 계열의 위산분비억제제로 임상 연구에서 빠른 약효 발현, 지속적이고 강력한 위산 분비 억제 효과를 보여 향후 난치성 소화성 궤양의 새로운 치료 약제로 주목된다[29].
난치성 소화성 궤양을 포함한 소화성 궤양은 위산분비억제제 투여를 중지하거나 용량을 감량하는 경우 5∼30% 환자에서 1년 안에 재발을 경험한다[30]. 원인 인자가 교정되고 궤양이 치유된 경우에는 대부분 유지요법이 필요하지 않지만, H. pylori, 비스테로이드소염제 등의 원인 인자를 교정했는데도 궤양이 치유되지 않을 때는 6∼24개월 동안 지속적인 위산분비억제제 투여가 권장되며, 특히 크고 심한 반흔이 있는 궤양의 경우에 추천된다. 난치성 소화성 궤양의 원인 인자를 교정할 수 없을 때는 지속적인 위산분비억제제 투여가 필요하다[31,32].
3) 수술적 치료
양성자펌프억제제를 포함한 많은 약제들의 개발로 수술이 필요한 경우는 이전에 비하여 많이 감소하였다. 하지만, 충분한 약물치료에 반응하지 않는 궤양, 내과 치료를 받을 수 없을 때, 천공, 위배출구 폐쇄 등의 합병증 발생 또는 발생 고위험군, 거대 위ㆍ십이지장 궤양, 적절한 내과 치료에 실패한 경우, 유지요법 동안의 재발, 충분한 내과 치료 중 재발한 궤양에서 수술적 치료를 고려해 볼 수 있다.
결 론
난치성 소화성 궤양의 치료는 소화성 궤양의 치유를 지연 및 악화시키는 원인 및 기저 질환을 찾아내어 교정 및 치료를 시행하는 것이 시작이다. 이차적인 원인에 의한 난치성 소화성 궤양의 가능성이 배제되는 경우 양성자펌프억제제를 포함한 위산분비억제제는 현재 근간이 되는 치료 방법이며 필요한 경우 유지요법을 고려해야 한다. 수술적 치료는 충분한 내과적 치료에도 불구하고 치료가 되지 않거나 합병증이 발생한 환자에서 시행을 고려해야 한다.
Notes
No potential conflict of interest relevant to this article was reported.
