표재성 식도편평상피암의 내시경 절제 및 절제 후 치료전략
Strategies for the Endoscopic Management and Post-Resection Treatment of Superficial Esophageal Squamous Cell Carcinoma
Article information
Trans Abstract
Endoscopic resection (ER) is preferred for treating superficial esophageal squamous cell carcinoma (SESCC) that has a low risk of lymph node metastasis; the preference is due to the technique’s minimal invasiveness and having outcomes comparable to those of surgical resection, in suitable cases. Determining the appropriateness of ER requires a multidisciplinary review involving a pathological examination of the tumor’s depth, size, and lymphovascular invasion following resection of a specimen. According to the Korean guidelines, no additional treatment is necessary after a complete en bloc resection of SESCC that lacks submucosal invasion and lymphovascular invasion. In cases of non-curative resection for tumors that exhibit submucosal invasion, lymphovascular invasion, or positive margins, additional treatment (e.g., esophagectomy or chemoradiotherapy) is recommended. Due to the uncertainty regarding which treatment is more effective, tailored therapy that is based on patient factors and tumor characteristics is needed to maximize patient long-term survival and improve quality of life.
서 론
식도암은 국내에서는 2021년 기준 인구 10만 명당 조발생률이 5.8명으로 총 4371명이 발생하여 전체 암 발생의 1.1%를 차지한다. 식도암은 진행된 병기에서 발견되는 경우가 많고, 림프절 전이가 흔하게 발생하여 예후가 좋지 않지만, 최근 내시경 검사의 보편화와 성능 향상으로 조기 발견이 증가하고 있다[1]. 국내 연구에 따르면, 2006년에서 2013년을 비교했을 때, 국소식도암(localized stage)의 비율이 30.1%에서 33.0%로, 국소진행암(regional stage)은 32.7%에서 37.8%로 증가했는데, 이는 전이암(distant stage)과 미분류(unknown)의 비율이 37.3%에서 29.3%로 감소하고, 치료가 가능한 국소 혹은 국소 진행 식도암의 비율이 증가한 것을 의미한다[2]. 식도암은 두 가지 조직학적 유형으로 나뉘는데, 편평상피암종(squamous cell carcinoma, SCC)은 한국을 비롯한 아시아 국가에서 흔하고, 선암종(adenocarcinoma)은 북미, 유럽에서 더 많이 발생한다[3]. 식도암 중 침윤 깊이가 점막(T1a) 혹은 점막하층(T1b)에 국한된 경우를 표재성 식도암(superficial esophageal cancer)으로 정의한다. 이 논고에서는 식도암 중 표재성 식도편평상피암(superficial esophageal squamous cell carcinoma, SESCC)의 내시경적 절제술과 불완전 내시경 절제술 후 치료에 대해 다루고자 한다.
본 론
내시경적 절제술의 적응증
SESCC의 표준치료는 식도절제술이지만, 수술적 치료에 따른 합병증 위험과 수술 후 삶의 질 저하가 문제로 지적된다[4]. 내시경 절제술(endoscopic mucosal resection 또는 endoscopic submucosal dissection)은 SESCC에서 덜 침습적인 치료방법으로, 림프절 전이의 위험성이 매우 낮은 경우에는 식도절제술이나 항암방사선 치료 대신 일차치료로 사용되고 있다[5]. SESCC는 침윤의 깊이에 따라, 점막의 상피층(epithelium) 을 pT1a-M1, 점막고유층(lamina propria)을 pT1a-M2로, 점막근층(muscularis mucosa)까지 침범을 pT1a-M3로 분류한다. 점막하층 침윤이 200 μm 이하인 경우는 pT1b-SM1으로, 200 μm를 초과하는 더 깊은 침윤은 pT1b-SM2/SM3로 분류한다. 림프절 전이의 위험은 종양 침윤 깊이와 상관관계가 있는데, pT1a-M1/M2에서는 0.4%-5.6%, pT1a-M3에서는 8.7%-18.0%, pT1b-SM1에서는 7.7%-53.1%, 그리고 pT1b-SM2/SM3에서는 36.2%-53.9%로 보고 되었다[6]. 따라서 내시경 절제술로 절제된 SESCC의 병리조직학적 검사 결과에 따라 식도절제술이나 항암방사선 치료를 포함한 추가 치료가 필요할 수 있다[5,7-9].
국내 가이드라인에 따르면[5], 원격 전이와 림프절 전이가 없고, 점막하층에 침범하지 않은 SESCC는 내시경 절제술의 대상이다. 내시경 절제술로 완전히 일괄 절제된 검체의 병리 소견에서, 점막고유층을 넘지 않고 맥관에 침윤이 없는 경우, 림프절 전이의 위험이 매우 낮기 때문에 추가 치료가 필요없다. 또한, 점막근판을 침범한 경우라도 혈관에 암세포 침윤이 없으면 림프절 전이 위험이 낮아 추가 치료 없이 면밀한 경과관찰이 가능하다.
유럽 내시경학회 가이드라인에서는[7] 림프절 전이가 없고 점막고유층까지만 침범한(pT1a-M1/M2) SESCC를 내시경 절제술의 절대 적응증으로 제시하고 있다. 점막근층(pT1a-M3) 또는 점막하층 200 μm 이하(pT1b-SM1) 침윤이며 비전주성(non-circumferential)일 경우에도 내시경 절제술을 고려할 수 있다. 일본 가이드라인에서는[8,9] pT1a-M1/M2 침윤이 비전주성일 경우 내시경 절제술을 시행하며, 전주성(circumferential)이고 길이가 5 cm 이하인 경우에도 내시경 절제술을 시행할 수 있다. pT1a-M3 또는 pT1b-SM1 침윤의 경우, 비전주성일때만 내시경 절제술을 일차치료로 시행할 수 있다(Table 1).
국내의 연구결과로 점막하층 침범이 없는 SESCC 환자에서 내시경 절제술을 받은 군과 식도절제술을 받은 군 간의, 평균 관찰기간이 각각 43개월과 63개월, 전체 생존율(overall survival, OS), 질병 특이적 생존율(disease-specific survival), 무재발생존율(recurrence-free survival)에서 차이가 없었다[10]. 중국의 연구결과에서도 내시경 절제술을 받은 군과 수술을 받은 군 간에 사망률 차이가 없었다(7.4% vs. 10.9%, p=0.209) [11].
내시경 절제술 후 치료전략
내시경 절제술 후 불완전 절제가 되었거나, 완전절제는 되었지만 병변이 완치기준(curability criteria)을 충족하지 못하여 치료적으로 불완전절제(non-curative resection)인 경우에는, 림프절 전이 가능성이 있어 추가적인 치료가 필요하다[5,7,8]. SESCC에서 림프절 전이를 예측하고 이를 치료 방침에 적용하는 것이 중요하다. Xu 등[12]이 보고한 메타분석에서, 림프절 전이 위험을 예측하는 인자로는 병변의 크기(>20 mm), 융기형(Type I) 또는 궤양형(Type III)의 병변의 모양, 저분화도(poorly differentiated), 종양 침윤 깊이, 그리고 맥관 침습이 있다. 다른 후향적 연구에서는 비근치 절제술 후 추가 치료 없이 SESCC의 전이성 재발에 대한 위험 요인을 보고하였다[13]. 맥관 침습이 가장 높은 위험을 나타냈고, pT1b-SM2와 수직 절제면(vertical resection margin, VRM) 침범이 전이성 재발의 중요한 위험 요인이었다. 이 논문에서는 침윤의 깊이와 맥관 침습을 이용하여 전이성 재발 위험에 대한 분류를 하였다. 저위험군(low-risk)은 pT1a-M3/pT1b-SM1과 맥관 침습 음성인 경우이며, 5년 전이성 재발률(metastatic recurrence rate)은 2.8%였다. 중간 위험군(intermediate-risk)은 pT1a-M3와 맥관 침습 양성 또는 pT1b-SM2와 맥관 침습 음성이고, 고위험군(high-risk)은 pT1b-SM과 맥관 침습 양성으로 분류하였다. 중간 및 높은 위험의 5년 전이성 재발률은 각각 20.1%, 30.5%였다.
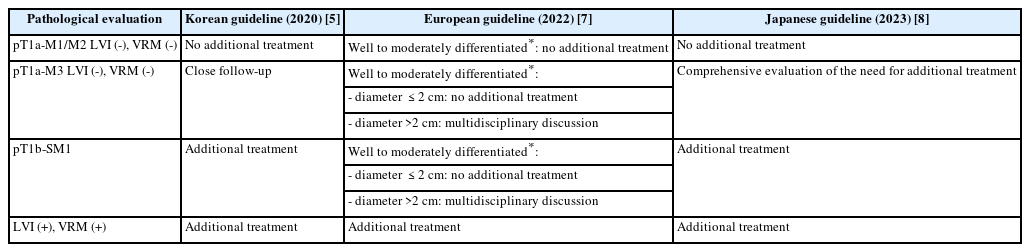
국내 가이드라인에 따르면[5], 내시경 절제 이후 검체의 병리 소견에서 점막근판을 넘어선 점막하층 침윤, 맥관 침윤이 있는 경우, 또는 VRM에서 침범 양성 소견이 있으면, 림프절 전이나 원격 전이의 위험이 높아져 추가 치료를 권장하고 있다. 유럽 가이드라인에 따르면[7], 병변이 pT1a-M1/M2에 국한되어 있고, 고분화 또는 중등도 분화도(well to moderately differentiated) 이며, 맥관 침습이 없는 경우 추가 치료는 권장되지 않는다. pT1a-M3 또는 pT1b-SM1까지 침윤한 경우, 고분화 또는 중등도 분화도이고, 맥관 침습이 없으며, 크기가 2 cm 이하인 경우에는 근치적 절제로 간주될 수 있다. 그러나 병변이 2 cm 초과인 경우, 림프절 전이의 위험이 낮지만 존재할 수 있으므로, 림프절 전이에 대한 다학제적 논의를 통해 추가 치료 여부를 결정하는 것이 권장된다. 일본 가이드라인에 따르면[8] pT1a-M1/M2까지 침윤의 경우 맥관 침습이 음성이면 경과관찰이 가능하다. pT1a-M3이며 맥관 침습이 음성인 환자의 경우 추가 치료 필요성에 논의가 있어 이에 대한 종합적인 평가가 필요하다. pT1b-SM이거나 맥관침습이 있는 SESCC 환자에서는 추가적인 외과적 절제술 또는 항암방사선 치료를 권장한다(Table 2).
내시경적 비근치적 절제 후 추가 치료
내시경 절제술 후 근치적 절제가 되지 않은 SESCC의 추가 치료로는 식도절제술과 항암방사선 치료가 있다. 그러나 현재로서는 수술과 항암방사선 치료 중 어느 것이 더 효과적이라고 결론짓기에는 충분한 근거가 부족하므로, 환자 개별의 상황을 고려하여 치료 방법을 결정해야 한다. 일본 가이드라인에 따르면[8], 비근치적 내시경 절제술 후 식도절제술을 시행한 환자의 5년 생존율은 79%-100%, 항암방사선 치료를 받은 환자의 5년 생존율은 60%-100%로 보고되었으며, 5년 무병 생존율(5-year disease-free survival)은 각각 89.5%-100%, 55%-100%였다. 재발의 위험 요소로는 점막하 침윤, 혈관 침습 양성, 그리고 종양 직경이 40 mm 이상인 것이 보고되었다. pT1a-M3 및 pT1b-SM에서 수술을 받은 환자들의 전체 생존율과 무병 생존율은 항암방사선 치료를 받은 환자보다 유의하지는 않지만 더 높은 경향을 보였다.
Tsou 등[4]은 근치적인 내시경 절제가 되지 않은 SESCC 환자에서 추가 식도절제술을 시행한 5개의 연구들을 정리하였다. 환자는 총 110명이었으며, 이 중 pT1a는 24명, pT1b는 86명이었다. VRM 양성은 14.5%, 맥관 침습은 64.5%였다. 23-47개월의 추적 관찰 기간동안, 국소 재발 및 원격 전이는 발생하지 않았다. 두 연구에서는 5년 OS가 각각 90%와 100%로 보고되었으며, 3년 무병생존율이 86%, 5년 무병생존율이 100%로 보고된 연구도 있었다. 수술 관련 사망률의 통합 비율은 3.6%로 나타났으며, 연구 간에는 0%-7.1%의 범위를 보였다.
근치적인 내시경 절제가 되지 않은 SESCC 환자의 추가 항암방사선 치료의 대한 여러 연구에서, 항암방사선 치료를 시행한 군은 추가 치료를 하지 않은 군에 비해 유의하게 낮은 전이 및 재발률이 보고되었다. Minashi 등[14]의 전향적 연구에서는 병리소견에서 pT1a이면서 절제면이 음성, 맥관 침윤이 음성인 경우를 Group A (74명)로, pT1b이면서 절제면이 음성이거나, pT1a이면서 맥관 침윤이 양성으로 예방적으로 항암방사선을 시행한 경우를 G roup B (87명), VRM 양성으로 항암방사선 치료를 받은 경우를 Group C로 분류하여 전향적으로 관찰하였다. 3년 OS는 92.6%였으며, Group B는 90.7%로 수술과 비교하여 효과적인 치료 방법임이 보고되었다. 이 중 Group C의 4명이 전이성 재발이 있었고, 3명(20%)이 식도암으로 사망하여, 내시경 치료로 완전 절제가 이루어지지 않는 경우에 추가적인 치료에 대한 연구가 필요함을 시사하였다.
이전에 시행된 근치적 내시경 절제가 되지 않은 SESCC 환자를 대상으로 한 연구들에서, 추가로 항암방사선 치료를 받은 경우(3.8%-27.2%)의 재발률이 추가 식도절제술을 받은 경우(0.0%-11.1%)보다 높은 것으로 보고되었다. 이는 근치적 내시경 절제가 되지 않은 SESCC 환자에서 재발 예방을 위해 식도절제술이 효과적임을 시사한다[15]. 그러나 수술은 합병증 위험이 높고 항암방사선 치료보다 삶의 질을 더 손상시킬 수 있다. 이 연구들 중 3개의 연구에서는 식도절제술 중 치료 관련 사망(1.8%-7.1%)이 있었지만, 항암방사선 치료와 관련된 사망은 보고되지 않았다. 근치적 내시경 절제가 되지 않은 환자에서 식도절제술과 항암방사선 치료를 전향적으로 비교한 무작위 배정 임상시험에 대한 보고는 현재까지는 없다. 하지만 현재 국내(ClinicalTrials.gov number, NCT03306901, ASSURE trial)와 중국에서[16] 3상 다기관 무작위 대조 시험이 진행 중이다. 이 연구의 결과는 SESCC에서 내시경 절제술 후 치료적 절제가 되지 않은 환자의 최적 추가 치료 방법을 제시해줄 것으로 기대된다.
결 론
국내에서 내시경 검사가 널리 시행되면서 표재성 식도암 발견이 증가하고 있어, 이에 대한 올바른 진단과 최선의 치료방법을 결정하는 것이 중요하다. 내시경 절제술은 SESCC에서 덜 침습적이고 식도를 보존하는 장점이 있으며, 수술과 비교할 만한 치료 성적이 보고되고 있다. 그러나 식도암은 초기단계에도 전이가 발생할 수 있으므로 내시경 절제술 대상자 선정이 중요하다. 국내 가이드라인에 따라 림프절 및 원격 전이가 없고 명확한 점막하층 침범이 없는 경우 초치료로 권고된다. 내시경 절제술 후 최종 병리에 따라 추가적인 치료여부가 결정되므로, 병리 소견을 올바르게 해석하고 이를 바탕으로 추가 치료의 필요성을 결정할 수 있어야 한다. 비근치적 내시경 절제 후 추가 치료로 수술적인 치료와 방사선 치료가 있다. 식도절제술은 재발예방에는 효과적이지만 수술 합병증 및 삶의 질 저하가 문제가 되며, 항암방사선의 경우 수술에 비해 재발이 문제가 된다. 이에 환자의 나이, 기저 질환, 전신 상태에 따라 개별 환자에 적절한 치료 방침을 결정해야 할 것이다.
Notes
Availability of Data and Material
Data sharing not applicable to this article as no datasets were generated or analyzed during the study.
Conflicts of Interest
Hyun Ho Choi, a contributing editor of the Korean Journal of Helicobacter and Upper Gastrointestinal Research, was not involved in the editorial evaluation or decision to publish this article.
Funding Statement
None
Acknowledgements
None