비유두부 십이지장 종양
Non-Ampullary Duodenal Tumors
Article information
Trans Abstract
Non-ampullary duodenal tumors refer to duodenal lesions that originate at sites other than the ampulla of Vater. They differ from ampullary duodenal tumors, which are typically associated with obstructive symptoms. Non-ampullary duodenal tumors are rare; therefore, standardized clinical management, including diagnostic and therapeutic modalities and the follow-up strategy remain unclear. An increase in the numbers of patients undergoing endoscopy during medical checkups and technological advances in endoscopic procedures, including high-resolution and image-enhanced endoscopy have led to an increase in detection rates of duodenal tumors recently. Currently, endoscopic resection of duodenal tumors is widely used and is a preferred therapeutic alternative to surgical excision. Some duodenal tumors of high malignant potential are associated with poor prognosis; therefore, accurate diagnosis and timely management are important. In this article, we review the current knowledge regarding non-ampullary duodenal tumors and the therapeutic approaches to these lesions.
서 론
십이지장 종양은 위내시경 수검자의 0.02~0.5% 정도에서 발견되는데[1-3] 임상병리학적 특성이 잘 정의되지 않는 비교적 드문 질환이다. 하지만 최근 검진 목적의 내시경 검사가 증가하고, 내시경 해상도와 기술이 발전하면서 십이지장 종양의 발견 빈도와 조기 발견율이 증가하고 있다. 십이지장 종양이 악성 종양으로 진행한 경우에는 표준 치료로 췌장십이지장절제술(pancreaticoduodenectomy)이 필요한데, 외과적 수술과 관련된 합병증이 40% 정도로 높기 때문에[4] 가급적 수술적 치료가 필요하기 이전 단계에서 십이지장 종양을 조기에 발견하고 진단하여 조기에 치료하는 것이 중요하다. 하지만 십이지장의 해부학적 구조상 좁은 유문부를 지나 복강 내에 위치하는 구부와 이어서 후복막으로 이행하면서 급격한 각도 변화를 동반하는 제2부로 이어지기 때문에, 위치에 따라서 내시경적 시야 확보가 어려울 수 있고, 따라서 내시경 관찰과 치료적 접근 시에 세심한 주의가 필요하다. 본고에서는 현재 비유두부 십이지장 종양에 관련하여 내시경적 진단과 치료를 비롯한 임상 진료에 도움이 될 만한 부분에 초점을 맞추어 살펴보고자 한다.
본 론
1. 종양의 종류
1) 비유두부 십이지장 선종(non-ampullary duodenal adenoma)
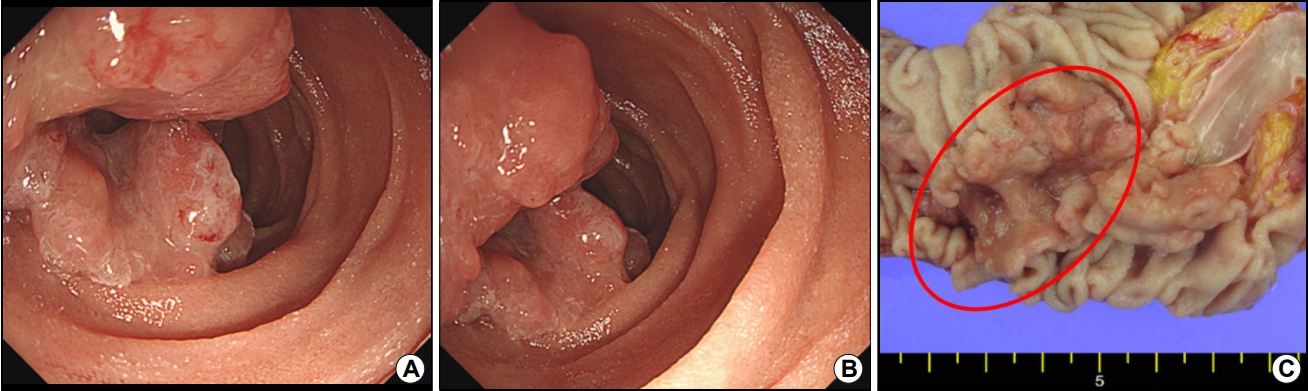
십이지장 선종은 비교적 드문 질환으로, 후향적 연구들에서의 유병률은 0.03~0.4% 정도로 비교적 낮게 보고되고 있으며, 가족성선종성용종증(familial adenomatous polyposis, FAP)과 연관된 경우가 60% 정도를 차지한다. 일본에서 2010년 발표한 43명의 산발적 비유두부 십이지장 선종 환자를 치료없이 평균 29개월 추적 관찰한 자연 경과에 관한 연구에 따르면[5] 저도 이형성 샘종 환자에서 79%는 추적 기간 동안 조직병리학적 변화를 보이지 않았다. 하지만 20%는 고도 이형성 샘종으로 진행하였으며 전체의 4.7%는 점막암으로 진행하였다. 2010년 미국에서 보고된 다른 연구에서 59명의 산발적 비유두부 십이지장 종양 환자에서 대부분의 병변은 십이지장 하행부에 무경성의 단일 병변(sessile, solitary)으로 많이 관찰되었다(Fig. 1) [6,7]. 십이지장 선종의 유병률이 낮고 치료와 관련된 연구가 많지 않아 근거 수준이 높지는 않지만, 모든 산발적 비유두부 십이지장 선종은 내시경 절제를 고려해야 하며, 특히 십이지장 선종이 20 mm 이상인 경우에는 선암으로 진행될 가능성이 높기 때문에 즉시 치료할 것을 권유한다. 또한 십이지장 선종의 내시경 절제 후 국소 재발률이 0~36%로 연구마다 다양하게 보고되고 있기 때문에[8] 내시경 절제술이 성공적으로 진행된 경우에도 주기적인 추적 관찰이 중요하다.
Endoscopic images of a non-ampullary duodenal adenoma. Images showing a flat-elevated duodenal adenoma with whitening and pit pattern (A: bulb, B: superior duodenal angle, C: 2nd portion of the duodenum).
FAP 환자의 30~70%가 십이지장 선종이 발생하며 이는 대장 절제술을 받은 FAP 환자에서 사망의 주요한 원인이다[9,10]. 이 경우에 십이지장 선종은 일반적으로 무경성의 다발성 병변으로 하행십이지장의 점막주름 사이에 많이 위치한다. FAP 환자들에서 십이지장 용종의 중증도를 평가하는 도구 중 하나로 Spigelman 병기가 유용하게 사용되는데(Table 1) 선종의 수, 크기, 조직학적 분류 및 이형성 정도에 대해 점수를 메겨 총 4개의 stage로 나눈다. 1단계는 경증, 2~4단계는 중증 십이지장 용종증을 나타내는데 FAP 환자의 70%가 2~3단계에 속하고 20~30%는 1, 4단계에 속한다. 4단계 환자에서 십이지장암이 발생할 누적 위험률은 70세에서 50%에 이른다[11]. 내시경이나 수술로 국소 절제하는 경우에는 재발이 흔하기 때문에 4단계 환자에서는 십이지장절제술을 진행해야 한다[10].
2) 십이지장 선암(duodenal adenocarcinoma)
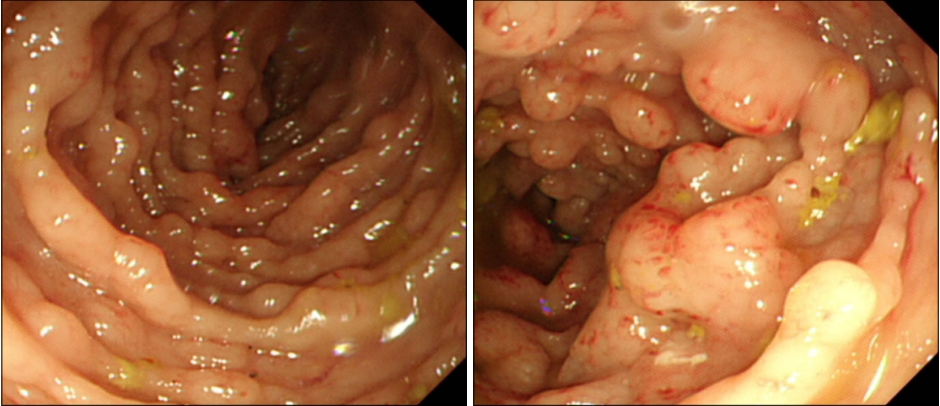
원발성 십이지장 선암은 전체 위장관 종양의 1% 미만으로 비교적 드물지만, 소장 종양 중에서는 33~45%가 십이지장에 위치한다(Fig. 2) [12]. 십이지장 선암은 구부, 하행부, 횡행부 등에서 모두 발생할 수 있지만, 일반적으로 유두부 주위에 가장 흔하게 발생하며, 결절상, 궤양상, 돌출상 등의 다양한 형태로 관찰될 수 있다. 유두부의 암일 경우 유두부가 정상 크기의 2배 이상 커지며 종괴 형태로 나타나는 경우가 흔하다. 원발성 비유두부 십이지장 선암은 전체 위장관 암의 0.3% 정도로 매우 드물게 발생하는데, 유두부암에 비해서 특이한 임상 증상이 없고 자각 증상이 비교적 늦게 나타나기 때문에 병기가 많이 진행된 상태에서 진단되는 경우가 많고 예후가 나쁘다[13]. 전형적인 비유두부 십이지장 선암은 중심부에 함몰이나 궤양을 동반하면서 침윤으로 인해 주변 부위에 비해 돌출된 경계를 보이는 경우가 많다. 내시경 관찰 시 흔히 관찰하게 되는 구부의 양성 궤양은 통상적으로 생검을 시행하지 않지만, 하행부 이하 부위에 궤양성 병변이 관찰되거나 구부의 궤양성 병변이 침윤성, 불규칙한 모양 또는 주변에 비해 돌출된 경계를 보이면 반드시 조직 검사를 고려해야 한다. 내시경 검사의 증가로 십이지장 선암 또는 선종이 우연히 발견되는 빈도가 늘어나고 있으며, 특히 선종이나 점막층 혹은 점막하층 일부까지 침범된 조기 십이지장 선암의 경우 내시경 절제술이 치료 방법으로 시도되고 있다[14]. 하지만 십이지장의 해부학적 특성으로 시술의 어려움과 시술 후 합병증 및 재발로 인해 대부분의 십이지장 선암은 현재 수술적 치료를 표준 치료로 인정하고 있다[13].
3) 십이지장 유암종(duodenal Neuroendocrine tumor)
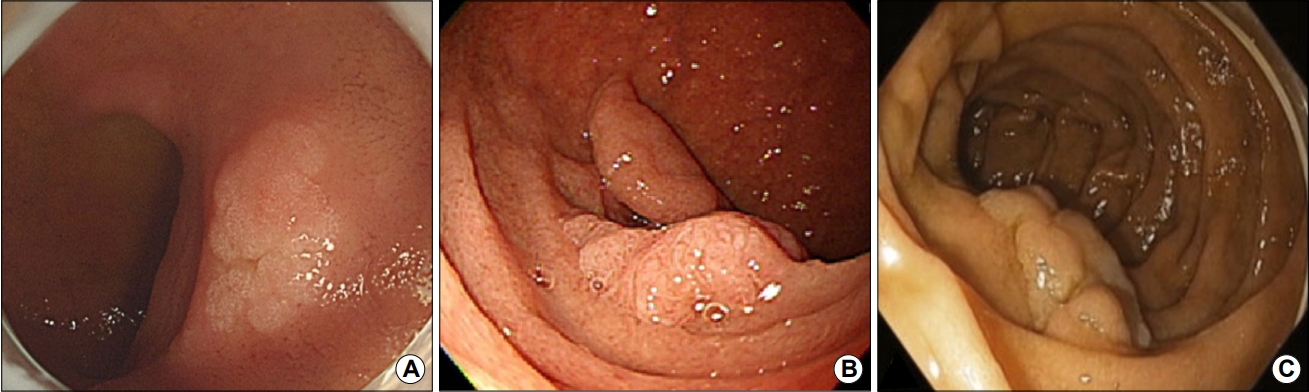
장크롬친화세포에서 발생하는 신경내분비종양은 유암종이라고 흔히 통용되기도 한다. 소화관에 발생하는 신경내분비종양은 대부분은 직장(71.7%), 위(13.6%)에서 발견되고, 십이지장은 8.6%로 3번째로 호발하는 장기이다[15]. 원발성 십이지장 유암종은 90% 이상이 십이지장 구부, 하행부에서 관찰되며 팽대부 주위는 20% 정도의 빈도로 발생한다고 알려져 있다[16]. 내시경적으로는 매끄러운 황색조의 표면을 가지고, 완만한 융기를 보이는 상피하종양으로 관찰된다(Fig. 3). 크기가 커지면서 발적 및 중심부의 함몰이 나타나면 악성도가 증가하는 소견으로 보아야 한다. 진행이 느리기는 하지만 드물게 전이가 생길 수 있는 악성 종양이므로 절제가 필요하다. 십이지장 유암종의 치료는 전이가 없는 10 mm 이하의 종양에서 내시경 초음파 검사상 근층 침범이 없는 경우에 내시경적 절제술을 고려할 수 있으며, 10 mm 이상에서는 위치, 근층 침범 여부에 따라 수술적 치료를 고려한다. 내시경 절제술을 시행할 때는 통상적인 용종 절제술로는 절제면에 유암종이 남아있을 수 있기 때문에, 흡인을 활용하는 밴드 결찰법(endoscopic mucosal resection [EMR] with ligation) 또는 투명캡을 이용한 절제술(EMR with cap) 방법을 고려한다. 십이지장 유암종에 대한 endoscopic submucosal dissection (ESD) 절제는 일괄 절제율이나 절제연 음성 근치적 절제의 확률은 높지만, 십이지장에서의 ESD 술기가 기술적으로 매우 어렵고 천공 등의 합병증 위험성이 상대적으로 높으므로, 매우 숙련된 시술자에 의해서만 제한적으로 시도되어야 한다.
4) 십이지장 간질세포종양(gastrointestinal stromal tumor, GIST)
위장관간질종양(GIST)은 비상피성 종양 중 간엽조직에서 기원하며, 그 빈도는 위가 60% 정도로 가장 많고 소장, 대장, 식도의 순으로 발생한다[17]. 십이자장의 GIST는 대부분 제2부위에서 발생하고 약 50%에서 악성 변화를 보이기 때문에 위에 발생하는 경우에 비해 악성도가 높은 경향이 있다. 정상 점막으로 덮인 전형적인 상피하종양의 형태로 관찰되거나, 발육 속도가 빠른 악성 병변에서는 중심부 궤양 또는 출혈을 동반하기도 한다(Fig. 4). 환자는 대부분 무증상이나 위장관 출혈, 복부 통증 및 등 통증을 호소하기도 한다. 통상적인 내시경 생검을 통해서는 진단율이 낮기 때문에, 의심되면 전산화단층촬영, 내시경 초음파, MRI 등의 추가적인 검사를 시행하는 것이 진단에 도움이 된다[18].
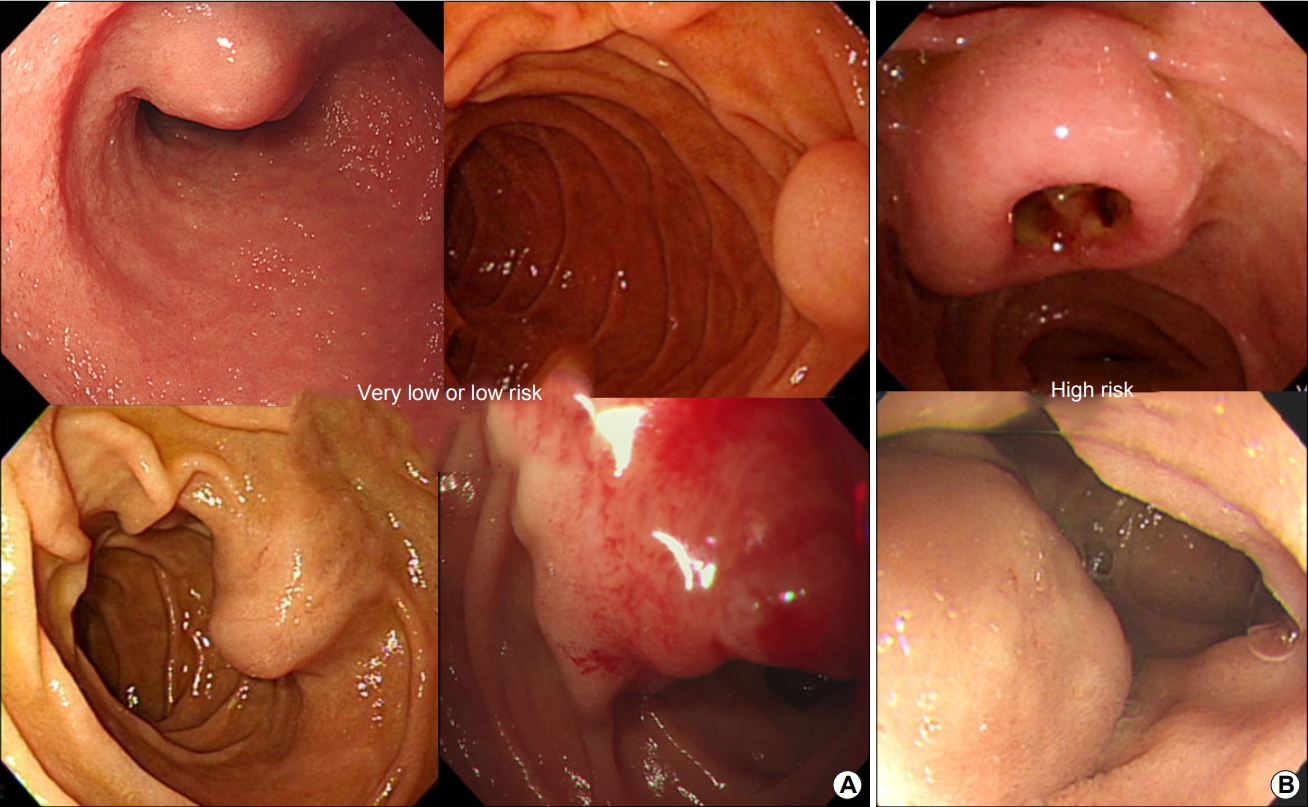
Endoscopic images of duodenal gastrointestinal stromal tumors. (A) Images of four different lesions that are surgically confirmed as showing an extremely low or low risk of a typical submucosal tumor pattern, approximately 2 cm in size. (B) Image showing two different lesions (>3 cm) with an ulcer on the surface, surgically confirmed as high-risk lesions.
5) 십이지장 림프종(duodenal lymphoma)
림프종은 림프절을 제외하면 위장관에 가장 흔히 발생하며 림프절외 림프종의 30~40% 정도를 차지한다. 대부분의 위장관 림프종은 위에 발생하며, 원발성 십이지장 림프종은 극히 드물어서 다양한 조직학적 형태들이 산발적으로 문헌보고되고 있는 정도이다. 가장 흔한 조직학적 유형은 말트 림프종(mucosaassociated lymphoid tissue [MALT] lymphoma)이며 이외 미만성 거대 B세포 림프종(diffuse large B cell lymphoma), 외투 세포림프종(mantle cell lymphoma), T세포 림프종(T-cell lymphoma), 소포 림프종(follicular lymphoma) 등 다양한 조직형에 따라 내시경적 소견도 천차만별이기 때문에 전형적인 내시경적 형태가 있다고 보기는 어렵다. 삼출물을 동반하는 광범위한 미란 형태의 염증형, 작은 용종들이 산재한 형태의 용종형, 궤양형, 결절형 등의 다양한 형태로 관찰될 수 있으며, 의심되는 비전형적인 소견이 있다면 생검을 통해 진단하게 된다(Fig. 5). 위장관 림프종의 치료 전략은 조직형에 따라서 크게 달라지는데, 진행이 느린 저등급 림프종에서 경과 관찰만 시행하는 일명 'watch and wait' 전략으로부터, 헬리코박터(Helicobacter pylori, H. pylori) 제균 치료, 방사선 요법, 화학 요법, 외과적 절제, 면역 요법(예: 리툭시맙) 및 이들의 조합으로 치료한다. 하지만 십이지장 말트 림프종은 위의 말트 림프종과 다르게 H. pylori 감염과 직접적인 관련이 없는 경우가 많아 제균 치료에 반응하지 않을 수 있다. 환자 수가 작아 표준 치료 방법이 정해져 있지 않지만 한 연구에 따르면 십이지장 말트 림프종 환자 4명에게 cyclophosphamide 100 mg을 18개월간 투여하여 이 중 3명에서 내시경적, 조직학적 완전 관해를 이루었고, 2년째에 2명이 재발하여 한 명은 재치료로 3년째에 다시 완전 관해를 이루었으며 나머지 한 명은 임상적으로 안정적이어서 관찰하였다[19]. 또 다른 연구에서는 H. pylori 감염의 증거가 없는 환자에서 림프구 활성화 억제를 위해 clarithromycin을 6개월간 800 mg을 단독 투여하여 완전 관해를 이루어 효과를 입증하였다[20]. 최적의 치료 전략은 침범 부위, 조직학적 유형 및 임상 단계에 따라 결정되어야 하며 질병의 정확한 치료 전 진단이 가장 중요하다[21].
6) 기타 십이지장 용종
전술한 선종과 유암종 이외에, 십이지장에서 내시경 치료를 고려해야 하는 종양성 병소는 드물다. 부르너 과오종(Brunner’s gland hamartoma), 지방종(lipoma), 이소성 위점막(Heterotopic gastric mucosa), 이소성 췌장(heterotopic pancreas, ectopic pancreas) 등이 십이지장 용종 형태로 관찰될 수 있는데, 이러한 기타 용종은 증상을 유발하지 않으면 절제가 필요하지 않지만, 간혹 선종과의 감별이 어려워서 진단적 목적의 내시경 절제술을 시도하는 경우가 있다. 부르너 과오종의 경우 대부분 2 cm 이내의 크기이지만 드물게 5 cm 이상으로 매우 크게 자라는 경우가 있는데, 위배출을 지연하여 증상을 유발하는 것으로 의심되는 경우에는 내시경 절제술을 고려할 수 있다[22].
2. 진단 방법
십이지장 종양은 위내시경을 통해 접근하여 별 어려움 없이 관찰할 수 있다. 크기가 작은 종양은 영상학적 검사에서 발견되지 않기 때문에 맹점을 최대한 줄여 내시경을 진행해야 한다. 상부십이지장각(superior duodenal angle) 원위부 대만측은 각도 변화로 인해 내시경 관찰이 어렵고 맹점이 발생할 수 있다. 따라서 진입 시 뿐만 아니라 후퇴 시에도 신중하게 관찰해야 한다. 하행부에서 구부로 내시경을 후퇴할 때는 진입할 때의 역순으로 조작하는데, 오른쪽으로 비틀었던 내시경의 축을 서서히 왼쪽으로 되돌리면서 내시경은 오히려 약간 밀어 넣는 듯 조작하면, 서서히 하행부에서 구부로 사야를 확보하면서 관찰할 수 있다.
3. 비유두부 십이지장 종양의 치료(management of non-ampullary duodenal adenomas)
2021년도 유럽 소화기내시경학회에 발표된 표재성 비유두부 십이지장 종양의 내시경적 치료 가이드라인에서는 첫 번째로 모든 십이지장 선종은 침윤암으로 진행될 가능성이 있기 때문에 내시경 절제술을 고려하도록 권고하였고, 십이지장 선종이 발견된 환자에서는 진행성 대장 선종의 상대적 위험도가 높기 때문에 대장내시경 검사의 확인도 필요함을 강조하였다. 두 번째로 십이지장 종양의 내시경 치료에 있어서 유두부와의 위치 관계를 명확히 파악하는 것이 중요하기 때문에, 주유두 및 소유두 주변에 위치한 선종은 내시경 선단에 투명캡을 장착하여 관찰하는 것이 도움이 되고, 애매한 경우에는 측시내시경을 이용한 추가 관찰을 권고하였다. 세 번째로 선종이 명백히 의심되는 내시경 소견인 경우에는 추후 내시경 절제술에 방해가 될 수 있는 조직 검사를 굳이 시행하지 않도록 권고하였다. 네 번째로 6 mm 이하의 작은 선종의 경우 저온 올가미 절재술을 고려할 수 있지만, 6 mm 이상의 선종에 대해서는 보편적인 내시경적 점막 절제술을 우선적으로 고려해 볼 수 있고, ESD의 경우 전술하였듯이 대상자를 신중히 선택해 숙련된 전문가에 의해서만 진행하기를 권유하였다. 또한 출혈이나 천공의 부작용을 최소화하기 위한 방안으로, 일괄 절제를 고집하기보다는 계획적 분할 절제를 고려할 수 있고, 절제 후 궤양을 클립으로 봉합하는 것도 합병증 예방에 도움이 될 수 있다. 비유두부 십이지장 종양의 내시경 치료 대상은 아직 가이드라인이 명확하지는 않지만, 현재까지 보고된 연구들에서는 저도 이형성 선종, 고도 이형성 선종, 점막에 국한된 선암을 치료 대상으로 하고 있다[23]. 치료의 방법은 선종의 크기와 위치, 형태, 조직학적 진단에 좌우되지만 대체로 십이지장 선암으로 진행된 것으로 의심되거나 내시경 치료 후 재발된 경우에는 수술적 치료도 고려해야 한다[24].
1) 내시경 치료
비유두부 십이지장 종양의 내시경 절제술의 안정성과 유효성에 대한 연구는 많지 않다. 앞서 설명하였듯이 내시경 치료 전 생검을 이용한 조직학적 진단이 치료 계획 수립에 도움이 되지만 진단적 정확도가 높지 않고 생검으로 인한 섬유화 유발 가능성이 있어 주의가 필요하다. 십이지장 종양의 내시경 치료는 다른 위장관 부위에 비해 특히 합병증의 위험성이 높은데, 해부학적 구조로 인한 내시경 조작의 어려움, 매우 얇은 근층, 절제 부위 궤양이 췌장액과 담즙에 노출되는 점 등이 그 원인이다[25]. 비유두부 십이지장 종양에서 시행할 수 있는 내시경 치료의 종류는 보편적인 EMR, ESD, 아르곤플라즈마소작술(argon plasma coagulation, APC) 등이 있다.
(1) 내시경적 점막 절제술(EMR)
십이지장 종양의 EMR에 관한 14개 연구를 분석한 2016년 체계적 문헌 고찰에서는 총 440명의 환자를 대상으로 평균 6~72개월 추적 관찰하였다. 병변의 크기는 13~35 mm였으며 93%에서 완전 절제(complete resection)가 이루어졌다. 시술 후 출혈은 16%에서 나타났고 천공은 전체 1%에서 발생하였다. EMR 이후 재발은 15% 나타났다. 재발한 용종의 내시경적 절제의 성공률은 62%였고 재발 사례 중 총 3사례는 악성 변화(malignant transformation)한 경우였다[26]. 2019년 한국에서 발표한 연구에 의하면 총 92명의 환자에서 95개의 십이지장 병변이 포함되었으며 이들 중 59명이 EMR을 시도하였다. 병변의 크기는 평균 9 mm였고 EMR을 한 환자에서 일괄 절제율은 83%, 완전 절제는 81%였다. 합병증으로는 각각 5%의 환자에서 출혈과 천공이 발생하였다. 평균 15개월의 추적 관찰 기간 중 EMR을 진행한 사람에서 재발은 없었다[27]. EMR은 20 mm 이하의 십이지장 선종에서 일차적으로 시도해 볼 수 있는 내시경적 치료이나 크기가 클수록 일괄 절제의 가능성이 줄어든다. 하지만 천공의 위험성을 감수하면서 무리한 일괄 절제를 시도하는 것보다는 분할 절제 후 재발 여부에 대해 주의 깊은 추적 관찰을 고려하는 것이 나을 수 있다.
(2) 내시경 점막하 박리술(ESD)
십이지장에서의 ESD는 기존에 소개된 내시경 치료 중 크기가 큰 병변에 대해서도 완전 절제율이 높다는 장점이 있으나 천공도 가장 높게 보고된다. 2014년 일본에서 발표한 비유두부 십이지장 종양에 대한 연구에 의하면 총 13명의 ESD를 진행한 환자를 평균 14개월 추적 관찰하였을 때 이들의 평균 크기는 13.5 mm였고 이들 중 30%인 4명에서 천공이 발생하였으며 재발은 관찰되지 않았다[28]. 2019년 한국에서 발표된 연구에 의하면 총 92명의 십이지장 종양 환자에서 ESD를 진행한 11명의 환자 중 일괄 절제율은 90%로 EMR에서 83%보다 높았고 완전 절제는 80%로 EMR과 유사하였다. 이 연구에서도 천공의 합병증은 APC나 EMR와 비교하여 45%로 높게 나타났다[27]. 십이지장 종양에 대한 ESD 치료는 이와 같이 합병증의 위험이 매우 높기 때문에, 보편적인 EMR 치료로 제거가 불가능한 병변에서 매우 숙련된 ESD 술자에 의해서 선택적으로만 시도되어야 한다.
(3) 저온 용종 절제술(cold snare polypectomy, CSP)
CSP는 고주파 전류를 사용하지 않기 때문에 열손상이 없고 절제면의 깊이가 낮아 10 mm 이하의 대장 용종 절제술에 자주 사용되는 방법으로 출혈 및 천공의 위험이 낮다는 장점이 있다. 2017년 보고된 연구에서는 30명의 환자에서 평균 크기 2~6 mm의 39개의 병변이 CSP를 통해 제거되었으며 30개 중 29개(96.7%) 병변이 CSP를 통해 완전 절제되었다. 지연 출혈이나 지연 천공은 관찰되지 않았으며 3개월 후 추적 관찰에서 국소 재발 소견은 관찰되지 않았다[29]. 2018년 보고된 연구에서는 10명의 FAP 환자에서 10 mm 이하의 332개 십이지장 용종을 CSP로 제거하였고, 큰 부작용이 없었다는 결과를 제시하여, 산발성 십이지장 선종뿐만 아니라 FAP 환자에서 발생한 다발성 선종 제거에도 CSP가 안전하고 적용될 수 있다고 판단된다[30].
(4) 수중 EMR (underwater EMR, UEMR)
수중 EMR (UEMR)은 관강을 물로 채운 뒤, 점막하 주입 없이 올가미 절제술을 시행하는 새로운 개념의 내시경 절제술로 대장에서 먼저 소개되었다[31]. 관강에 물을 채우고 내시경 초음파 검사를 할 때, 점막과 점막하층이 근육층 위쪽으로 부유하는 듯 떠오르는 현상에 착안하여 시행되기 시작하였다[32]. 관강에 물을 채우면 점막과 점막하층은 위의 점막 주름과 유사한 수축을 형성하는 반면, 깊은 근육층은 원형으로 유지되면서 수축을 형성하지 않는다. 관강내 공기를 제거함으로써 장력이 감소되고 벽은 원래 두께를 회복한다. 일단 수중에서 조직의 부력으로 인해 선종의 점막 병변을 고유근층에서 들어올려 점막하 주사의 필요성이 없어지기 때문에 EMR에 비해 더 큰 병변도 일괄 절제가 가능하다. 또한 층의 분리로 근층의 올가미 포획 가능성을 줄이고 관강내 물은 열 손상으로부터 장벽을 보호하는 방열판 역할을 하는 장점으로 인해, 결과적으로 지연 천공과 용종 절제술 후 전기 소작 증후군의 위험을 감소시킨다[33]. 2013년 보고된 11명의 비유두부 십이지장 종양 환자에 대한 UEMR 시술의 결과에서는 중앙값 35 mm의 측방발육형 선종에 대해 11명 모두에서 UEMR로 완전 절제가 가능하였고, 16주 후 추적 검사에서 재발은 없었다. 다만 3명(27%)의 환자에서 지연성 출혈이 발생하였고, 1명의 환자에서 의식 저하와 저나트륨혈증 등의 수분 중독이 발생하였다[34]. 따라서 관강을 채우는 물은 증류수보다는 생리식염수를 고려한다. 2020년 발표된 체계적 고찰 연구에서도 8개 연구를 통한 258개 병변의 UEMR 시술의 결과를 분석하였는데, 평균 크기는 19.4 mm였고, 일괄 절제율은 84.6%, 제거된 병변 중 24.7%가 고도 이형성 샘종 혹은 점막암이었으며, 합병증 발생률은 6.9%였다[35]. UEMR은 20 mm 미만 크기의 비유두부 십이지장 종양의 치료에 기존 EMR보다 일괄 절제율을 높이고, 지연성 천공 합병증 위험을 낮출 수 있는 방법이나 병리학적 완전 절제율이 다른 시술에 비해 낮은 것으로 보고되고 있어 고도 이형성 샘종 및 샘암에서는 다른 방법을 고려해야 한다. 또한 십이이장 구부와 제2부위는 중력의 반대 방향으로 물이 잘 채워지지 않고 다량의 물을 주입하다가 흡인이나 수분 중독증으로 이어질 위험이 있으므로 주의가 필요하다[36].
2) 수술적 치료
수술적 치료는 크기가 크고 내시경적으로 접근이 힘든 경우나 악성이 의심되어 내시경 시술이 부적합한 경우 선택되는 치료법이다. 수술적 방법은 경십이지장 점막하 절제술, 국소전층 절제술, 췌장보존 분절 십이지장 절제술, 췌장십이지장 절제술이 고려될 수 있다[37]. 수술은 내시경적 술기보다 국소 재발의 빈도가 낮고 복강경과 내시경을 이용한 공동 수술(laparoscopic and endoscopic co-operative surgery)을 이용하여 수술 시 혹은 이후 발생할 수 있는 부작용을 줄이고 최소한의 침습적 절제와 안정성을 확보할 수 있다[38].
결 론
비유두부 십이지장 종양은 비교적 드문 질환이지만 근래에 내시경 검진이 보편화되면서 발견율이 증가하고 있다. 십이지장에 발생하는 종양으로 내시경적 치료를 고려해야 하는 경우는 선종과 유암종이 대표적이다. 십이지장 조기암이나 간질세포종양은 악성 종양의 전이 위험성이 있으므로 내시경적 치료보다는 수술적 치료가 우선적으로 고려되어야 한다. 십이지장에서의 내시경적 치료는 매우 신중한 접근이 필요한데, 그 이유로는 첫째, 구조적으로 급격한 각도의 변화를 동반하여 내시경적 접근 각도가 어려운 부위가 많다는 점, 둘째, 십이지장 벽의 두께가 매우 얇고 혈관이 풍부하여 천공과 출혈 위험성이 높다는 점, 셋째, 췌장과 담도의 배액이 이루어지는 유두부가 위치하고 있기 때문에 췌담도 영역의 합병증도 조심해야 한다는 점, 넷째, 내시경 절제술 후 발생하는 의인성 궤양에 췌장액과 담즙이 공격인자로 작용하여 합병증의 위험성을 증가시킬 수 있다는 점, 다섯째, 후복막에 위치한 십이지장에서 합병증이 발생하면 후복막 농양으로 파급되어 치료가 매우 어려워질 수 있다는 점 등을 고려해야 한다. 십이지장 선종의 내시경 치료 후에는 국소재발 여부를 판단하기 위한 추적 내시경을 시행하여야 하는데 유럽 소화기내시경학회의 최근 가이드라인에서는 치료 3개월 후 그리고 이후 1년에 추적 내시경을, 그 이후에는 케이스별로 개별화된 추적 내시경 간격을 권고하고 있다.
Notes
No potential conflict of interest relevant to this article was reported.