위・십이지장 신경내분비종양의 내시경 치료: 현재와 미래
Endoscopic Treatment of Gastric and Duodenal Neuroendocrine Tumors: Present and Future
Article information
Trans Abstract
Gastric and duodenal neuroendocrine tumors (NETs) are not common; however, there is an increase in the incidence due to increased use of endoscopy. Endoscopic treatment has been applied to treat small NET G1 in the stomach and duodenum. For the endoscopic treatment of NETs, it is necessary to evaluate tumor size, depth of invasion, and lymphatic and distant metastasis. This article will review the current knowledge concerning the endoscopic treatment of gastric and duodenal neuroendocrine tumors.
서 론
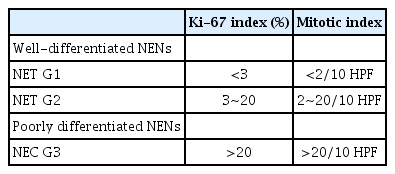
신경내분비종양은 호르몬을 생성하는 내분비 표현형과 생체 아민(biogenic amine)을 분비하는 신경 표현형을 모두 갖는 신경내 분비세포에서 발생하는 종양을 의미한다. 1907년 Orberndorfer에 의해 느린 성장을 보이며 양성과 악성의 중간 단계의 종양이라는 의미로 유암종(carcinoid)이라 보고된 이후, 2010년 세계보건기구(World Health Organization, WHO)에 의해 신경내분비세포에서 기원하여 악성 혹은 양성의 성질을 갖는 종양을 통칭하는 병명으로 분류되었다[1,2]. 과거에는 신경내분비종양을 발생학적 기원에 따라 폐, 흉선, 위, 십이지장, 근위부 소장 및 췌장을 포함하는 앞창자(foregut), 원위부 소장, 충수돌기, 맹장을 포함하는 중간창자(midgut) 그리고 결장과 직장을 포함하는 뒤창자(hindgut)의 신경내분비종양으로 분류하였으나 2017년 WHO에서 종양의 악성화 경향과 예후 등을 반영하는 등급에 의해 신경내분비종양을 분류하였다(Table 1) [3].
위장관에서의 신경내분비종양은 흔하지 않은 질환으로 소장에서 가장 많이 발생하고 직장, 충수돌기, 대장과 위의 순으로 발생 빈도를 보이는 것으로 알려져 있다[4]. 그러나 최근 내시경 접근성이 높아지고 내시경 진단 및 술기가 발전되면서 위와 십이지장에서의 신경내분비종양의 진단이 증가하고 있다[5,6]. 이번 글에서는 위와 십이지장에서 발생하는 신경내분비종양과 내시경 치료에 대해서 알아보고자 한다.
위 신경내분비종양의 특성
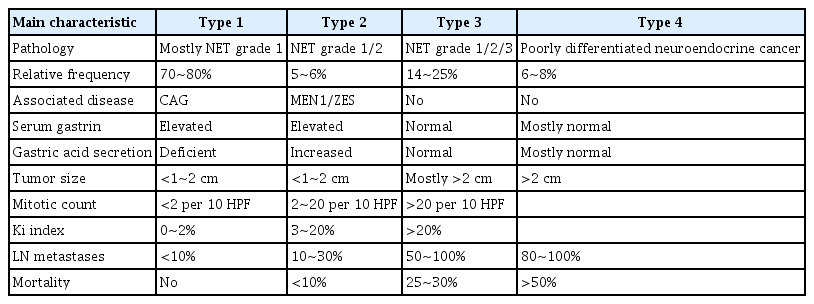
위 신경내분비종양의 발생은 전체 위장관 신경내분비종양의 5.2~11%를, 전체 위 종양의 0.3~1.8%를 차지하는 것으로 보고되고 있다[7,8]. 위 신경내분비종양은 3가지의 아형으로 분류되는 위 유암종과 저분화 신경내분비암으로 구분되는데 그 특성에 대하여 Table 2에 간략히 정리하였다[8-13]. 1형과 2형은 장크롬화 유사세포(enterochromaffin like cells)에서 기원한다. 1형이 가장 흔한 형태로 혈중 가스트린 수치의 상승과 만성 위축성 위염과 동반되고 주로 1~2 cm의 다발성 병변으로 나타나며 조직학적으로 고분화 등급이다. 주로 점막하층 이내에 국한되어 있고 5~10%의 림프절 전이와 2~5%의 간 전이가 보고된다. 2형은 다발성 내분비샘 종양 1형(multiple endocrine neoplasia type 1)의 한 부분인 가스트린종과 연관되어 발생할 수 있고 혈중 가스트린 수치의 상승을 보이며 대부분 다발성으로 1 cm 미만의 병변으로 관찰된다. 점막하층 이내에 국한된 경우가 대부분이고 고분화 등급의 조직 소견을 보이며 10~20%의 림프절 전이와 10%의 간 전이가 보고된다 [10]. 1, 2형과는 달리 3형은 어떠한 위 병변과의 관련성을 보이지 않으며 혈중 가스트린 수치도 정상이다. 주로 2 cm 이상의 단발 병변으로 나타나고 위벽의 침윤 형태가 다양하여 고유근층이나 혈관 침범이 흔하고 진단 당시 50~100%의 림프절 전이와 22~75%의 간 전이가 동반되는 것으로 보고된다[14]. 저분화 신경내분비암은 장크롬화 유사세포의 형태가 아닌 소세포 또는 대세포 신경내분비암으로, 진단 당시 대부분 4 cm 이상의 단발성 궤양형 종괴로 관찰되고 광범위한 전이를 동반한 진행 병기에 발견된다[13].
위 신경내분비종양의 내시경 치료
위 신경내분비종양은 종양의 아형, 분화 등급, 침윤의 범위와 치료 후 예후에 따라 다른 치료 접근이 필요하다. 불량한 예후인자로 병변의 크기가 2 cm 이상, 점막하층 이상의 침범, 3% 이상의 Ki-67 수치, 혈관 침범, 이형성이나 괴사의 존재 및 분화도가 좋지 않은 경우 등이 있다[15]. National Comprehensive Cancer Network (NCCN) 가이드라인에 따르면 1형과 2형의 위 신경내분비종양에 대하여 2 cm 이하의 단발성 혹은 다발성 병변에 대해서는 1) 내시경 절제와 종양 및 종양 주변 점막의 조직검사, 2) 추적 관찰, 혹은 3) 가스트린종과 졸링거엘리슨 증후군에 대한 증상 조절을 치료 선택 사항으로 권고하고 있고 2 cm 이상인 경우 내시경이나 수술적 방법을 통한 절제를 권고하고 있다. 3형 위 신경내분비종양에 대해서는 위 근치 절제와 임파선 절제를 권고하며 2 cm 미만일 경우 내시경 절제 혹은 수술적 쐐기 절제도 고려할 수 있다고 하였다[16].
1. 1형 위 신경내분비종양
과거에는 1형 위 신경내분비종양에 대해서도 위 절제술을 시행하였으나 현재는 1형 종양의 경우 분화도가 좋고 매우 좋은 예후를 가지고 있어 대부분의 병변에 대해서 내시경 절제를 시행하고 있다[17-19]. 내시경 점막 절제술(endoscopic mucosal resection)이 병변의 완전 절제를 위하여 내시경 치료법으로 널리 사용되고 있다[20]. 병변의 상태에 따라 내시경 점막 절제술로 완전 일괄 절제가 어려울 경우 내시경 점막하 박리술(endoscopic submucosal dissection)이 안전한 치료를 위하여 권고된다[21]. 외과적 수술이 필요한 경우로 내시경 절제가 불가능하거나 깊은 침윤이 있는 경우, 병변의 등급이 높은 경우, 동시성 위암이 있는 경우, 내시경 치료 후 변연의 침범이 있거나 재발한 경우, 점막하층 이상의 침윤을 보이거나 림프절 침범 소견이 의심되는 경우들이 거론되고 있다[22-24]. 그러나 불량한 예후인자가 있는 경우 수술적 치료를 하는 것이 최선인가에 대한 명확한 근거는 없는 상태이다. 최근의 메타분석에서 내시경 치료 후 22%(n=72/328)에서 국소 재발이 있었으나 수술 치료와 비교하여 통계학적 차이를 보이지 않았고 5년 질병특이생존율(disease-specific survival rate)은 림프절 전이 여부와 상관 없이 100%로 보고하였다[19]. 침윤이 깊은 병변이나 위 주변 림프절 전이가 의심될 때는 위암 치료에서 연구되고 있는 내시경과 복강경의 병합 절제술(laparoscopic and endoscopic cooperative surgery)을 미래 치료법으로 기대해 볼 수 있다. 실제로 최근 종양의 침윤이 깊었던 병변에 대하여 내시경과 복강경의 병합 절제술의 증례 보고가 있었다[25]. 앞으로 1형 위 신경내분비종양 환자에 대한 최선의 치료를 위한 예후와 관련하여 추가적인 연구가 필요하겠다.
2. 2형 위 신경내분비종양
2형 위 신경내분비종양의 림프절 침범과 전이의 위험도가 1형에 비하여 높기 때문에 모든 2형 종양에 대해서는 절제가 권고된다. 국소 병변에 대해서는 내시경 절제를 시행할 수 있고 침윤성 또는 전이성 병변에 대해서는 수술을 시행한다[24,26]. 가능하다면 가스트린종에 대한 절제가 필요하고 내과적 치료가 권고된다.
3. 3형 위 신경내분비종양
3형 위 신경내분비종양은 다양한 조직학적 등급과 분화도를 가질 수 있으나 G3 종양이 흔하고 예후가 불량하여 사망률이 22~30%에 달하는 것으로 알려져 있다[27]. 그러므로 림프절 곽청술(lymph node dissection)과 위 절제술과 같은 적극적인 수술 치료를 권고하고 있다. 또한 전이 부위의 병변에 대해서도 가능하다면 절제를 해야 한다. 이러한 이유에서 과거에는 3형 위 신경내분비종양의 치료에 있어 내시경 치료는 권고되지 않았으나 앞서 언급한 대로 최근 권고안에서는 2 cm 미만의 종양에 대해서는 내시경 치료를 고려해 볼 수 있다고 하였다[16]. 국내의 연구에서 2 cm 미만의 림프 혈관계 침윤을 보이지 않는 3형 위 신경내분비종양 환자 50명을 대상으로 내시경 절제를 시행 후 43개월 동안 추적 관찰하였다[28]. 완전 절제율은 80%였고 내시경 점막 절제술이나 내시경 점막하 박리술 등 내시경 절제 방법에 따른 차이는 보이지 않았다. 추적 관찰 기간 중 재발이나 사망은 보고되지 않아 2 cm 미만 림프 혈관계 침범이 없는 점막하층에 국한된 3형 위 신경내분비종양에 대한 초치료로 내시경 절제의 안전성을 제시하였다. G1 종양에 대해 내시경 치료를 받은 22명의 환자들을 대상으로 한 국내의 연구에서도 59개월의 추적 관찰 기간 1.5 cm 이상의 종양 크기를 보였던 한 환자에서만 림프절에서 재발이 관찰되었다. 최근 일 본에서 내시경 치료(n=63)와 수술 치료(n=81)를 받은 3형 위 신경내분비종양 환자들을 대상으로 연구를 진행하였다[29]. 전이 여부가 확인된 93명의 환자 중 15명(16%)에서 림프절 전이가 확인되었다[30]. 림프절 전이는 종양의 크기, 침윤 깊이 및 종양의 등급과 연관이 있었으며, 종양의 크기가 5 mm 이하, 점막하층 이내에 국한된 G1 종양에서는 림프절 전이가 관찰되지 않았다. 내시경 치료만 받은 48명의 환자 중 1명에서 재발이 있었지만 연구 기간 중 사망은 관찰되지 않았다. 이러한 연구들을 근거로 최근 한국과 일본에서는 작은 3형 위 신경내분비종양에 대하여 내시경 치료를 시행하고 있으나 안전한 치료를 위해 명확한 내시경 치료의 적응증이 필요할 것으로 생각되어 이를 위한 대단위 전향 연구가 필요하겠다.
십이지장 신경내분비종양의 특성
십이지장 신경내분비종양은 전체 위장관 신경내분비종양의 2~3%에서 발생하고 원발성 십이지장 악성 종양 중 3%를 차지하며 주로 단일 무경형 용종의 형태이고 십이지장 제1부와 제2부에서 대부분 발견된다[6,31,32]. 병리학적으로 가스트린 분비 신경내분비종양(48%), 소마토스타틴 분비 종양, 신경절세포부신종양, 비기능성 신경내분비종양과 신경내분비암 등 다양한 형태로 보고된다[33]. 십이지장 신경내분비종양의 1/3에서 증상 없이 내시경 검사 중 우연히 발견되고 그 밖에 통증, 황달, 구역 구토, 출혈, 폐쇄의 증상으로 나타날 수 있다[34]. 진단 당시, 75%에서 2 cm 미만의 작은 종양으로 발견되나 40~80%의 국소 림프절 전이가 보고된다[35,36]. 십이지장 신경내분비종양은 해부학적인 위치에 따라 유두부 주위 종양과 비유두부 종양으로 구분할 수 있다. 유두부 주위 신경내분비종양은 발견 당시 종양의 크기가 크고 분화도가 좋지 않으며 림프절 전이가 많아 예후가 불량한 것으로 알려져 있다[37].
십이지장 신경내분비종양의 내시경 치료
내시경 치료의 적응증에 대한 명확한 기준은 정해져 있지 않으나 NCCN 가이드라인에 따르면 십이지장의 신경내분비종양은 국소 병변일 경우 가능하다면 내시경 절제가 우선적으로 고려되어야 하며 내시경 절제가 불가능한 경우에 한하여 수술 방법을 통한 국소절제를 권고하고 있다[16]. European Neuroendocrine Tumor Society 가이드라인에서는 2 cm 이상의 종양, 점막하층 이상의 침범이 있거나 전이가 있는 경우와 유두부 주위 신경내분비종양에 대해서는 수술 치료를 권고하고 있다[21]. 전이에 대한 위험인자로는 고유근층의 침범, 크기가 큰 종양(>1~2 cm) 및 분화도가 좋지 않은 병리 소견 등이 제시되고 있다[34]. 그러므로 1 cm 미만의 점막하층 내에 국한되어 있는 병변이 내시경 치료의 대상으로 여겨지고 있다.
내시경 치료는 병변의 위치, 크기 및 시술자의 숙련도에 따라 내시경 점막 절제술, 내시경 점막하 박리술, 단순 용종 절제술, 밴드 결찰 후 점막 절제술 등 다양한 내시경 절제 방법이 적용되고 있다. 2010년대 초반 일본에서 십이지장 신경내분비종양의 내시경 절제에 대하여 15예 미만의 소규모 연구들이 산발적으로 보고되었다[38-40]. 연구들은 크기가 작은 십이지장 신경내분비종양에 대해서 내시경 치료를 적용할 수 있음을 제시하였고 천공의 위험성이 높음을 보고하였다. 국내의 연구에서는 41예의 1 cm 미만 십이지장 신경내분비종양에 대하여 내시경 절제술을 시행하였고 40예에서 완전 절제를 할 수 있었다[41]. 내시경 절제 방법에 따른 완전 절제에는 차이를 보이지 않았고 천공 등 심각한 합병증은 발생하지 않았으며 17개월의 추적 관찰 중 재발은 관찰되지 않았다. 최근 일본에서 2 cm 미만의 십이지장 신경내분비종양 33예에 대하여 단순 용종 절제술과 내시경 점막 절제술을 비교한 연구가 있었고 완전 절제율은 각각 86%와 68%였으며 재발률은 14.3%와 17.7%를 보고하였다[42]. 비유두부 십이지장 신경내분비종양의 치료에 대한 최근 국내 다기관 연구에서 크기가 11 mm 이상인 종양은 내시경 절제를 할 경우 병리학적 완전 절제율이 낮으므로 수술적 치료를 권고하였다[43].
현재까지 십이지장 신경내분비종양의 내시경 치료에 대한 연구들은 대부분 소규모 후향적 연구이고 치료의 성적이 일관적이지 않으며 장기 예후에 대한 결과가 부족한 실정이다. 그러므로 내시경 치료의 적응증 확립을 위한 대단위 전향적 다기관 연구가 필요하다. 또한, 내시경적 치료 접근이 어려운 병변이나 큰 종양 및 깊은 침윤이 예상되는 병변들에 대한 치료 방법의 개발 또한 필요하겠다. 최근의 증례들에서 내시경 치료가 기술적으로 어려운 병변과 깊은 침윤이 예상되는 병변에 대한 내시경과 복강경의 병합 절제술을 통한 성공적인 치료를 보고하였다[44,45].
결 론
상부위장관 신경내분비종양은 내시경 검사의 수요가 많아지면서 임상에서 접하는 빈도가 많아지고 있으나 종양에 대한 치료 방법 결정이 쉽지 않고 특히 크기가 비교적 작은 병변에 대한 치료 선택에 있어 내시경 치료가 적합한지에 대한 고민이 있을 수 있다. 적절한 내시경 치료를 위해서는 병변의 크기, 침윤 정도 및 림프절과 원격 전이에 대한 정확한 평가가 필수적이다. 현재까지 시도되고 있는 내시경 절제 방법들은 제시되고 있는 적응증 범위에서 대부분 안전한 치료법으로 인정받고 있으나 정확한 적응증과 예후에 대한 추가적인 연구가 필요하다. 새로운 치료법으로 종양의 크기가 크거나 침윤이 깊은 병변, 내시경 치료의 접근이 어려운 병변에 대하여 내시경과 복강경의 병합 치료를 통한 전층 절제술이 보고되고 있다. 또한 심부 절제 변연을 확보하기 위하여 직장 신경내분비종양의 치료에 시도되고 있는 내시경 점막하 터널 절제술(submucosal tunnel endoscopic resection)도 상부위장관 신경내분비종양 치료에 적용해 볼 수 있을 것이다[46]. 앞으로 진단 장비와 내시경 술기의 발달로 안전한 새로운 내시경 치료법들이 개발될 것으로 기대한다.
Notes
No potential conflict of interest relevant to this article was reported.