 |
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 22(4); 2022 > Article |
|
Abstract
Ampullary tumors originate from the ampulla of Vater and are often discovered incidentally during an upper endoscopy. These tumors usually occur sporadically and may be benign or malignant in nature. Tumor growth clinically presents with cholestasis, pancreatitis, and bleeding. Patients with ampullary adenomas are often asymptomatic; however, removal of these lesions is recommended in view of their malignant potential. Following advances in endoscopic techniques and the accumulation of experience, considering high recurrence, mortality, and morbidity rates associated with surgery, endoscopic papillectomy may be useful as first-line treatment for adenomatous lesions with ambiguous malignant changes or focal intraepithelial carcinoma. Although it is relatively safe and easy to perform, the operation is a high-level procedure that may be associated with serious complications. It should be performed by an experienced endoscopist at a well-equipped hospital/center with emergency facilities and support personnel. Accurate resection is associated with high treatment success rates. Most complications are mild and can be treated medically. Pancreatitis is the most common complication, and pancreatic duct stenting is useful for prophylaxis. Recurrence may occur, and is more frequently observed during segmental resection; therefore, close periodic follow-up is essential. Although there are no unified indications or guidelines for endoscopic papillectomy, endoscopic papillectomy may be safe and effective for management of ampullary adenomas. Careful patient selection and follow-up are mandatory.
십이지장 유두부 주변은 해부학적으로 유두팽대부, 원위부담관, 십이지장 제2부, 췌장두부로 이루어져 있는 복합적인 구조다. 유두팽대부에서 발생하는 종양은 부검에서 0.04~0.12% 정도로 보고되는 드문 질환이나[1] 가족성 용종증처럼 유전적인 소인이 있는 경우 많이 발생한다[2]. 내시경 검사의 증가와 전산화단층촬영과 같은 영상학적 검사의 증가에 따라 무증상의 유두팽대부 종양의 발견도 증가하고 있다[3]. 유두팽대부 종양은 원위부담관과 췌관의 합류점의 원위부에서 발생하며, 팽대부 내부의 표층세포에서 시작하여 팽대부의 폐쇄를 일으키며, 점차 인접한 담관이나 췌관을 막게 되어 담즙정체나 췌장염, 출혈 등의 증상을 일으킨다. 대부분의 유두팽대부 종양은 산발적으로 발생하며 주 유두부에서 전암성 병변으로 발견된다. 선종성 병변은 조직학적으로 유두팽대부 내에서 십이지장에 가까이 위치하고 있는 장형 점막에서 발생한 것과 더 깊은 곳에 위치한 췌장담관에 접하는 췌담관형점막에서 발생한 것으로 구분할 수 있다[4]. 장형점막에서 발생한 유두팽대부 종양은 대장선종과 마찬가지로 선종-암종 과정의 발생 경과를 보인다[5-7]. 그에 반하여 췌담관형에서 발생한 종양은 상대적으로 임파선 침범, 혈관 침범이 많고, 종양의 국소 침범이 더 많아 나쁜 예후를 나타낸다[8]. 유두팽대부 종양은 절제가 가장 좋은 치료이며, 진행된 병기는 재발과 관련이 많으므로[9] 조기 발견 및 절제가 좋은 예후를 보장할 수 있다.
진행된 유두부암의 수술적 치료는 유두팽대부와 십이지장, 원위부 담관, 췌장두부의 광범위 절제를 동반하는 십이지장췌장 절제술이 전통적인 수술법이며, 재발률은 낮으나 비교적 높은 술 후 사망률(2.1~10%)과 이환율(52.2%)을 동반한다[9-12]. 한편 유두부암은 고령 환자에서 많이 발생하며, 전암성 병변 및 조기암 병변을 위하여 광범위 절제술을 시행하는 것은 과도한 치료가 될 수도 있다. 이러한 광범위 절제술의 단점을 극복하고자 국소 절제법인 경십이지장 유두절제술과 같은 최소침습적 수술법도 시도되었고, 전암성 병변과 조기암의 경우 절제성공률이 61~92%, 재발률이 0~33%, 사망률이 0.3~7%로 좋은 성적을 보고하였다[13,14].
내시경 유두절제술은 처음 보고된 이래로 전암성 병변의 치료법으로 이용될 수 있음을 알게 되었으며[15,16], 이후 많은 연구에서 완치적 목적으로 내시경 유두절제술이 시도되었으며, 시술성공률 61~92%로 좋은 결과를 보여주었다[1,17-26]. 그리하여 현재는 수술적 치료의 높은 합병증과 이환율로 인하여 전암성 병변의 경우 내시경 유두절제술을 일차적 치료 방법으로 고려한다. 그러나 아직도 내시경 유두절제술에 대한 논란, 즉 시술과 관련된 합병증, 불완전 절제 가능성, 겸자생검법으로 발견되지 않는 침윤성 암의 가능성[27], 담관이나 췌관 내로의 침범에 따른 재수술 필요성 등에 대한 해결과제가 남아 있다. 따라서 이 종설에서는 유두팽대부 종양의 내시경 치료에 대하여 알아보고자 한다.
선종성 병변이 발견되었을 때 추적 관찰 또는 절제술을 시행할 지에 대한 합의는 아직 없지만, 선종성 병변이 조직학적으로 확인되기 전에는 진단 및 치료적 목적의 유두절제술은 권고하지 않는다[28]. 내시경 절제는 병변의 완전한 일괄 절제를 목표로 하며, 이를 위해서는 수평 및 수직 절제면에서 병변이 발견되지 않아야 한다. 일부 측방발육된 큰 병변에서는 부분 절제를 시도할 수도 있으나 재발률이 높아지는 단점이 있다. 2015년 발표된 미국소화기내시경학회 권고안에서는 고도 이형성이 포함된 병변이 관찰된다면, 병소에 악성 세포가 포함되어 있을 가능성과 장차 악성으로 진행하는 것을 막기 위하여 내시경 절제를 하는 것을 추천하였다[29]. 일부 예외적으로 선암으로 진행하였더라도 내시경 절제술을 시도하기도 하지만 통상적으로 적용하기에는 무리가 있다.
육안 소견에서 궤양이 있거나 병변의 연약성(friability)이 높아 쉽게 출혈을 하면 선암으로 진행되었을 가능성이 크므로, 조직 검사에서 악성 세포가 보이지 않더라도 적극적인 수술적 치료를 고려하여야 한다. 병변의 점막하 침범이 의심된다면 수술적 절제를 권한다. 고도이형성증이나 상피내암(high grade intraepithelial neoplasia/in situ tumor, HGIN/Tis) 또는 국소 침범 T1암(점막내암이면서 크기가 선종의 1/4보다 작은 암)을 대상으로 내시경 절제를 시행한 군(23명)과 HGIN/Tis 또는 T1암에 대하여 광범위 절제를 시행한 수술군(60명)을 대상으로 종양의 국소 침범 유무와 재발 유무에 관한 후향적 연구를 보면, HGIN/Tis군에서는 임파-혈관 침범이나 임파선 전이가 없었고, 내시경 절제술을 시행한 환자를 평균 27개월을 관찰하였을 때 재발이나 사망이 없었다. 또한 수술을 시행한 T1암에서는 10.7%의 임파선 전이와 17.9%의 담관 침범이 관찰된 반면에 국소 침범 T1암에서는 임파-혈관 침범이나 임파선 전이도 관찰되지 않았다. 내시경 절제를 시행한 focal T1 cancer 환자를 평균 32개월을 관찰하였을 때 암의 재발이나 암과 관계된 사망도 없었다[29]. 따라서 내시경 절제는 전암성 병변이나 상피내암을 대상으로 하고, 수술적 치료에 위험성이 큰 환자에서는 국소 침범 T1암이 경우 내시경 절제를 고려해 볼 수 있겠다.
유두팽대부 종양의 적절한 치료를 위하여 정확한 시술 전 평가가 필요하다. 이를 위하여 내시경을 통한 육안적 평가와 병기 설정을 위한 내시경초음파(EUS), 전산화단층촬영(CT), 자기공명담관조영술(MRI/MRCP) 등이 필요하다.
상부위장관 내시경 검사를 통한 유두팽대부 종양의 관찰은 유두팽대부가 십이지장 제2부 내측벽에 위치하므로 관찰이 안될 때가 있다. 이런 경우 내시경의 선단에 투명캡을 장착하여 벽면을 밀면서 관찰하면, 점막과 내시경렌즈 사이의 공간 때문에 시야가 원활하게 유지되어 병변을 더 잘 관찰할 수 있다. 측시경인 십이지장경(ERCP)을 사용하면 정면상으로 병변을 정확하게 관찰할 수 있다(Fig. 1). 십이지장경으로 유두괄약근 절개술도 가능하고, 담췌관조영술을 통하여 병변의 담관내 침범 범위도 확인할 수 있다. 또한 첨단기법인 확대내시경이나 영상증강 기술이 포함된 내시경을 이용하면 병변의 분포와 양성 또는 악성의 구별에 더 도움이 된다[28,30]. 이론적으로 유두팽대부 종양은 팽대부 내부에 국한되어 있을 때 발견될 수도 있고, 더 진행하여 십이지장이나 담췌관으로 확장되어 발견되기도 한다. 따라서 유두팽대부 종양은 육안적으로 볼 때 3종류로 구분될 수 있다. 즉 정상 점막에 둘러싸여 있으며 종양은 보이지 않으나 팽대부만 돌출된 형태(non-exposed protruded), 육안적 선종이 관찰되면서 돌출한 형태(exposed protruding), 궤양 형태(ulcerating)이다(Fig. 2).
유두부 종양이 양성을 시사하는 소견으로는 경계면이 규칙적이고 부드러우며, 움직임이 부드럽거나 접촉하였을 때 출혈이 덜 생기는 경우이나, 악성을 시사하는 소견으로는 궤양이 관찰되거나 쉽게 출혈하거나 딱딱하거나 점막하 침범을 보이는 경우이다. 때로는 육안적 소견으로 악성과 양성과의 차이가 구분이 안 될 수가 있어 치료 방침의 결정을 위하여 조직 검사가 필요하다. 조직 검사는 췌장염을 예방하기 위하여 가급적이면 췌관 입구와 먼 곳에서 시행한다. 조직 검사는 선종일 경우 90% 이상의 양성률을 나타내나, 악성의 경우 30% 가량에서 위음성으로 나타나기도 한다[31]. 이를 극복하기 위해서 조직 검사시 병변 채취를 많이 하거나 재검사가 필요하기도 하다. 정상 점막에 의해 싸여 있으면서 팽대부만 돌출된 형태의 유두팽대부 종양은 조직 검사로 진단이 되지 않기에 유두절제술 이후에 조직 검사를 하면 진단율을 높일 수 있으나, 일부에서 완전 절제 후 조기 간전이 발생이 높아진다는 보고가 있어 유두팽대부종양에서 무분별한 유두괄약근 절개술은 주의가 필요하다[32].
EUS와 담관초음파(transpapillary intraductal ultrasound, IDUS)는 7.5~12 MHz, 12~20MHz의 파장을 이용하여 종양의 관내 침범 정도와 유두부 주위 및 임파선, 인접장기의 침범 유무를 확인할 수 있는 좋은 도구이다[33,34]. 유럽소화기내시경학회에서는 일반적인 조직 검사가 유용하지 않을 때 EUS를 이용한 조직 검사가 도움이 되며, EUS는 MRCP 만큼 유두부 병변의 담췌관으로의 관내 침범 유무를 확인할 수 있다는 점에서 EUS와 MRCP의 유용성을 강조하고 있다[28]. 2015년 발표된 미국소화기내시경학회의 권고안에서는 1 cm 미만의 작은 병변이나 암성 변화가 없어 보이는 경우에는 시술 전 EUS가 꼭 필요하지 않다고 하였으나[29], 최근 발표된 유럽소화기내시경학회의 권고안에서는 가급적이면 EUS의 시행을 권한다[28].
십이지장 주유두부의 선종은 산발적으로 발생하나 가족성 선종성 용종증(familal andenomatous polpyposis, FAP)의 경우와 동반되어 발생하기도 한다. 따라서 유두팽대부 종양이 발견된다면 대장내시경을 시행하여 FAP가 동반되어 있는지에 대한 평가가 필요하다[37]. FAP는 유전적 소인을 강하게 나타내며 일반인보다 유두부암의 경우 120배, 십이지장암은 300배 더 많이 발생한다[38]. FAP에서 십이지장암이나 유두부암이 발생할 가능성은 약 4% 가량 되므로[39], 대장내시경을 시행하여 FAP가 의심된다면 십이지장이나 유두부의 종양 유무를 확인할 필요가 있다. FAP에서는 다양한 크기의 선종이 십이지장과 유두부에서 다발적으로 발생 가능하며, 크기가 작은 경우에는 암성 변화가 상대적으로 적고, 비교적 천천히 자라 시간적 여유가 있기에 비교적 악성 변화 가능성이 큰 병변(1 cm 이상)을 중심으로 절제하는 것이 효과적이다[28,40,41].
통상적으로 십이지장경을 이용한다. 일반공기를 사용하기도 하나 이산화탄소를 사용하면 빠른 흡수로 인하여 장관팽창이 덜하며, 시술 후 복통이나 불편감이 덜하고, 천공이 일어났을 경우 복강내 공기압의 빠른 감소를 유도한다[42].
전기 소작기는 점막 절제술 및 용종 절제술에 많이 사용되는 고주파단펄스절단 및 응고파를 많이 사용한다. 병변 절제를 위해서는 적당한 크기의 전기통전되는 용종 절제용 올가미가 필요하며, 시술 후 괄약근 절개를 위하여 당김형 절개도와 유도철사도 필요하다. 시술 후 지혈 가능성을 대비하여 지혈겸자, 지혈용 클립을 미리 준비하는 것이 좋다. 일부 거대한 측방발육형 종양의 절제를 위한 주입 카테터가 필요할 수 있으며, 주입용 용액(생리식염수, 색소, 희석된 에피네프린)도 같이 준비한다. 시술관련 췌장염을 예방하기 위한 췌관 스텐트를 미리 준비한다. 일부에서는 절제된 조직을 회수하기 위해 그물 올가미를 따로 준비하기도 하나, 절제에 사용한 올가미로 포획하여 회수할 수 있다.
ERCP 시술처럼 환자를 엎드리게 한 후 우측을 보도록 자세를 위치시킨 후, 생체활력징후를 관찰하면서 산소공급과 함께 진정 유도를 시행한다. 이후 내시경을 삽입하여 병변을 관찰하면서 절제하기에 적절한 위치를 잡고 병변을 관찰한다.
내시경 점막 절제술에서처럼 일부에서는 유두절제술을 시행하기 전 유두부 점막하에 용액을 주입하는 경우가 있으나 이것이 더 좋은 결과를 보장하지는 않는다[43]. 그러나 유두부 주위로 측방발육이 많이 된 경우에는 측방발육 부분에 점막하 주입을 시행한 후 절제하는 것이 안전하다.
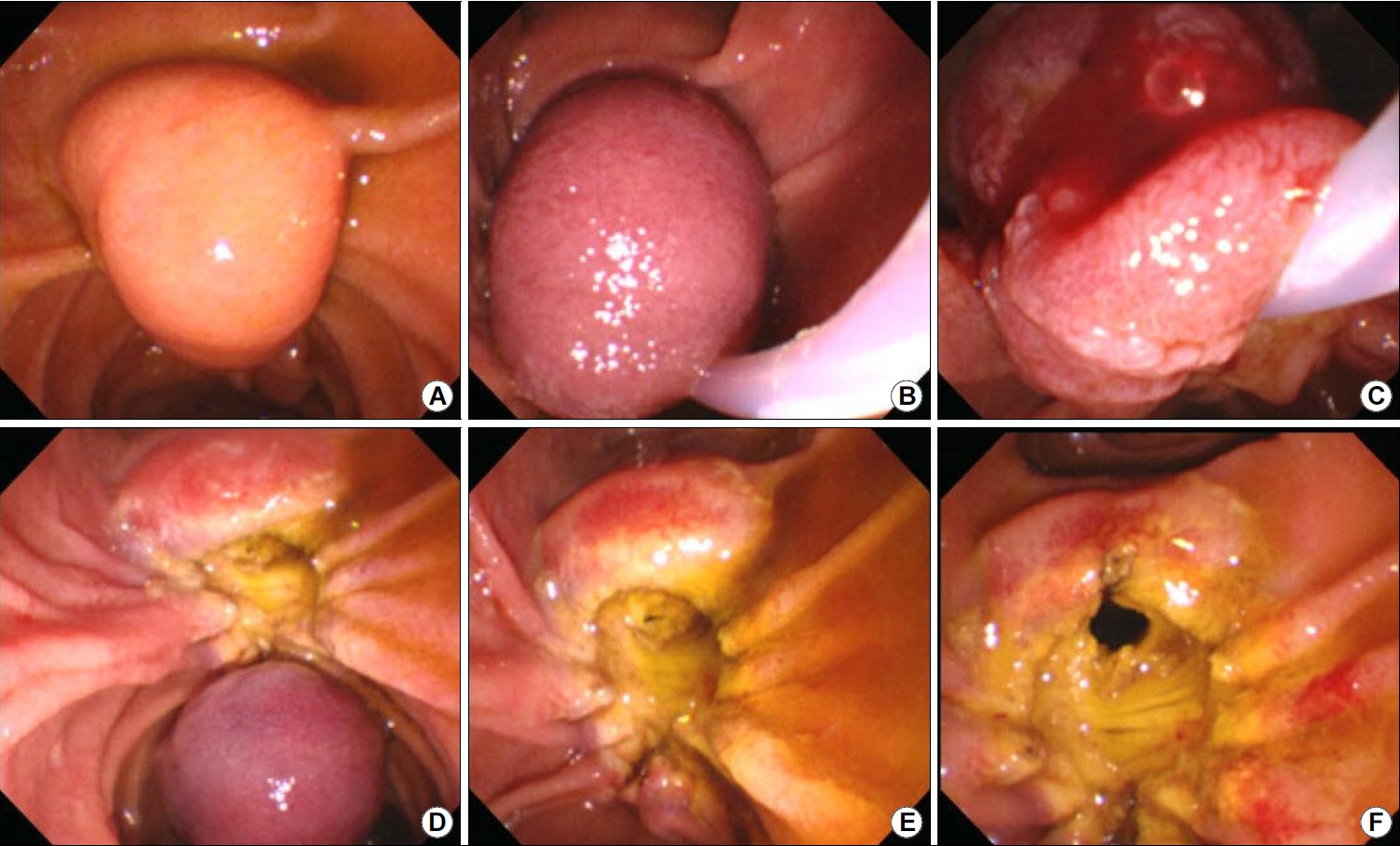
전기소작기와 용종 절제용 올가미를 이용하여 유두부 선종을 절제한다. 절제하고자 하는 병변의 크기에 맞은 올가미가 필요하며, 때로는 담관 내의 병변을 제거하기 위해서는 더 작은 크기의 올가미도 필요할 수 있다. 병변을 올가미로 포획하는 방법도 정해져 있지 않으나 구측에서 항문측, 또는 항문측에서 구측 중 시술자의 선호도와 병변에 따라서 적절하게 응용할 수 있다. 올가미로 포획할 때는 올가미를 십이지장벽으로 약간 누르는 느낌으로 밀면서 포획하여야 병변 전체를 한번에 잡기에 수월하다. 병변을 한번에 포획하여 일괄 절제하는 것이 시술시간도 줄일 수 있고 조직 검사에서 전 병변을 관찰할 수 있어 완전 절제 유무를 파악하는 데 도움이 된다. 그러나 2 cm 이상의 큰 병변인 경우에는 천공의 가능성을 줄이기 위하여 “계획적 부분 절제”를 시도하는 것도 도움이 된다. 사용하는 전류파에 관하여는 합의점은 없으나 순수절개파나 혼합파를 사용하여 절제한다(Fig. 3).
간혹 술 전에 담관내 침범이 확인되었으나 환자 요인에 의하여 수술적 절제가 곤란한 경우도 있고, 내시경 절제 후에 담관내로 종양 침범이 확인되는 경우가 있다. 내시경 절제술 후 잔존 병변이 발견된 9명에 대하여 고주파소작술(radiofrequency ablation, RFA)을 시행한 후 21개월 동안 추적 관찰한 성적을 보면, 100%의 시술성공률과 67%의 무재발률을 보고하였다[44]. 10명에 대하여 253일을 추적 관찰한 국내 보고에서도 추가적 수술이 필요한 경우는 10%에 불과하였다[45].
절제된 조직은 환자의 자세로 인하여 십이지장 원위부로 떠내려갈 수 있으므로 가급적 빨리 올가미를 이용하여 포획하고, 내시경 자체를 회수하면서 검체를 확보하는 것이 필요하다. 진경제를 시술 전 주입하면, 장운동이 감소되어 조직의 유실을 줄일 수 있다. 회수된 검체는 조직학적 침범 정도를 정확하게 판단하기 위하여, 핀으로 펴서 고정하여 사진을 찍고, 고정액에 담근다. 이후 다시 내시경을 삽입한 후 병변을 관찰하여 심부 손상이나 천공 유무, 출혈이나 출혈 가능 부위를 확인하여야 하며, 필요 시 클립봉합이나 지혈술을 시행한다.
내시경 유두절제술은 숙련된 전문의가 시술할 때, 수술에 비하여 치료 성적은 비슷하고 전반적인 합병증은 낮으나 합병증의 발생은 여전히 위험요소가 된다. 106명을 대상으로 한 국내의 후향적 다기관 연구에서는 24.5%에서 합병증이 발생하였으며, 췌장염이 가장 많았다[49]. 최근에 발표된 1,751명이 포함된 29개 연구를 분석한 체계적 문헌고찰에서도 합병증은 24.9%(95% 신뢰구간, 21.2∼29%)로 보고하였으며, 췌장염이 가장 많았고(11.9%), 췌장염을 예방하는 데 도움이 되는 것은 예방적 췌관 스텐트 삽입이라고 하였다[50]. 합병증은 흔히 조기 합병증(췌장염, 출혈, 천공 등)과 지연 합병증(유두부협착, 담관협착, 십이지장협착 등)으로 나뉠 수 있으며, 시술관련 사망률은 0.3%였다[50].
췌장염은 내시경 유두절제술시 가장 많이 발생하는 합병증(11.9%; 95% 신뢰구간, 10.5∼13.6%)이며[50], 절제술시 사용하는 올가미의 통전으로 인하여 췌관 입구의 폐쇄 및 부종으로 인하여 발생한다. 예방적 췌관 스텐트 삽입은 완전형 분할췌가 없는 경우에는 췌장염의 발생을 감소시킬 수 있으며[28], 시술 전에 100 mg의 indomethacin을 직장내 투여하거나 절제술 직후 diclofenac 투여도 도움이 된다[28]. 만일 시술 후 예방적 췌관 삽입을 시행하지 못하는 경우는 고용량 lactated Ringer’s 용액을 정주하는 것이 췌장염 예방에 도움이 된다고 하였다[28].
출혈은 내시경 유두절제술시 두 번째 많이 발생하는 합병증(10.6%; 95% 신뢰구간, 5.2∼13.6%)이며, 혈관이 발달된 십이지장벽까지 침범한 측방발육형 종양을 절제할 때 많이 발생한다[50]. 대부분 절제 직후 발견되나 지연성 출혈로 나타나기도 한다. 시술 중 출혈이 발생할 때 즉각적인 지혈을 시행하지 않으면, 출혈 및 혈괴로 인하여 급격히 출혈 부위가 가려져 더 이상의 시술이 곤란해지므로 침착하게 빨리 지혈을 시도하여야 한다. 지혈겸자가 유용하며, 지혈클립도 도움이 된다. 아르곤프라스마소작술(argon plasma coagulation, APC)도 작은 양의 출혈이나 노출된 혈관을 소작할 때 도움이 되나 사용에 주의를 기울여야 한다. 십이지장벽에 접촉이 되면 가스압력으로 인하여 천공이 발생할 수 있다. 특히 지혈과 관련하여 명심하여야 할 것은 췌관 입구를 확인하고, 지혈술과 관련된 손상으로부터 보호하기 위하여 스텐트 삽입 같은 조치를 취하는 것이 필요하다[41].
지연성 출혈은 시술 후 12시간 이내에 주로 많이 발생하며 절제된 병변의 크기와 관련이 많다. 지연성 출혈로 인한 혈역학적 이상 소견이 발견되면 응급내시경을 시행하는 것이 도움이 되며, 적극적인 지혈술을 시행하여야 한다. 출혈로 인하여 시야가 확보되지 않고 혈역학적 이상이 관찰된다면 출혈혈관에 대한 응급혈관조영술 및 색전술도 필요하다.
천공은 주로 전기소작과 관련이 많으며 3.1% (95% 신뢰구간, 2.2∼4.2%)에서 발생하나[50], 출혈지혈 중에도 기구의 조작때문에 발생하기도 한다. 절제 후 단면을 잘 살펴서 근육손상이 관찰되면 천공의 위험성이 높아진다. 사용하는 공기의 송기량은 너무 많지 않는 것이 도움이 될 수 있다. 천공은 대부분 후복막강으로 발생하기에 대부분 내과적 치료로 해결이 될 수 있다. 시술 중 후복막강에 공기음영이 발견되면 천공 위치에 따라서 클립봉합술을 하거나 담관에 피막형자가팽창형 스텐트를 삽입하여 더 이상의 공기나 체액누출이 없도록 하여야 한다[51]. 이후 항생제 및 금식을 유지하고 임상 경과를 추적 관찰하여야 한다.
담관염은 2.7% (95% 신뢰구간, 1.9∼4%)에서 발생한다[50]. 유두팽대부 종양의 절제 이후 담관의 세균감염으로 발생하며, 담관에 잔존종양이 남아 있거나 혈괴가 있어 담즙배액이 불완전할 때 발생 가능하다. 이를 예방하기 위하여 내시경유두부 절제술을 시행 후 유두괄약근 절개술을 추가로 시행하면 담관염 예방과 함께 지연성 담관협착도 예방할 수 있다.
유두절제술의 지연성 합병증으로 담관 및 췌관 입구의 협착이 2.4% (95% 신뢰구간, 1.6∼3.4%)에서 발생 가능하다. 예방적 췌관 스텐트 삽입으로 췌관협착을 예방할 수 있다. 협착 발생 시에는 유두부 절개술을 추가로 시행하거나 유두부풍선확장술, 스텐트 삽입 등으로 협착을 해결할 수 있다[50].
내시경 유두절제술은 수술적 방법에 비하여 시술과 관련된 사망률이나 이환율은 낮으나 치료 방법에 따라 국소 재발은 높은 편이다. 완전 절제란 절제된 검체의 수평 및 수직변연에서 더 이상의 선종성 병변이 발견되지 않음(R0)을 의미한다[28]. 만일 절제면에서 선종성 병변이 발견되면(R1), APC나 추가적 점막 절제술의 시행을 고려하여야 한다. 절제된 검체에서 경계면이 깨끗하고 상피암만 발견된다면 치료성공으로 판단한다. 그러나 검체에서 T1 병변이 발견된다면 임파선전이의 가능성이 높으므로 수술적 광범위 절제술이 요구된다. 체계적 문헌고찰의 결과를 보면, 모든 병변의 제거를 나타내는 완전 절제율(기술적 성공률)은 94.2% (95% 신뢰구간, 90.5∼96.5%), 치료적 성공률은 87.1% (95% 신뢰구간, 83.0∼90.3%)였다[50]. 치료성공과 관련된 인자는 일괄 절제이며, 분할 절제시 재발률이 높아졌다.
재발률이 11.8% (95% 신뢰구간, 8.4∼16.5%)로 보고되므로[50], 시술 후 추적 검사가 필요하다. 주로 첫 1년에 많이 발생하므로, 술 후 3개월, 6개월, 그리고 이후부터 5년간, 1년 간격으로 십이지장경을 이용한 육안적 관찰과 조직 검사를 권한다[28]. 재발에 영향을 미치는 인자로는 48세 미만, 여성, 용종증후군, 병변이 클수록(24 mm 이상), 고도이형성증, 담관내 침범이었다[41]. 재발이 발견되면 대부분 국소 점막 재발의 형태를 나타내기에 국소 치료를 시행하면 된다. 재발된 병변의 제거율은 80.9%(95% 신뢰구간, 73∼87%)였다[50].
내시경 술기의 발달과 경험의 축적으로 내시경 유두절제술의 경험도 늘어나고 있으며, 2~3 cm 미만의 절제 가능하며 악성 변화가 명확하지 않은 선종성 병변(일부에서는 국소적 상피내암)이나, 담관이나 췌관으로의 침범이 없는 경우는 내시경 절제술을 첫번째 치료 방법으로 고려할 수 있다. 3~4 cm 가량의 큰 병변은 환자 상태와 시술자의 경험에 따라 치료 방법을 선택할 수 있다. 술 전 검사는 십이지장경을 통한 육안적 검사가 필수적이며, 조직 검사, EUS, 필요에 따라서 MRCP를 통한 담관내 침범 유무 확인이 필요하다.
시술은 비교적 안전하면서도 간단히 시행할 수 있지만, 심각한 합병증이 발생할 수 있는 고난이도 시술이므로 숙련된 시술자가 시행해야 하며, 합병증 발생시 협진할 수 있는 장비와 인력이 갖춰진 기관에서 시행하는 것이 필요하다. 적절한 절제술이 시행되었을 때 완전 절제율과 치료성공률은 매우 높으며, 합병증은 24.9%에서 발생 가능하나 대부분 중증도가 낮아 내과적으로 치료가 가능하다. 췌장염이 가장 많기에 예방적 췌관 스텐트 삽입이 필요하며 집중적인 관찰이 필요하다. 재발은 약 13%에서 발생하며, 분할 절제시 더 많이 발생하므로 주기적인 면밀한 추적 검사가 필요하다.
Fig. 1.
Shape of ampulla tumor according to endoscopy type. (A) When viewed through an upper endoscopy, only the lateral side of the lesion is partially observed. (B) Observation is possible from the front of the lesion when observed using a duodenoscope.
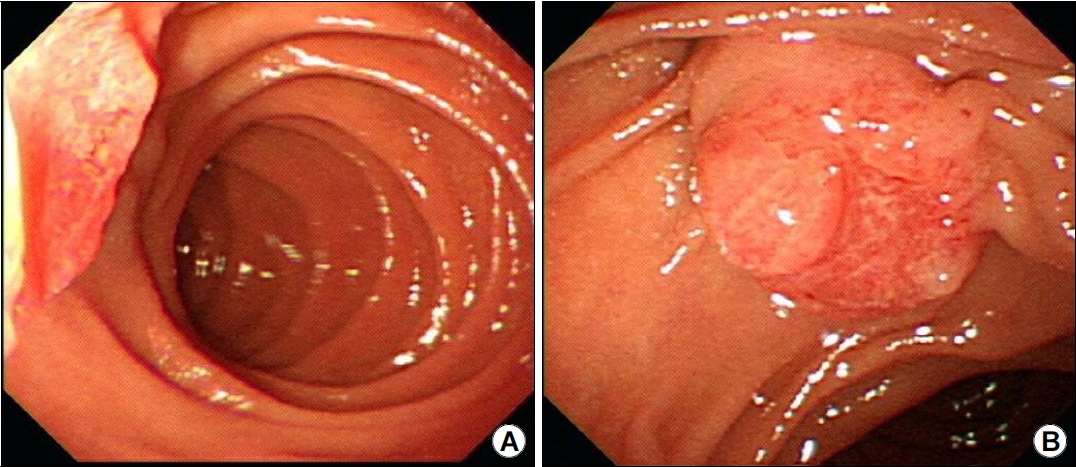
Fig. 2.
Gross morphology of ampulla tumor. (A) A form in which only the ampulla mucosa protrudes (non-exposed protruded-type tumor). (B) A form in which adenoma protrudes into the papilla (exposed protruded-type tumor). (C) A form in which ulcer is observed (ulcerating-type tumor).
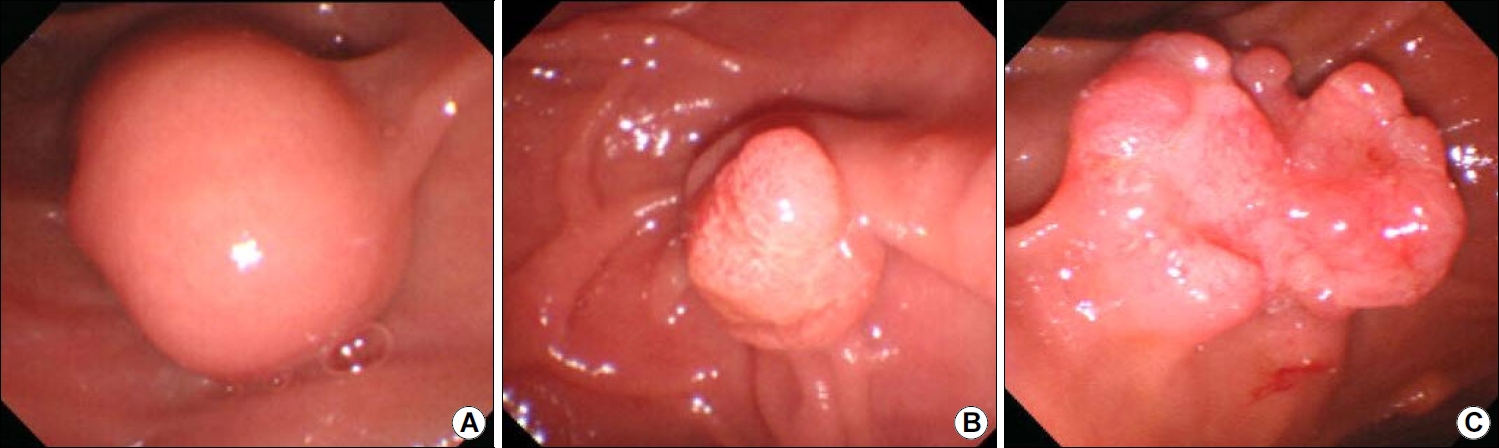
Fig. 3.
Endoscopic papillectomy. (A) Observe the lesion closely. (B) The ampulla tumor, in which only the ampulla protrudes, is captured with a snare from top to bottom. (C) In order to check the boundary of the mucous membrane trapped in the lower part, slightly lift the snare and check how much is captured. (D) Since the specimen may be lost to the lower duodenum immediately after resection, the specimen should be quickly captured and recovered. (E, F) After papillectomy, biliary sphincterotomy can prevent cholangitis or bile duct stricture.
REFERENCES
1. Irani S, Arai A, Ayub K, et al. Papillectomy for ampullary neoplasm: results of a single referral center over a 10-year period. Gastrointest Endosc 2009;70:923–932.


2. Jagelman DG, DeCosse JJ, Bussey HJ. Upper gastrointestinal cancer in familial adenomatous polyposis. Lancet 1988;1:1149–1151.


3. Norton ID, Geller A, Petersen BT, Sorbi D, Gostout CJ. Endoscopic surveillance and ablative therapy for periampullary adenomas. Am J Gastroenterol 2001;96:101–106.


4. Fischer HP, Zhou H. Pathogenesis of carcinoma of the papilla of Vater. J Hepatobiliary Pancreat Surg 2004;11:301–309.



5. Gouma DJ, Obertop H, Vismans J, Willebrand D, Soeters PB. Progression of a benign epithelial ampullary tumor to adenocarcinoma. Surgery 1987;101:501–504.

6. Spigelman AD, Talbot IC, Penna C, et al. Evidence for adenoma-carcinoma sequence in the duodenum of patients with familial adenomatous polyposis. The Leeds Castle Polyposis Group (Upper Gastrointestinal Committee). J Clin Pathol 1994;47:709–710.



7. Seifert E, Schulte F, Stolte M. Adenoma and carcinoma of the duodenum and papilla of Vater: a clinicopathologic study. Am J Gastroenterol 1992;87:37–42.

8. Westgaard A, Tafjord S, Farstad IN, et al. Pancreatobiliary versus intestinal histologic type of differentiation is an independent prognostic factor in resected periampullary adenocarcinoma. BMC Cancer 2008;8:170.




9. Talamini MA, Moesinger RC, Pitt HA, et al. Adenocarcinoma of the ampulla of Vater. A 28-year experience. Ann Surg 1997;225:590–599; discussion 599-600.


10. Whipple AO, Parsons WB, Mullins CR. Treatment of carcinoma of the ampulla of Vater. Ann Surg 1935;102:763–779.


11. Beger HG, Thorab FC, Liu Z, Harada N, Rau BM. Pathogenesis and treatment of neoplastic diseases of the papilla of Vater: Kausch-Whipple procedure with lymph node dissection in cancer of the papilla of Vater. J Hepatobiliary Pancreat Surg 2004;11:232–238.



12. Winter JM, Cameron JL, Olino K, et al. Clinicopathologic analysis of ampullary neoplasms in 450 patients: implications for surgical strategy and long-term prognosis. J Gastrointest Surg 2010;14:379–387.



13. Beger HG, Treitschke F, Gansauge F, Harada N, Hiki N, Mattfeldt T. Tumor of the ampulla of Vater: experience with local or radical resection in 171 consecutively treated patients. Arch Surg 1999;134:526–532.


14. Posner S, Colletti L, Knol J, Mulholland M, Eckhauser F. Safety and long-term efficacy of transduodenal excision for tumors of the ampulla of Vater. Surgery 2000;128:694–701.


15. van Stolk R, Sivak MV Jr, Petrini JL, Petras R, Ferguson DR, Jagelman D. Endoscopic management of upper gastrointestinal polyps and periampullary lesions in familial adenomatous polyposis and Gardner's syndrome. Endoscopy 1987;19 Suppl 1:19–22.

16. Binmoeller KF, Boaventura S, Ramsperger K, Soehendra N. Endoscopic snare excision of benign adenomas of the papilla of Vater. Gastrointest Endosc 1993;39:127–131.


17. Bohnacker S, Seitz U, Nguyen D, et al. Endoscopic resection of benign tumors of the duodenal papilla without and with intraductal growth. Gastrointest Endosc 2005;62:551–560.


18. Boix J, Lorenzo-Zúñiga V, Moreno de Vega V, Domènech E, Gassull MA. Endoscopic resection of ampullary tumors: 12-year review of 21 cases. Surg Endosc 2009;23:45–49.



19. Catalano MF, Linder JD, Chak A, et al. Endoscopic management of adenoma of the major duodenal papilla. Gastrointest Endosc 2004;59:225–232.


20. Cheng CL, Sherman S, Fogel EL, et al. Endoscopic snare papillectomy for tumors of the duodenal papillae. Gastrointest Endosc 2004;60:757–764.


21. Desilets DJ, Dy RM, Ku PM, et al. Endoscopic management of tumors of the major duodenal papilla: refined techniques to improve outcome and avoid complications. Gastrointest Endosc 2001;54:202–208.


22. Han J, Lee SK, Park DH, et al. Treatment outcome after endoscopic papillectomy of tumors of the major duodenal papilla. Korean J Gastroenterol 2005;46:110–119.

23. Katsinelos P, Paroutoglou G, Kountouras J, et al. Safety and long-term follow-up of endoscopic snare excision of ampullary adenomas. Surg Endosc 2006;20:608–613.



24. Norton ID, Gostout CJ, Baron TH, Geller A, Petersen BT, Wiersema MJ. Safety and outcome of endoscopic snare excision of the major duodenal papilla. Gastrointest Endosc 2002;56:239–243.


25. Saurin JC, Chavaillon A, Napoléon B, et al. Long-term followup of patients with endoscopic treatment of sporadic adenomas of the papilla of Vater. Endoscopy 2003;35:402–406.


26. Vogt M, Jakobs R, Benz C, Arnold JC, Adamek HE, Riemann JF. Endoscopic therapy of adenomas of the papilla of Vater. A retrospective analysis with long-term follow-up. Dig Liver Dis 2000;32:339–345.


27. Menzel J, Poremba C, Dietl KH, Böcker W, Domschke W. Tumors of the papilla of Vater--inadequate diagnostic impact of endoscopic forceps biopsies taken prior to and following sphincterotomy. Ann Oncol 1999;10:1227–1231.


28. Vanbiervliet G, Strijker M, Arvanitakis M, et al. Endoscopic management of ampullary tumors: European Society of Gastrointestinal Endoscopy (ESGE) guideline. Endoscopy 2021;53:429–448.


29. ASGE Standards of Practice Committee, Chathadi KV, Khashab MA, et al. The role of endoscopy in ampullary and duodenal adenomas. Gastrointest Endosc 2015;82:773–781.


30. Uchiyama Y, Imazu H, Kakutani H, et al. New approach to diagnosing ampullary tumors by magnifying endoscopy combined with a narrow-band imaging system. J Gastroenterol 2006;41:483–490.



31. Yamaguchi K, Enjoji M, Kitamura K. Endoscopic biopsy has limited accuracy in diagnosis of ampullary tumors. Gastrointest Endosc 1990;36:588–592.


32. Ahn KS, Kang KJ, Kim YH, et al. Impact of preoperative endoscopic cholangiography and biliary drainage in ampulla of Vater cancer. Surg Oncol 2018;27:82–87.


33. Itoh A, Goto H, Naitoh Y, Hirooka Y, Furukawa T, Hayakawa T. Intraductal ultrasonography in diagnosing tumor extension of cancer of the papilla of Vater. Gastrointest Endosc 1997;45:251–260.


34. Ito K, Fujita N, Noda Y, et al. Preoperative evaluation of ampullary neoplasm with EUS and transpapillary intraductal US: a prospective and histopathologically controlled study. Gastrointest Endosc 2007;66:740–747.


35. Trikudanathan G, Njei B, Attam R, Arain M, Shaukat A. Staging accuracy of ampullary tumors by endoscopic ultrasound: meta-analysis and systematic review. Dig Endosc 2014;26:617–626.


36. Kim TU, Kim S, Lee JW, et al. Ampulla of Vater: comprehensive anatomy, MR imaging of pathologic conditions, and correlation with endoscopy. Eur J Radiol 2008;66:48–64.


37. Lagarde S, Dauphin M, Delmas C, et al. Increased risk of colonic neoplasia in patients with sporadic duodenal adenoma. Gastroenterol Clin Biol 2009;33:441–445.


38. Offerhaus GJ, Giardiello FM, Krush AJ, et al. The risk of upper gastrointestinal cancer in familial adenomatous polyposis. Gastroenterology 1992;102:1980–1982.


39. de Vos tot Nederveen Cappel WH, Järvinen HJ, Björk J, Berk T, Griffioen G, Vasen HF. Worldwide survey among polyposis registries of surgical management of severe duodenal adenomatosis in familial adenomatous polyposis. Br J Surg 2003;90:705–710.



40. Angsuwatcharakon P, Ahmed O, Lynch PM, et al. Management of ampullary adenomas in familial adenomatous polyposis syndrome: 16 years of experience from a tertiary cancer center. Gastrointest Endosc 2020;92:323–330.


42. Paspatis GA, Arvanitakis M, Dumonceau JM, et al. Diagnosis and management of iatrogenic endoscopic perforations: European Society of Gastrointestinal Endoscopy (ESGE) position statement - update 2020. Endoscopy 2020;52:792–810.


43. Standards of Practice Committee, Adler DG, Qureshi W, et al. The role of endoscopy in ampullary and duodenal adenomas. Gastrointest Endosc 2006;64:849–854.


44. Tringali A, Matteo MV, Orlandini B, et al. Radiofrequency ablation for intraductal extension of ampullary adenomatous lesions: proposal for a standardized protocol. Endosc Int Open 2021;9:E749–E755.



45. Choi YH, Yoon SB, Chang JH, Lee I S. T he s afety of r ad iofrequency ablation using a novel temperature-controlled probe for the treatment of residual intraductal lesions after endoscopic papillectomy. Gut Liver 2021;15:307–314.


46. Harewood GC, Pochron NL, Gostout CJ. Prospective, randomized, controlled trial of prophylactic pancreatic stent placement for endoscopic snare excision of the duodenal ampulla. Gastrointest Endosc 2005;62:367–370.


47. Yamao T, Isomoto H, Kohno S, et al. Endoscopic snare papillectomy with biliary and pancreatic stent placement for tumors of the major duodenal papilla. Surg Endosc 2010;24:119–124.



48. Dumonceau JM, Kapral C, Aabakken L, et al. ERCP-related adverse events: European Society of Gastrointestinal Endoscopy (ESGE) guideline. Endoscopy 2020;52:127–149.


49. Choi SJ, Lee HS, Kim J, et al. Clinical outcomes of endoscopic papillectomy of ampullary adenoma: a multi-center study. World J Gastroenterol 2022;28:1845–1859.



-
METRICS

-
- 0 Crossref
- 1,961 View
- 45 Download
- Related articles in Korean J Helicobacter Up Gastrointest Res
-
Underwater Endoscopic Mucosal Resections of Non-ampullary Small Duodenal Tumors2022 June;22(2)
Endoscopic Treatment for Esophageal Cancer2019 September;19(3)
Endoscopic Full-thickness Resection for Gastric Tumor2016 March;16(1)
Is Endoscopic Resection Really Safe for Mucosal Gastric Cancers?2017 March;17(1)






