 |
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 22(4); 2022 > Article |
|
See editorial "Can Nizatidine Play a Dual Role of Inhibition of Gastric Acid Secretion and Promotion of Gastric Emptying?" in Volume 22 on page 251.
Abstract
Background/Aims
Histamine-2 receptor antagonists (H2RA) are used to treat acid-related disorders and functional dyspepsia. In contrast to other H2RAs, nizatidine promotes gastric emptying (GE). We investigated the effects of nizatidine and famotidine on intragastric pH and the GE rate in rats exposed to stress.
Materials and Methods
We used 8-week-old male Wistar rats. Based on administration of water or drugs after an overnight fast, the animals were categorized into the nonstress-water, stress-water, stress-nizatidine, stress-famotidine, and stress-nizatidine with mosapride groups. The rats had access to pre-weighed food for 10 minutes, and those in the stress groups were exposed to 1 hour of restraint stress. Intragastric pH was measured under isoflurane anesthesia, and the GE rate was measured after the rats were sacrificed.
Results
The GE rate was significantly lower in the stress-water and stress-famotidine groups than in the nonstress-water group. However, GE in the stress-nizatidine and stress-nizatidine with mosapride group did not significantly differ from that in the nonstress- water group. The GE rate was significantly higher in the stress-nizatidine with mosapride than in the stress-famotidine group. Intragastric pH was significantly higher in the stress-nizatidine and stress-famotidine groups than in the stress-water group. Nonetheless, there was no significant difference in pH between the stress-nizatidine and stress-famotidine groups. The intragastric pH was slightly but significantly higher in the stress-nizatidine with mosapride group than in the stress-nizatidine and stress-famotidine groups.
ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØĆ ņāüļ│ĄļČĆ ĒåĄņ”Ø, ņŗØĒøä ĒīĮļ¦īĻ░É, ņĪ░ĻĖ░ ļ¦īļ│ĄĻ░É ļō▒ ņ£äņŗŁņØ┤ņ¦Ćņן ļČĆņ£äņŚÉņä£ ĻĖ░ņøÉĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉśļŖö ņ”ØņāüņØä ĒśĖņåīĒĢśņ¦Ćļ¦ī ņØ┤ļź╝ ņäżļ¬ģĒĢĀ ĻĖ░ņ¦łņĀü ņøÉņØĖņØ┤ ņŚåļŖö Ļ▓ĮņÜ░ļĪ£ ņĀĢņØśļÉ£ļŗż[1]. Ļ│╝Ļ▒░ņŚÉ ņ£äņÜ┤ļÅÖ ņØ┤ņāüĻ│╝ ļé┤ņןĻ│╝ļ»╝ņä▒ņ£╝ļĪ£ ņäżļ¬ģļÉśņŚłļŹś ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØś ļ│æĒā£ņāØļ”¼ļŖö ņĄ£ĻĘ╝ņŚÉ ļćī-ņןņČĢ ņØ┤ņāü ņ¦łĒÖśņØś Ļ░£ļģÉņ£╝ļĪ£ ļ░£ņĀäĒĢśņśĆļŗż[1]. ņ”ē, ņŖżĒŖĖļĀłņŖżļéś ņŗĀĻ▓ĮĻ│ä ņŗĀĒśĖ ņĀäļŗ¼ ņØ┤ņāüĻ│╝ Ļ░ÖņØĆ ļćīņĖĪ ļ│æĒā£ņāØļ”¼ņÖĆ ņ£äņÜ┤ļÅÖ ĻĖ░ļŖź ņØ┤ņāü, ņŗŁņØ┤ņ¦Ćņן ļ®┤ņŚŁ ņØ┤ņāü ļ░Å ņĀÉļ¦ēņŚ╝ņ”Ø, ļ»ĖņāØļ¼╝ņ┤Ø ņØ┤ņāü ļō▒ņØś ņ£äņŗŁņØ┤ņ¦ĆņןņĖĪ ļ│æĒā£ņāØļ”¼ņØś ņāüĒśĖ ņ×æņÜ®ņ£╝ļĪ£ ņ£äņן ņ”ØņāüņØ┤ ļ░£ņāØĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉśĻ│Ā ņ׳ļŗż[2]. ņØ┤ļĀćĻ▓ī ļŗżņ¢æĒĢ£ ĻĖ░ņĀäņŚÉļÅä ļČłĻĄ¼ĒĢśĻ│Ā Ēśäņ×¼ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ņ╣śļŻīņŚÉļŖö ņ£äņÜ┤ļÅÖņØä ņ”ØĻ░Ćņŗ£ĒéżļŖö ņ£äņןĻ┤Ć ņÜ┤ļÅÖņ┤ēņ¦äņĀ£ņÖĆ ņ£äņé░ ļČäļ╣ä ņ¢ĄņĀ£ņĀ£ņØĖ ņ¢æņä▒ņ×ÉĒÄīĒöäņ¢ĄņĀ£ņĀ£(proton pump inhibitor, PPI)ļéś H2 ņłśņÜ®ņ▓┤ ĻĖĖĒĢŁņĀ£(H2 receptor antagonist, H2RA)Ļ░Ć ņŻ╝ļĪ£ ņé¼ņÜ®ļÉ£ļŗż. ņØ┤ ņżæņŚÉņä£ ņ£äņé░ ļČäļ╣ä ņ¢ĄņĀ£ņĀ£ļŖö ņ£äņé░ņŚÉ ļīĆĒĢ£ Ļ│╝ļ»╝ņä▒, ņŗŁņØ┤ņ¦Ćņן ņé░ ņ▓ŁņåīļŖź Ļ░Éņåī, ņŗŁņØ┤ņ¦Ćņן ļé┤ ņ”ØĻ░ĆļÉ£ ņé░ņØ┤ ņ£Āļ░£ĒĢśļŖö ņ£äņÜ┤ļÅÖ ņןņĢĀ ļō▒ņØ┤ ņåīĒÖöļČłļ¤ē ņ”ØņāüņØä ņØ╝ņ£╝Ēé©ļŗżļŖö ĻĖ░ņĀäņŚÉ ĻĘ╝Ļ▒░ĒĢśņŚ¼ ņé¼ņÜ®ļÉśĻ│Ā ņ׳ļŗż[3-5]. ļśÉ PPIļŖö ņŗŁņØ┤ņ¦Ćņן ļé┤ ļ╣äļ¦īņäĖĒżņÖĆ ĒśĖņé░ĻĄ¼ļź╝ Ļ░Éņåīņŗ£ņ╝£ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ē ņ”ØņāüņØä Ļ░£ņäĀņŗ£ĒéżļŖö ĻĖ░ņĀäļÅä ļ│┤Ļ│ĀļÉśņŚłļŗż[6].
ĻĘĖļ¤¼ļéś ņ£äņé░ ļČäļ╣ä ņ¢ĄņĀ£ņĀ£ļź╝ Ēł¼ņŚ¼ĒĢśļ®┤ ņ£äņé░ Ļ░ÉņåīņŚÉ ņØśĒĢ┤ Ļ│ĀĻ░ĆņŖżĒŖĖļ”░Ēśłņ”ØņØ┤ ņ£Āļ░£ļÉśĻ│Ā, ņØīņŗØļ¼╝ Ļ░ĆņłśļČäĒĢ┤ Ļ░ÉņåīņÖĆ ņ£äļ░░ņČ£ ņ¦ĆņŚ░ ļō▒ņŚÉ ņØśĒĢ┤ ņåīĒÖöļČłļ¤ē ņ”ØņāüņØ┤ ļ░£ņāØĒĢśĻĖ░ļÅä ĒĢśļ»ĆļĪ£ ĒØöĒ׳ ņ£äņןĻ┤ĆņÜ┤ļÅÖņ┤ēņ¦äņĀ£ņÖĆ ļ│æņÜ® ņ▓śļ░®ļÉ£ļŗż[7-9]. ņ£äņé░ ļČäļ╣ä ņ¢ĄņĀ£ņĀ£ņÖĆ ņ£äņןĻ┤ĆņÜ┤ļÅÖņ┤ēņ¦äņĀ£ņØś ļ│æņÜ® Ēł¼ņŚ¼ļŖö ņåīĒÖöļČłļ¤ē ņ”ØņāüņØś Ļ░£ņäĀļ┐Éļ¦ī ņĢäļŗłļØ╝ ņ£äņé░ ņ¢ĄņĀ£ ĒÜ©Ļ│╝ļź╝ ļŹö ļ╣Āļź┤Ļ│Ā Ļ░ĢĒĢśĻ▓ī ĒĢĀ ņłśļÅä ņ׳ļŖöļŹ░, ņØ┤ļŖö ņ£äļ░░ņČ£ņØ┤ ņ”ØĻ░ĆļÉśļ®┤ņä£ ņ£äņé░ ļČäļ╣ä ņ¢ĄņĀ£ņĀ£Ļ░Ć ņŗŁņØ┤ņ¦Ćņןņ£╝ļĪ£ ļ╣©ļ”¼ ņØ┤ļÅÖļÉśĻĖ░ ļĢīļ¼Ėņ£╝ļĪ£ ņČöņĀĢļÉ£ļŗż[10,11]. Choi ļō▒[12]ņØĆ ĒØ░ņźÉļź╝ ņØ┤ņÜ®ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ Ēīīļ¬©Ēŗ░ļöśņŚÉ ļ¬©ņé¼Ēöäļ”¼ļō£ļź╝ ļ│æĒĢ®ĒĢ£ Ļ▓ĮņÜ░ ņ£ä ļé┤ pHĻ░Ć ļŹö ļåÆņĢäņ¦ĆļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆĻ│Ā ņØ┤ļ¤░ ļ│æĒĢ® ĒÜ©Ļ│╝ņØś ņןņĀÉņØĆ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØś ĒØöĒĢ£ ņ£Āļ░£ ņÜöņØĖņØĖ ņŖżĒŖĖļĀłņŖż ļģĖņČ£ ĒøäņŚÉļÅä ļÅÖņØ╝ĒĢśĻ▓ī Ļ┤Ćņ░░ļÉśņŚłļŗż[10-13].
ļŗłņ×ÉĒŗ░ļöśņØĆ ļŗżļźĖ H2RAņÖĆ ļŗ¼ļ”¼ ņĢäņäĖĒŗĖņĮ£ļ”░ ļČäĒĢ┤ĒÜ©ņåīļź╝ ņ¢ĄņĀ£ĒĢ©ņ£╝ļĪ£ņŹ© ņŗĀĻ▓Į-ĻĘ╝ņ£Ī ņĀæĒĢ®ļČĆņŚÉņä£ ņĢäņäĖĒŗĖņĮ£ļ”░ņØś ļåŹļÅäļź╝ ļåÆņŚ¼ ĒÅēĒÖ£ĻĘ╝ ņłśņČĢņØä ņ”ØĻ░Ćņŗ£ĒéżļŖö ļÅģĒŖ╣ĒĢ£ ĒÜ©Ļ│╝ļź╝ Ļ░Ćņ¦ĆĻ│Ā ņ׳ļŗż[13,14]. ņŖżĒŖĖļĀłņŖżņŚÉ ļģĖņČ£ļÉ£ ņāüĒā£ņŚÉņä£ļÅä Ēīīļ¬©Ēŗ░ļöśĻ│╝ ļ¬©ņé¼Ēöäļ”¼ļō£ ļ│æĒĢ® ņÜöļ▓ĢņØ┤ ņ£äņןĻ┤ĆņÜ┤ļÅÖņØä ņ┤ēņ¦äĒĢśĻ│Ā ņ£äņé░ ļČäļ╣ä ņ¢ĄņĀ£ņŚÉ ļŹö ĒÜ©Ļ│╝ņĀüņØ┤ļØ╝ļŖö Choi ļō▒[12]ņØś ņŚ░ĻĄ¼ļź╝ Ļ│ĀļĀżĒĢĀ ļĢī ņ£äņןĻ┤ĆņÜ┤ļÅÖ ņ┤ēņ¦ä ĒÜ©Ļ│╝ļź╝ ļÅÖņŗ£ņŚÉ Ļ░Ćņ¦ĆļŖö ļŗłņ×ÉĒŗ░ļöśņØĆ ļŗ©ļÅģņ£╝ļĪ£ ņé¼ņÜ®ĒĢśļŹöļØ╝ļÅä ļŗżļźĖ H2RAļź╝ ņ£äņןĻ┤ĆņÜ┤ļÅÖ ņ┤ēņ¦äņĀ£ņÖĆ ļ│æĒĢ® Ēł¼ņŚ¼ĒĢ£ Ļ▓āĻ│╝ ņ£Āņé¼ĒĢ£ ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļé╝ Ļ▓āņ£╝ļĪ£ ņČöņĀĢĒĢĀ ņłś ņ׳ļŗż[15]. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņŖżĒŖĖļĀłņŖżņŚÉ ļģĖņČ£ļÉ£ ĒØ░ņźÉņŚÉņä£ ļŗłņ×ÉĒŗ░ļöś ļŗ©ļÅģ Ēł¼ņŚ¼ Ēś╣ņØĆ ļŗłņ×ÉĒŗ░ļöśĻ│╝ ļ¬©ņé¼Ēöäļ”¼ļō£ņØś ļ│æĒĢ® Ēł¼ņŚ¼Ļ░Ć ņ£ä ļé┤ pH ļ│ĆĒÖöņÖĆ ņ£äļ░░ņČ£ņŚÉ ļ»Ėņ╣śļŖö ĒÜ©Ļ│╝ļź╝ Ēīīļ¬©Ēŗ░ļöś ļŗ©ļÅģ Ēł¼ņŚ¼ņÖĆ ļ╣äĻĄÉĒĢśĻ│Āņ×É ĒĢśņśĆļŗż.
ņ▓┤ņżæņØ┤ ņĢĮ 260 gņØś ņłśņ╗Ę 8ņŻ╝ļĀ╣ Wistar ņźÉ(Sam Taco, Osan, Korea)ļź╝ ņé¼ņÜ®ĒĢśņśĆļŗż. ļ¬©ļōĀ ņŗżĒŚśļÅÖļ¼╝ņØĆ Ļ░£ļ│ä ņ╝ĆņØ┤ņ¦ĆņŚÉņä£ ņé¼ņ£ĪĒĢśņśĆĻ│Ā 1ņŻ╝ņØ╝Ļ░äņØś ņĀüņØæ ĻĖ░Ļ░ä Ēøä Ļ░ü ņŗżĒŚśĻĄ░ņŚÉ ļ░░ņĀĢĒĢśņśĆļŗż. ņŗżĒŚśĻĄ░ņØĆ ŌæĀ ņŖżĒŖĖļĀłņŖż ņŚåņØ┤ ņŗØņłśļ¦ī ņ▓śļ”¼ĒĢ£ ĻĄ░, ŌæĪ ņŖżĒŖĖļĀłņŖż Ēøä ņŗØņłśļ¦ī ņ▓śļ”¼ĒĢ£ ĻĄ░, Ōæó ņŖżĒŖĖļĀłņŖż Ēøä Ēīīļ¬©Ēŗ░ļöśļ¦ī Ēł¼ņŚ¼ĒĢ£ ĻĄ░, ŌæŻ ņŖżĒŖĖļĀłņŖż Ēøä ļŗłņ×ÉĒŗ░ļöśļ¦ī Ēł¼ņŚ¼ĒĢ£ ĻĄ░, Ōæż ņŖżĒŖĖļĀłņŖż Ēøä ļ¬©ņé¼Ēöäļ”¼ļō£ņÖĆ ļŗłņ×ÉĒŗ░ļöśņØä Ļ░ÖņØ┤ Ēł¼ņŚ¼ĒĢ£ ĻĄ░ņ£╝ļĪ£ ļČäļźśĒĢśņśĆļŗż. ņŗżĒŚśņŚÉ ņé¼ņÜ®ļÉ£ Ēīīļ¬©Ēŗ░ļöś, ļŗłņ×ÉĒŗ░ļöś, ļ¬©ņé¼Ēöäļ”¼ļō£(Daewoong Pharmaceutical, Seoul, Korea)ļŖö Ļ░üĻ░ü 3 mg/kg, 20 mg/kg, 3 mg/kgņØś ņÜ®ļ¤ēņ£╝ļĪ£ Ēł¼ņŚ¼ļÉśļÅäļĪØ ņŗØņłśņŚÉ ļģ╣ņŚ¼ ĻĖłņåŹņ£╝ļĪ£ ļÉ£ ņŻ╝ņ×ģĻĖ░ļź╝ ĒåĄĒĢ┤ Ļ▓ĮĻĄ¼ ņŻ╝ņ×ģĒĢśņśĆļŗż. ņŗżĒŚśņŚÉ Ļ┤ĆļĀ©ļÉ£ ļ¬©ļōĀ ņé¼ĒĢŁņØĆ ņøÉĻ┤æļīĆĒĢÖĻĄÉ ņŗżĒŚśļÅÖļ¼╝ ņ£żļ”¼ņ£äņøÉĒÜīņØś ĻĖ░ņżĆņŚÉ ļ¦×ņČöņ¢┤ ņ¦äĒ¢ēĒĢśņśĆļŗż(IRB No. WKU 21-34).
ņŗżĒŚśļÅÖļ¼╝ņØĆ ņŗżĒŚś ĒĢśļŻ© ņĀäļéĀ ĻĖłņŗØņØä ņŗ£ņ╝░ņ£╝ļ®░ ĻĖłņŗØ ļÅÖņĢł ļ¼╝ņØĆ ņ×Éņ£ĀļĪŁĻ▓ī ņäŁņĘ©ĒĢśļÅäļĪØ ĒĢśņśĆļŗż. ņŗżĒŚś ļŗ╣ņØ╝ Ļ░ü ņŗżĒŚśĻĄ░ņŚÉ ļö░ļØ╝ ņŗØņłś, Ēīīļ¬©Ēŗ░ļöś, ļŗłņ×ÉĒŗ░ļöś, ļ¬©ņé¼Ēöäļ”¼ļō£ņÖĆ ļŗłņ×ÉĒŗ░ļöś Ļ░üĻ░üņØä Ļ▓ĮĻĄ¼ Ēł¼ņŚ¼ Ēøä ļ╣äņ¢┤ ņ׳ļŖö ņ╝ĆņØ┤ņ¦ĆļĪ£ ņś«Ļ▓© 10ļČäĻ░ä ņĀüņØæņŗ£ņ╝░Ļ│Ā ņØ┤Ēøä 10ļČäĻ░ä 1.5 gņØś ņé¼ļŻīļź╝ ņĀ£Ļ│ĄĒĢśņŚ¼ ņ×Éņ£ĀļĪŁĻ▓ī ļ©╣Ļ▓ī ĒĢśņśĆļŗż. 10ļČä ļé┤ņŚÉ 1.5 gņØś ļ©╣ņØ┤ļź╝ ļŗż ņäŁņĘ©ĒĢśņ¦Ć ļ¬╗ĒĢ£ ņźÉļŖö ļČäņäØņŚÉņä£ ļ░░ņĀ£ĒĢśņśĆļŗż. ņØ┤ņ¢┤ņä£ ļ╣äņŖżĒŖĖļĀłņŖżĻĄ░ņØä ņĀ£ņÖĖĒĢ£ ļéśļ©Ėņ¦Ć 4Ļ░£ņØś ņŖżĒŖĖļĀłņŖż ņŗżĒŚśĻĄ░ņŚÉ ļīĆĒĢ┤ ĻĄ¼ņåŹ ņŖżĒŖĖļĀłņŖżļź╝ Ļ░ĆĒĢśņśĆļŗż. ĻĄ¼ņåŹ ņŖżĒŖĖļĀłņŖżļŖö ĻĖ░ņĪ┤ ņŚ░ĻĄ¼[16]ņÖĆ Ļ░ÖņØ┤ Ļ│ĄĻĖ░Ļ░Ć ņל ĒåĄĒĢś ļŖö ļ░śņøÉĒåĄĒśĢ ņĢäĒü¼ļ”┤ ĒŖ£ļĖīņŚÉ ņźÉļź╝ ļäŻĻ│Ā Ļ│ĀņĀĢĒīÉņ£╝ļĪ£ ļ¦ēņĢä ņøĆņ¦üņØ┤ņ¦Ć ļ¬╗ĒĢśĻ▓ī ĒĢ£ Ēøä ĒŖ£ļĖīļź╝ 45┬░ĻĖ░ņÜĖņŚ¼ ĒĢ£ ņŗ£Ļ░ä ļÅÖņĢł ņ£Āņ¦ĆĒĢśņśĆļŗż. ĻĄ¼ņåŹ ņŖżĒŖĖļĀłņŖż Ēøä ņ”ēņŗ£ ņØ┤ņåīĒöīļŻ©ļ×Ć ĒØĪņ×ģ ļ¦łņĘ©ĒĢśņŚÉņä£ ļ│ĄļČĆļź╝ 4 cm ņĀĢļÅä ņĀłĻ░£ĒĢśņŚ¼ ņ£äļź╝ ļģĖņČ£ņŗ£ĒéżĻ│Ā ņ£äņŗØļÅä ņĀæĒĢ®ļČĆņÖĆ ņ£äņŗŁņØ┤ņ¦Ćņן ņĀæĒĢ®ļČĆļź╝ ņŗżļĪ£ ļ¼Čņ¢┤ ņ£ä ļé┤ ņØīņŗØļ¼╝ņØ┤ ņØ┤ļÅÖĒĢśļŖö Ļ▓āņØä ļ░®ņ¦ĆĒĢśņśĆļŗż. ļģĖņČ£ļÉ£ ņ£äņŚÉņä£ ļīĆļ¦īņĖĪņ£╝ļĪ£ ņøÉņ£äļČĆ ņ▓┤ļČĆņÖĆ ĻĘ╝ņ£äļČĆ ņ▓┤ļČĆņŚÉ Ļ░üĻ░ü ņĄ£ņåīĒĢ£ņØś Ēü¼ĻĖ░ļĪ£ ņĀłĻ░£Ļ│ĄņØä ļ¦īļōżĻ│Ā pH ņĖĪņĀĢĻĖ░(PH-220S; Lutron Electronic Enterprise Co. Ltd., Taipei, Taiwan)ļź╝ ņéĮņ×ģĒĢśņŚ¼ ņ£ä ļé┤ ņØīņŗØļ¼╝ņØś pHļź╝ ņĖĪņĀĢĒĢśņśĆļŗż(Fig. 1; ņØ┤ņĀä ņŚ░ĻĄ¼ņŚÉņä£ ņźÉņØś ĒĢ┤ļČĆĒĢÖņĀü ĒŖ╣ņä▒ņāü nonglandular forestomachļź╝ ņĀ£ņÖĖĒĢśĻ│Ā ļéśļ©Ėņ¦Ć glandular corpusļź╝ ņé¼ļ×īņØś ņ£äņ▓śļ¤╝ ņĀäņĀĢļČĆņÖĆ ĻĖ░ņĀĆļČĆļĪ£ ļéśļłäņ¢┤ ĻĄ¼ļČäĒ¢łņŚłļŗż. ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļÅÖņØ╝ĒĢ£ ļČĆņ£äņŚÉņä£ pHļź╝ ņĖĪņĀĢĒ¢łņ¦Ćļ¦ī ņóĆ ļŹö ņźÉņØś ĒĢ┤ļČĆĒĢÖņĀü ņÜ®ņ¢┤ņŚÉ ļ¦×Ļ▓ī ĒĢśĻĖ░ ņ£äĒĢ┤ņä£ ņ£äņé░ņØ┤ ļČäļ╣äļÉśļŖö glandular corpusļź╝ ņ▓┤ļČĆļĪ£ ļ¬ģļ¬ģĒĢśĻ│Ā ĻĘ╝ņ£äļČĆņÖĆ ņøÉņ£äļČĆļĪ£ ļéśļłäņŚłļŗż). ņ£ä ļé┤ pH ņĖĪņĀĢ Ēøä ņŗżĒŚśļÅÖļ¼╝ņØä ĒÜĪĻ▓®ļ¦ē ņĀłļŗ©ņØä ĒåĄĒĢ┤ ĒؼņāØņŗ£ĒéżĻ│Ā ņ£äļź╝ ņĀüņČ£ĒĢśņŚ¼ ņ”Øļźśņłśļź╝ ļŗ┤ņØĆ ļ╣äņ╗ż ņĢłņŚÉņä£ ņĀłĻ░£ĒĢśņŚ¼ ņ£ä ļé┤ņŚÉ ņ׳ļŖö ņé¼ļŻīļź╝ ļČäļ”¼ĒĢśņśĆļŗż. ļČäļ”¼ļÉ£ ņ£ä ļé┤ ņé¼ļŻīļŖö Ļ▒░ļ”äņóģņØ┤ļź╝ ĒåĄĒĢ┤ Ļ▒░ļźĖ Ēøä ņØ┤ĒŗĆĻ░ä Ļ▒┤ņĪ░ĒĢśņŚ¼ ļ¼┤Ļ▓īļź╝ ņĖĪņĀĢĒĢśņśĆļŗż. ņ£äļ░░ņČ£ļŖźņØĆ (ņäŁņŗØļ¤ē-ņ£äņŚÉ ļé©ņĢä ņ׳ļŖö ņ¢æ)/ņäŁņŗØļ¤ē├Ś100ņ£╝ļĪ£ Ļ│äņé░ĒĢśņśĆļŗż[16]. ļ¦łņĘ© ņŗ£Ļ░ä ļ░Å ņĖĪņĀĢ ņŗ£Ļ░äņØĆ ļ¬©ļōĀ ĻĄ░ņŚÉ ļÅÖņØ╝ĒĢśĻ▓ī ņĀüņÜ®ĒĢśņśĆņ£╝ļ®░ ļ¬©ļōĀ ņłśņłĀņØĆ ĒĢ£ ņé¼ļ×īņØś ņŗ£ņłĀņ×ÉņŚÉ ņØśĒĢ┤ ņ¦äĒ¢ēļÉśņŚłļŗż.
ĒåĄĻ│ä ļČäņäØņØä ņ£äĒĢ┤ SPSS Windows version 22.0 (IBM, New York, NY, USA) ļśÉļŖö R (version 4.0.1)ņØä ņé¼ņÜ®ĒĢśņśĆļŗż. 1.5 gņØś ļ©╣ņØ┤ļź╝ ļŗż ņäŁņĘ©ĒĢ£ ņŗżĒŚśļÅÖļ¼╝ņØś ņłśĻ░Ć Ļ░ü ĻĄ░ņŚÉ 6ļ¦łļ”¼Ļ░Ć ļÉĀ ļĢīĻ╣īņ¦Ć ņŗżĒŚśņØä ļ░śļ│ĄĒĢśņŚ¼ ņ┤Ø 30ļ¦łļ”¼ņØś ņ×ÉļŻīļź╝ ņ¢╗ņ¢┤ ĒåĄĻ│ä ļČäņäØĒĢśņśĆļŗż. ļ¬©ļōĀ ņ×ÉļŻīņØś ļČäņäØņØĆ ņĀĢĻĘ£ļČäĒżņÖĆ ļō▒ļČäņé░Ļ▓ĆņĀĢ Ēøä ņØ┤ņŚÉ ļö░ļØ╝ ANOVAņÖĆ LSD post-hoc test ļśÉļŖö Kruskal-Wallis H Test Ēøä post-hoc testļź╝ ĒåĄĒĢ┤ Ļ▓░Ļ│╝ļź╝ ļČäņäØĒĢśņśĆņ£╝ļ®░ P<0.05ņØĖ Ļ▓ĮņÜ░ ņ£ĀņØśĒĢ£ Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ĒĢśņśĆļŗż. ļ│Ėļ¼ĖĻ│╝ ĻĘĖļ”╝ņØś Ļ▓░Ļ│╝ļŖö ĒÅēĻĘĀ┬▒Ēæ£ņżĆ ņśżņ░©ļĪ£ Ēæ£ĻĖ░ĒĢśņśĆļŗż.
ņŗØņłś Ēł¼ņŚ¼ņÖĆ 10ļČäĻ░ä 1.5 g ņé¼ļŻī ņäŁņĘ© Ēøä 1ņŗ£Ļ░ä ļÅÖņĢł ņŖżĒŖĖļĀłņŖżņŚÉ ļģĖņČ£ļÉ£ ĻĄ░ņØĆ ļ╣äņŖżĒŖĖļĀłņŖżĻĄ░ņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī ņ£äļ░░ņČ£ļŖźņØ┤ Ļ░ÉņåīĒĢśņśĆļŗż(43.65%┬▒2.30% vs. 58.42%┬▒9.30%, P<0.05). Ēīīļ¬©Ēŗ░ļöśņØä Ēł¼ņŚ¼ĒĢśĻ│Ā ņŖżĒŖĖļĀłņŖżņŚÉ ļģĖņČ£ņŗ£Ēé© ĻĄ░ ņŚŁņŗ£ ņ£äļ░░ņČ£ļŖźņØ┤ ļ╣äņŖżĒŖĖļĀłņŖżĻĄ░ņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīĒĢśņśĆļŗż(37.40%┬▒7.69% vs. 58.42%┬▒9.30%, P<0.01). ĻĘĖļ¤¼ļéś ļŗłņ×ÉĒŗ░ļöśņØä Ēł¼ņŚ¼ĒĢśĻ│Ā ņŖżĒŖĖļĀłņŖżņŚÉ ļģĖņČ£ņŗ£Ēé© ĻĄ░ņØĆ Ēīīļ¬©Ēŗ░ļöś Ēł¼ņŚ¼ĻĄ░ļ│┤ļŗż ņ£äļ░░ņČ£ļŖź Ļ░ÉņåīĻ░Ć ņĀüņŚłņ£╝ļ®░ ļ╣äņŖżĒŖĖļĀłņŖżĻĄ░Ļ│╝ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļéśĒāĆļé┤ņ¦Ć ņĢŖņĢśļŗż(48.72%┬▒12.60% vs. 58.42%┬▒9.30%, P=0.15). ļŗłņ×ÉĒŗ░ļöśĻ│╝ ļ¬©ņé¼Ēöäļ”¼ļō£ļź╝ ļ│æĒĢ® Ēł¼ņŚ¼ĒĢśĻ│Ā ņŖżĒŖĖļĀłņŖżņŚÉ ļģĖņČ£ņŗ£Ēé© ĻĄ░ ņŚŁņŗ£ ņ£äļ░░ņČ£ļŖź Ļ░ÉņåīĻ░Ć ņĀüņ¢┤ ļ╣äņŖżĒŖĖļĀłņŖżĻĄ░Ļ│╝ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļéśĒāĆļé┤ņ¦Ć ņĢŖņĢśņ£╝ļ®░(52.22%┬▒15.69% vs. 58.42%┬▒9.30%, P=0.35), Ēīīļ¬©Ēŗ░ļöśļ¦ī Ēł¼ņŚ¼ĒĢ£ ĻĄ░ļ│┤ļŗż ņ£ĀņØśĒĢśĻ▓ī ņ£äļ░░ņČ£ļŖźņØ┤ ļåÆņĢśļŗż(52.22%┬▒15.69% vs. 37.40%┬▒7.69%, P<0.05). ļŗłņ×ÉĒŗ░ļöśĻ│╝ ļ¬©ņé¼Ēöäļ”¼ļō£ ļ│æĒĢ® Ēł¼ņŚ¼ĻĄ░ņØĆ ļŗłņ¦ĆĒāĆļöśļ¦ī Ēł¼ņŚ¼ĒĢ£ ĻĄ░Ļ│╝ ļ╣äĻĄÉ ņŗ£ ņ£äļ░░ņČ£ļŖźņØ┤ ņĢĮĻ░ä ļåÆņĢśņ£╝ļéś ĒåĄĻ│äņĀü ņ£ĀņØśņä▒ņØĆ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż(Fig. 2).
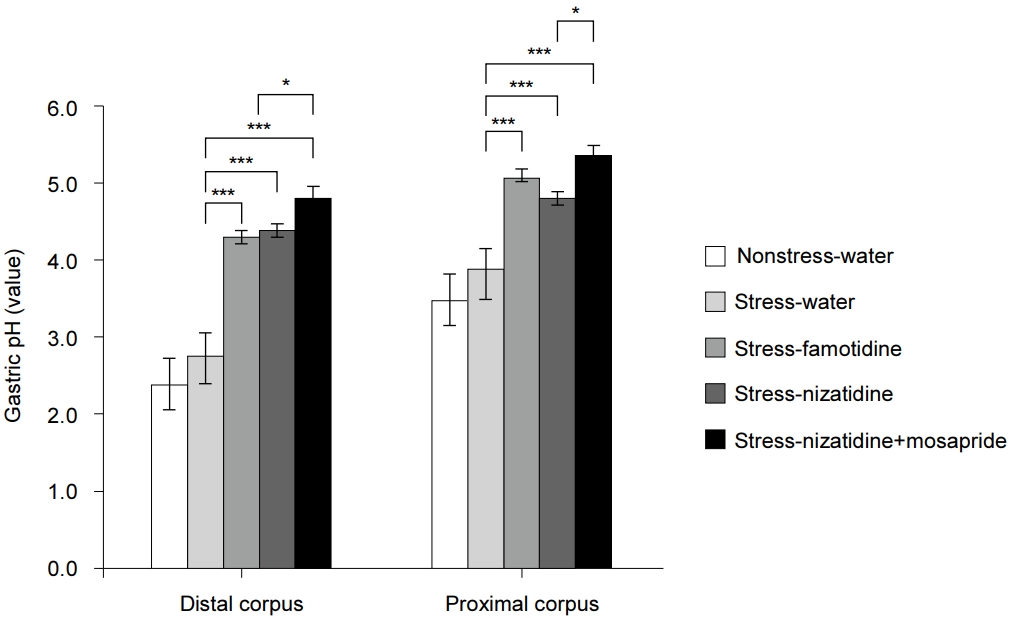
ņŗØņłś Ēł¼ņŚ¼ņÖĆ ņé¼ļŻī ņäŁņĘ© Ēøä 1ņŗ£Ļ░ä ļÅÖņĢł ļ╣äņŖżĒŖĖļĀłņŖżļéś ĻĄ¼ņåŹņŖżĒŖĖļĀłņŖżņŚÉ ļģĖņČ£ņŗ£Ēé© ļÆżņŚÉ ņĖĪņĀĢĒĢ£ ņ£ä ļé┤ ņé░ļÅäļŖö ļ╣äņŖżĒŖĖļĀłņŖż-ņŗØņłśĻĄ░Ļ│╝ ņŖżĒŖĖļĀłņŖż-ņŗØņłśĻĄ░ ļ¬©ļæÉņŚÉņä£ ĻĘ╝ņ£äļČĆ ņ▓┤ļČĆļ│┤ļŗż ņøÉņ£äļČĆ ņ▓┤ļČĆĻ░Ć ļŹö ļé«ņØĆ Ļ▓ĮĒ¢źņØä ļ│┤ņśĆļŗż. ĒĢ£ ņŗ£Ļ░äņØś ņŖżĒŖĖļĀłņŖżņŚÉ ļģĖņČ£ņŗ£Ēé© ĻĄ░ļōżļ¦īņØä ļ╣äĻĄÉĒ¢łņØä ļĢī ņøÉņ£äļČĆ ņ▓┤ļČĆņØś Ļ▓ĮņÜ░ Ēīīļ¬©Ēŗ░ļöś Ēł¼ņŚ¼ĻĄ░Ļ│╝ ļŗłņ×ÉĒŗ░ļöś Ēł¼ņŚ¼ĻĄ░ņØĆ ņŗØņłśļ¦ī Ēł¼ņŚ¼ĒĢ£ ĻĄ░ņŚÉ ļ╣äĒĢ┤ ņ£ä ļé┤ pHĻ░Ć ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż(4.13┬▒0.15, 5.30┬▒0.14, 2.68┬▒0.13; P<0.001). ĻĘ╝ņ£äļČĆ ņ▓┤ļČĆ ņŚŁņŗ£ Ēīīļ¬©Ēŗ░ļöś Ēł¼ņŚ¼ĻĄ░Ļ│╝ ļŗłņ×ÉĒŗ░ļöś Ēł¼ņŚ¼ĻĄ░ņØĆ ņŗØņłśļ¦ī Ēł¼ņŚ¼ĒĢ£ ĻĄ░ņŚÉ ļ╣äĒĢ┤ pHĻ░Ć ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż(4.87┬▒0.09, 4.60┬▒0.11, 3.78┬▒0.10; P<0.001). ĻĘĖļ¤¼ļéś ļæÉ ņĖĪņĀĢ ņ£äņ╣ś ļ¬©ļæÉņŚÉņä£ Ēīīļ¬©Ēŗ░ļöś Ēł¼ņŚ¼ĻĄ░Ļ│╝ ļŗłņ×ÉĒŗ░ļöś Ēł¼ņŚ¼ĻĄ░ Ļ░äņØś ņ£ä ļé┤ pH ņ░©ņØ┤ļŖö ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż. ļŗłņ×ÉĒŗ░ļöśņŚÉ ļ¬©ņé¼Ēöäļ”¼ļō£ļź╝ ļ│æĒĢ® Ēł¼ņŚ¼ĒĢ£ ĻĄ░ņØĆ Ēīīļ¬©Ēŗ░ļöś ļśÉļŖö ļŗłņ×ÉĒŗ░ļöśļ¦ī Ēł¼ņŚ¼ĒĢ£ ĻĄ░Ļ│╝ ļ╣äĻĄÉĒĢ┤ pHĻ░Ć ņĢĮĻ░ä ļåÆņĢśļŖöļŹ░, ņøÉņ£äļČĆ ņ▓┤ļČĆņŚÉņä£ļŖö Ēīīļ¬©Ēŗ░ļöś Ēł¼ņŚ¼ĻĄ░ņŚÉ ļ╣äĒĢ┤ņä£(4.63┬▒0.29 vs. 4.13┬▒0.15, P<0.05), ĻĘĖļ”¼Ļ│Ā ĻĘ╝ņ£äļČĆ ņ▓┤ļČĆņŚÉņä£ļŖö ļŗłņ×ÉĒŗ░ļöś Ēł¼ņŚ¼ĻĄ░ņŚÉ ļ╣äĒĢ┤ņä£(5.13 ┬▒ 0.43 vs. 4.60 ┬▒ 0.11, P<0.05) ņ£ĀņØśĒĢśĻ▓ī ļåÆņĢśļŗż(Fig. 3).
ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņŖżĒŖĖļĀłņŖżņŚÉ ļģĖņČ£ļÉ£ ņźÉņŚÉņä£ ņ£äļ░░ņČ£ņØ┤ Ļ░ÉņåīļÉśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢĀ ņłś ņ׳ņŚłļŗż. ņŖżĒŖĖļĀłņŖżļĪ£ ņØĖĒĢ£ ņ£äļ░░ņČ£ Ļ░ÉņåīļŖö ļŗłņ×ÉĒŗ░ļöśņŚÉ ņØśĒĢ┤ Ļ░£ņäĀļÉśņŚłņ¦Ćļ¦ī Ēīīļ¬©Ēŗ░ļöśņØĆ ĒÜ©Ļ│╝Ļ░Ć ņŚåņŚłĻ│Ā, ļ░śļ®┤ ņ£äņé░ņ¢ĄņĀ£ ĒÜ©Ļ│╝ņØś ņĖĪļ®┤ņŚÉņä£ļŖö ļæÉ ņĢĮņĀ£Ļ░Ć ņ£Āņé¼ĒĢ£ ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļāłļŗż.
ņŖżĒŖĖļĀłņŖżļŖö ņן-ļćī ņČĢņŚÉņä£ Ļ┤æļ▓öņ£äĒĢ£ ņŚŁĒĢĀĻ│╝ ĒĢ©Ļ╗ś ļé┤ņן Ļ░ÉĻ░ü ņÜ┤ļÅÖ ĻĖ░ļŖźņØä ņĪ░ņĀłĒĢśņŚ¼ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”ØņØä ĒżĒĢ©ĒĢ£ ĻĖ░ļŖźņä▒ ņ£äņן ņןņĢĀņØś ļ░£ļ│æ ļ░Å ņĢģĒÖöņŚÉ ņżæņÜöĒĢ£ ņŚŁĒĢĀņØä ĒĢśļŖö Ļ▓āņ£╝ļĪ£ ņĢīļĀżņĀĖ ņ׳ļŗż[17]. ņŗ¼Ļ░üĒĢ£ ņŖżĒŖĖļĀłņŖżļź╝ ļ░øļŖö ĒÖśņ×ÉļŖö ņóģņóģ ņ£äņן ņ”ØņāüņØä ĒśĖņåīĒĢśļ®░, ļīĆĒæ£ņĀüņØĖ ņāüļČĆņ£äņןĻ┤Ć ņ”Øņāüņ£╝ļĪ£ļŖö ĒīĮļ¦īĻ░ÉĻ│╝ ņåīļ¤ēņØś ņŗØņé¼ Ēøä Ēżļ¦īĻ░É, ļ│ĄļČĆ ĒīĮļ¦ī, ļ®öņŖżĻ║╝ņøĆ ļ░Å ņŗØņÜĢļČĆņ¦äņØä ņóģņóģ ĒśĖņåīĒĢ£ļŗż[15]. ņØ┤ļ¤¼ĒĢ£ ņ”ØņāüņØś ņØ╝ļČĆļŖö ņ£äņÜ┤ļÅÖ ņןņĢĀ ļĢīļ¼ĖņØ╝ ņłś ņ׳ļŖöļŹ░, Nakade ļō▒[16]ņØĆ Sprague-Dawley ņźÉņŚÉ ĻĄ¼ņåŹ ņŖżĒŖĖļĀłņŖżļź╝ Ļ░ĆĒĢśļ®┤ ņ£äļ░░ņČ£ņØ┤ Ļ░ÉņåīļÉśļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆĻ│Ā ņØ┤ļŖö ņżæņČö CRF2 ņłśņÜ®ņ▓┤ņÖĆ ļ¦Éņ┤ł ĻĄÉĻ░ÉņŗĀĻ▓ĮĻ│äņØś ĒÖ£ņä▒ĒÖöļź╝ ĒåĄĒĢ┤ ņØ╝ņ¢┤ļéśļŖö Ļ▓āņØä ņ”Øļ¬ģĒĢśņśĆļŗż. ļ│Ė ņŗżĒŚśņŚÉņä£ļÅä Wistar ņźÉļź╝ ņØ┤ņÜ®ĒĢ┤ ĻĄ¼ņåŹ ņŖżĒŖĖļĀłņŖżĻĄ░ņŚÉņä£ ļ╣äņŖżĒŖĖļĀłņŖżĻĄ░ņŚÉ ļ╣äĒĢ┤ ņ£äļ░░ņČ£ņØ┤ ņ£ĀņØśĒĢśĻ▓ī Ļ░ÉņåīļÉśļŖö Ļ▓āņØä ņ×¼ĒśäĒĢĀ ņłś ņ׳ņŚłļŗż. ņ£äļ░░ņČ£ Ļ░ÉņåīņÖĆ ņŚ░Ļ┤ĆļÉ£ ņåīĒÖöļČłļ¤ē ņ”ØņāüņØä ņ╣śļŻīĒĢśĻĖ░ ņ£äĒĢ┤ ņ£äņןĻ┤ĆņÜ┤ļÅÖ ņ┤ēņ¦äņĀ£Ļ░Ć ĒØöĒ׳ ņé¼ņÜ®ļÉśņ¦Ćļ¦ī, ņ£äļ¦łļ╣ä ĒÖśņ×É ļīĆņāü ņŚ░ĻĄ¼ņŚÉņä£ ņ£äņןĻ┤ĆņÜ┤ļÅÖ ņ┤ēņ¦äņĀ£ņØś ņ”Øņāü Ļ░£ņäĀ ĒÜ©Ļ│╝Ļ░Ć ņ£äļ░░ņČ£ ņ”ØĻ░ĆņÖĆ ņל ņŚ░Ļ┤ĆļÉśņ¦Ć ņĢŖņĢä ņÜ┤ļÅÖ Ļ░£ņäĀ ņÖĖņŚÉ ļŗżļźĖ ĻĖ░ņĀäņØ┤ ņ׳ņØä Ļ▓āņØ┤ļØ╝Ļ│Ā ņČöņĀĢļÉśĻ│Ā ņ׳ļŗż[13]. ĻĘĖļ¤¼ļéś ņ£äļ░░ņČ£ņØ┤ Ļ░ÉņåīļÉ£ ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ĒĢ£ ņŚ░ĻĄ¼ņŚÉņä£ļŖö ņØ╝Ļ┤ĆļÉśĻ▓ī ņ£ĀņÜ®ĒĢ£ ĒÜ©Ļ│╝ļź╝ ļ│┤ņŚ¼ņŻ╝ņŚłĻĖ░ ļĢīļ¼ĖņŚÉ ņŚ¼ņĀäĒ׳ ņØ╝ļČĆ ĒÖśņ×ÉĻĄ░ņŚÉņä£ļŖö ņ£äņןĻ┤ĆņÜ┤ļÅÖ ņ┤ēņ¦äņĀ£ņØś ņ£äņÜ┤ļÅÖ Ļ░£ņäĀ ĒÜ©Ļ│╝Ļ░Ć ņ”Øņāü Ļ░£ņäĀņŚÉ ņØśļ»Ėņ׳ļŖö ĻĖ░ņĀäņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż[18-20].
ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ņ╣śļŻīļź╝ ņ£äĒĢ┤ ĒØöĒ׳ H2RAĻ░Ć ņé¼ņÜ®ļÉśļŖöļŹ░ ļ▓ĮņäĖĒżņØś H2 ņłśņÜ®ņ▓┤ļź╝ ņ¢ĄņĀ£ĒĢ┤ ņ£äņé░ ļČäļ╣äļź╝ Ļ░Éņåīņŗ£ņ╝£ ļČłĒÄĖĻ░ÉņØä Ļ░Éņåīņŗ£ĒéżļŖö Ļ▓āņØ┤ ņŻ╝ ĻĖ░ņĀäņØ┤ļŗż. ņØ┤ļ¤░ ņ£äņé░ ņ¢ĄņĀ£ ĻĖ░ļŖź ņÖĖņŚÉ ļŗłņ×ÉĒŗ░ļöśņØĆ ņĢäņäĖĒŗĖņĮ£ļ”░ ļČäĒĢ┤ĒÜ©ņåī ņ¢ĄņĀ£ ĒÜ©Ļ│╝ļĪ£ ņĮ£ļ”░ņä▒ ņŗĀĻ▓Į ņŗ£ļāģņŖżņØś ņĢäņäĖĒŗĖņĮ£ļ”░ņØś ļåŹļÅäļź╝ ļåÆņŚ¼ ĒÅēĒÖ£ĻĘ╝ ņÜ┤ļÅÖņä▒ņØä ņ”ØĻ░Ćņŗ£Ēé¼ ņłś ņ׳ļŗż. ļŗżļźĖ H2RAļÅä ņ¢┤ļŖÉ ņĀĢļÅä ņĢäņäĖĒŗĖņĮ£ļ”░ ļČäĒĢ┤ĒÜ©ņåīļź╝ ņ¢ĄņĀ£ĒĢĀ ņłś ņ׳ļŖöļŹ░ ņØĖĻ░äĻ│╝ ņźÉņØś ņĀüĒśłĻĄ¼ļ¦ēĻ│╝ ĒśłņןņŚÉņä£ ļČäļ”¼ĒĢ£ ņĢäņäĖĒŗĖņĮ£ļ”░ ļČäĒĢ┤ĒÜ©ņåīņŚÉ ļīĆĒĢ£ ņ¢ĄņĀ£ļŖźņØä ĒÖĢņØĖĒĢ┤ ļ│┤ļ®┤ ļäżņśżņŖżĒŗ░ĻĘĖļ»╝ > ļŗłņ×ÉĒŗ░ļöś > ņŗ£ļ®öĒŗ░Ēŗ┤ >> Ēīīļ¬©Ēŗ░ļöś ņł£ņ£╝ļĪ£ ļéśĒāĆļé£ļŗż[21]. ĻĘĖļ¤¼ļéś Ļ░£ņÖĆ ņźÉļź╝ ņØ┤ņÜ®ĒĢ┤ ņŗżņĀ£ ņ£äļ░░ņČ£ņØ┤ļéś ņ£äņןĻ┤ĆņÜ┤ļÅÖņä▒ņØä ļ╣äĻĄÉĒĢ┤ļ│┤ļ®┤ ļŗłņ×ÉĒŗ░ļöśļ¦ī ņ£ĀņØśĒĢśĻ▓ī ņ£äņןņÜ┤ļÅÖņä▒ņØä ņ”ØĻ░Ćņŗ£ņ╝£ ņŗ£ļ®öĒŗ░ļöśņØ┤ļéś Ēīīļ¬©Ēŗ░ļöśņØś ņĢäņäĖĒŗĖņĮ£ļ”░ ļČäĒĢ┤ĒÜ©ņåī ņ¢ĄņĀ£ļŖźņØĆ ņ×äņāüņĀüņ£╝ļĪ£ ņØśļ»ĖĻ░Ć ņŚåļŖö Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż[21,22]. ĒŖ╣Ē׳ Ēü┤ļĪ£ļŗłļöśņ£╝ļĪ£ ņ£äļ░░ņČ£ņØä ņ¢ĄņĀ£ņŗ£Ēé© ņāüĒā£ņŚÉņä£ļÅä ņŗ£ļ®öĒŗ░ļöśņØ┤ļéś Ēīīļ¬©Ēŗ░ļöśĻ│╝ļŖö ļŗ¼ļ”¼ ļŗłņ×ÉĒŗ░ļöśņØĆ ņ£äļ░░ņČ£ņØä ĒÜīļ│Ąņŗ£ņ╝░ļŗż[14]. ļŗłņ×ÉĒŗ░ļöśņØś ĒÜ©Ļ│╝ļŖö ņŻ╝ļĪ£ ņ£äņĀäņĀĢļČĆņÖĆ ņŗŁņØ┤ņ¦ĆņןņØś ņÜ┤ļÅÖņä▒ņØä ņ”ØĻ░Ćņŗ£ņ╝░Ļ│Ā ņŗŁņØ┤ņ¦Ćņן ĒĢśļČĆņØś ņåīņןņŚÉļŖö ņśüĒ¢źņØ┤ ņ×æņĢśļŗż[14]. ņØ┤ļ¤░ ļŗłņ×ÉĒŗ░ļöśĻ│╝ Ēīīļ¬©Ēŗ░ļöśņØś ņ£äļ░░ņČ£ņŚÉ ļīĆĒĢ£ ņä£ļĪ£ ļŗżļźĖ ņśüĒ¢źņØĆ ļ│Ė ņŗżĒŚśņŚÉņä£ļÅä ĒÖĢņØĖļÉśņŚłļŗż. ĒĢ£ĒÄĖ ņĢäņäĖĒŗĖņĮ£ļ”░ ļČäĒĢ┤ĒÜ©ņåīļź╝ ņ¢ĄņĀ£ĒĢśļŖö ļäżņśżņŖżĒŗ░ĻĘĖļ»╝ņØ┤ ņŗØĒøä ņåīĒÖö ņāüĒā£ņØś ņÜ┤ļÅÖņä▒ļ¦ī ņ”ØĻ░Ćņŗ£ĒéżļŖö ļ░śļ®┤ ļŗłņ×ÉĒŗ░ļöśņØĆ Ļ│Ąļ│Ąņŗ£ ņĢłņĀĢ ņāüĒā£ ņÜ┤ļÅÖņä▒ļÅä ņ”ØĻ░Ćņŗ£Ēé¼ ņłś ņ׳ĻĖ░ ļĢīļ¼ĖņŚÉ ņĢäņäĖĒŗĖņĮ£ļ”░ ļČäĒĢ┤ĒÜ©ņåī ņ¢ĄņĀ£ļŖź ņÖĖņŚÉ ļśÉ ļŗżļźĖ ĻĖ░ņĀäņØ┤ ņ׳ņØä Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉśņŚłļŗż[21,23]. ļŗłņ×ÉĒŗ░ļöśņØś ļīĆņé¼ņé░ļ¼╝ņØĖ N-Desmethyl ļŗłņ×ÉĒŗ░ļöśņØś ļŗ©ļÅģ Ēł¼ņŚ¼ļ¦īņ£╝ļĪ£ļÅä ņ£äļ░░ņČ£ ņ”ØĻ░Ćļź╝ ļ│┤ņśĆņ£╝ļ®░ ņĢäĒŖĖļĪ£ĒĢĆņŚÉ ņØśĒĢ┤ ĻĘĖ ĒÜ©Ļ│╝Ļ░Ć ņé¼ļØ╝ņĀĖ ļŗłņ×ÉĒŗ░ļöśņØś ļīĆņé¼ņé░ļ¼╝ņØś ņ×æņÜ®ņØĆ ņĢäņäĖĒŗĖņĮ£ļ”░ ļČäĒĢ┤ĒÜ©ņåī ņ¢ĄņĀ£ ĒÜ©Ļ│╝ļ┐Éļ¦ī ņĢäļŗłļØ╝ ĒÅēĒÖ£ĻĘ╝ņŚÉ ļīĆĒĢ£ ņ¦üņĀæņĀüņØĖ ņĮ£ļ”░ņä▒ ņ×æņÜ®ņØ┤ ņ׳ņØīņØ┤ ĒÖĢņØĖļÉśņŚłĻ│Ā ņØ┤ļŖö ļŗłņ×ÉĒŗ░ļöśņŚÉ ņØśĒĢ£ ņ£äņןĻ┤ĆņÜ┤ļÅÖņØä ņ”ØĻ░Ćņŗ£ĒéżļŖö ļśÉ ĒĢśļéśņØś ĻĖ░ņĀäņ£╝ļĪ£ ņĀ£ņŗ£ļÉśņŚłļŗż[22].
ļŗłņ×ÉĒŗ░ļöśņØä ņØ┤ņÜ®ĒĢ£ ņ×äņāü ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņŚÉĻ▓ī Ēł¼ņŚ¼Ē¢łņØä ļĢī ņ£äļ░░ņČ£ Ļ░ÉņåīņÖĆ ņŚ░Ļ┤ĆļÉ£ ņ”ØņāüņØä Ļ░£ņäĀņŗ£Ēé©ļŗżĻ│Ā ļ│┤Ļ│ĀļÉśņŚłĻ│Ā[24,25], ņŚŁļźśņä▒ ņŗØļÅäņŚ╝ ĒÖśņ×ÉņØś ņ£Āņ¦Ć ņ╣śļŻīņŚÉņä£ļÅä Ēīīļ¬©Ēŗ░ļöśĻ│╝ ļ╣äĻĄÉĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī ļŹö ļåÆņØĆ ņ×¼ļ░£ Ļ░Éņåīņ£©Ļ│╝ ņØ╝ļČĆ ļåÆņØĆ Ļ┤ĆĒĢ┤ņ£©ņØä ļ│┤ņśĆļŗż[26]. ĻĘĖļ¤¼ļéś ļŗłņ×ÉĒāĆļöś Ēł¼ņŚ¼Ļ░Ć Ļ│ĀĒśĢņŗØņØś ņ£äļ░░ņČ£ņØä ņ¦ĆņŚ░ņŗ£Ēé©ļŗżļŖö ļ│┤Ļ│ĀļÅä ņ׳ļŗż[27]. ņ£äņé░ ņ¢ĄņĀ£ņĀ£ņŚÉ ņ£äņןĻ┤ĆņÜ┤ļÅÖ ņ┤ēņ¦ä ĻĖ░ļŖźņØä ņČöĻ░ĆĒĢśļ®┤ ņ£äļ░░ņČ£ļŖź ņ”ØĻ░Ćļ┐Éļ¦ī ņĢäļŗłļØ╝ ņ£äņé░ ņ¢ĄņĀ£ņŚÉļÅä ļŹö ĒÜ©Ļ│╝ņĀüņØ┤ļØ╝ļŖö ņØ┤ņĀä ņŚ░ĻĄ¼ Ļ▓░Ļ│╝ļź╝ Ļ│ĀļĀżĒĢĀ ļĢī ņØ┤ļĪĀņĀüņ£╝ļĪ£ ņŖżĒŖĖļĀłņŖż ņāüĒÖ®ņŚÉņä£ ņ£äļ░░ņČ£ļŖź ņĀĆĒĢśĻ░Ć ļÅÖļ░śļÉ£ Ļ▓ĮņÜ░ ļŗżļźĖ H2RAņŚÉ ļ╣äĒĢ┤ ļŗłņ×ÉĒŗ░ļöśņØ┤ ļŹö ņ£ĀņÜ®ĒĢĀ ņłś ņ׳ļŗż. ĻĘĖļ¤¼ļéś ņĢäņ¦üĻ╣īņ¦Ć ņŖżĒŖĖļĀłņŖżļéś ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ē ĒÖśņ×Éļź╝ ļīĆņāüņ£╝ļĪ£ ļŗłņ×ÉĒŗ░ļöśĻ│╝ Ēīīļ¬©Ēŗ░ļöśņØś ĒÜ©Ļ│╝ļź╝ ņ¦üņĀæ ļ╣äĻĄÉĒĢ£ ņŚ░ĻĄ¼ļŖö ņŚåņŚłļŗż. ņØ┤ņŚÉ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ĒØ░ņźÉļź╝ ņØ┤ņÜ®ĒĢ┤ ĻĄ¼ņåŹ ņŖżĒŖĖļĀłņŖżļĪ£ ņ£äļ░░ņČ£ļŖźņØ┤ ņĀĆĒĢśļÉ£ ņāüĒā£ņŚÉņä£ ļæÉ H2RAņØś ĒÜ©Ļ│╝ļź╝ ļ╣äĻĄÉĒĢśņśĆļŗż. ņŖżĒŖĖļĀłņŖżļŖö ņ£äļ░░ņČ£ļŖźņØä Ļ░Éņåīņŗ£ĒéżļŖöļŹ░ ļŗłņ×ÉĒŗ░ļöśņØä Ēł¼ņŚ¼Ē¢łļŹś Ļ▓ĮņÜ░ ĻĘĖ Ļ░Éņåī ņĀĢļÅäĻ░Ć ņĀüņ¢┤ ļ╣äņŖżĒŖĖļĀłņŖżĻĄ░Ļ│╝ ņ£ĀņØśĒĢ£ ņ░©ņØ┤Ļ░Ć ņŚåņŚłļŗż. ļ░śļ®┤ Ēīīļ¬©Ēŗ░ļöśņØä Ēł¼ņŚ¼ĒĢ£ Ļ▓ĮņÜ░ļŖö ļ╣äņŖżĒŖĖļĀłņŖżĻĄ░ņŚÉ ļ╣äĒĢ┤ ņ£ĀņØśĒĢśĻ▓ī ņ£äļ░░ņČ£ļŖźņØ┤ Ļ░ÉņåīļÉśņŚłĻ│Ā ņśżĒ׳ļĀż ņŗØņłśļ¦ī Ēł¼ņŚ¼ĒĢ£ ĻĄ░ļ│┤ļŗż ļŹö ļé«ņØĆ Ļ▓ĮĒ¢źņØä ļ│┤ņśĆļŗż. ļ│Ė ņŚ░ĻĄ¼ņØś Ļ▓░Ļ│╝ļŖö ņŖżĒŖĖļĀłņŖżņÖĆ ņŚ░Ļ┤ĆļÉśņ¢┤ ņ£äļ░░ņČ£ņØ┤ Ļ░ÉņåīļÉ£ ĻĖ░ļŖźņä▒ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņŚÉĻ▓ī ņ£äņé░ ņ¢ĄņĀ£ņĀ£ļź╝ ņäĀĒāØĒĢśļŖö Ļ▓ĮņÜ░ ņ£äņןĻ┤Ć ņÜ┤ļÅÖ ņ┤ēņ¦äĻĖ░ļŖźņØä Ļ░Ćņ¦ĆļŖö ļŗłņ×ÉĒŗ░ļöśņØ┤ ņ£ĀņÜ®ĒĢĀ ņłś ņ׳ņØīņØä ņŗ£ņé¼ĒĢ£ļŗż.
ņĢäņäĖĒŗĖņĮ£ļ”░, Ē׳ņŖżĒāĆļ»╝, Ļ░ĆņŖżĒŖĖļ”░ņØ┤ ļ▓ĮņäĖĒżņŚÉņä£ ņ£äņé░ļČäļ╣äņØś ņ×ÉĻĘ╣ ņØĖņ×ÉļĪ£ ņ×æņÜ®ĒĢ£ļŗżļŖö ņĀÉņØä Ļ│ĀļĀżĒĢśļ®┤ ļŗłņ×ÉĒŗ░ļöśņØ┤ ņ£äņןĻ┤Ć ņÜ┤ļÅÖņØä ņ┤ēņ¦äĒĢśļŖö ļÅÖņŗ£ņŚÉ ņ”ØĻ░ĆļÉ£ ņĢäņäĖĒŗĖņĮ£ļ”░ ļĢīļ¼ĖņŚÉ ņ£äņé░ļČäļ╣äļÅä ņ”ØĻ░ĆļÉśņ¢┤ ņ£äņé░ ņ¢ĄņĀ£ ĒÜ©Ļ│╝ņØś ņĖĪļ®┤ņŚÉņä£ļŖö ļČłļ”¼ĒĢĀ Ļ░ĆļŖźņä▒ņØ┤ ņĀ£ĻĖ░ļÉĀ ņłśļÅä ņ׳ļŗż. ĻĘĖļ¤¼ļéś ļ│Ė ņŗżĒŚśņŚÉņä£ļŖö ņøÉņ£äļČĆ ļ░Å ĻĘ╝ņ£äļČĆ ņ▓┤ļČĆ ļ¬©ļæÉņŚÉņä£ ņĖĪņĀĢĒĢ£ ņ£ä ļé┤ pHĻ░Ć ļŗłņ×ÉĒŗ░ļöś Ēł¼ņŚ¼ĻĄ░Ļ│╝ Ēīīļ¬©Ēŗ░ļöś Ēł¼ņŚ¼ĻĄ░ ņé¼ņØ┤ņŚÉ ņ░©ņØ┤Ļ░Ć ņŚåņ¢┤ ļŗłņ×ÉĒŗ░ļöśņØ┤ ņŗĀĻ▓ĮĻĘ╝ņ£Ī ņĀæĒĢ®ļČĆņŚÉņä£ ņĢäņäĖĒŗĖņĮ£ļ”░ņØä ņ”ØĻ░Ćņŗ£Ēé©ļŗżĻ│Ā ĒĢśļŹöļØ╝ļÅä ļ▓ĮņäĖĒżņŚÉļŖö Ēü░ ņśüĒ¢źņØ┤ ņŚåļŖö Ļ▓āņ£╝ļĪ£ ĒīÉļŗ©ļÉ£ļŗż.
ļØ╝ĒæĖĒŗ░ļöśņØ┤ļéś ņśżļ®öĒöäļØ╝ņĪĖņŚÉ ņäĀĒāØņĀü 5-HT4 ņ×æņÜ®ņĀ£ņØĖ ļ¬©ņé¼Ēöäļ”¼ļō£ļź╝ ļ│æĒĢ® Ēł¼ņŚ¼ĒĢśļ®┤ ļŗ©ļÅģ Ēł¼ņŚ¼ņŚÉ ļ╣äĒĢ┤ ņ£ä ļé┤ pHĻ░Ć ļŹö ļ╣©ļ”¼ ņāüņŖ╣ĒĢśļŖö Ļ▓āņØ┤ Ļ▒┤Ļ░ĢņØĖ ļīĆņāü ņŚ░ĻĄ¼ņŚÉņä£ ņ”Øļ¬ģļÉśņŚłļŗż[10,11]. ļ│Ė ņŚ░ĻĄ¼ņ×ÉļōżņØś ņØ┤ņĀä ļÅÖļ¼╝ņŗżĒŚśņŚÉņä£ļÅä ņŖżĒŖĖļĀłņŖż ņŚ¼ļČĆņÖĆ Ļ┤ĆĻ│äņŚåņØ┤ Ēīīļ¬©Ēŗ░ļöśņŚÉ ļ¬©ņé¼Ēöäļ”¼ļō£ļź╝ ļ│æĒĢ®ĒĢ£ Ļ▓ĮņÜ░ ņ£ä ļé┤ pHĻ░Ć ļŹö ļåÆņĢäņ¦ĆļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆļŗż[12]. ņ£äņé░ ņ¢ĄņĀ£ņĀ£ņÖĆ ļ¬©ņé¼Ēöäļ”¼ļō£ļź╝ ļ│æĒĢ®ĒĢśņśĆņØä ļĢī ņ£äņé░ ņ¢ĄņĀ£ ĒÜ©Ļ│╝Ļ░Ć ļŹö ļ╣©ļ”¼ ļ░£ĒśäļÉśļŖö ĻĖ░ņĀäņ£╝ļĪ£ļŖö ņ£äņןĻ┤ĆņÜ┤ļÅÖ ņ┤ēņ¦äņĀ£Ļ░Ć ņ£ä ļ░░ņČ£ņØä ņ”ØĻ░Ćņŗ£Ēéżļ®┤ ņ£äņé░ ņ¢ĄņĀ£ņĀ£Ļ░Ć ņŗŁņØ┤ņ¦Ćņןņ£╝ļĪ£ ļ╣©ļ”¼ ņØ┤ļÅÖ Ēøä ĒØĪņłśļÉśļ»ĆļĪ£ ņ£äņé░ ņ¢ĄņĀ£ ĒÜ©Ļ│╝Ļ░Ć ņØ╝ņ░Ź ļéśĒāĆļéśļŖö Ļ▓āņ£╝ļĪ£ ņäżļ¬ģļÉ£ļŗż. ņØ┤Ļ▓āņØĆ ĻĖ░ļŖźņä▒ ņåīĒÖöļČłļ¤ēņ”Ø ĒÖśņ×ÉņŚÉņä£ ņ£äņé░ ļČäļ╣ä ņ¢ĄņĀ£ņĀ£ņÖĆ ņ£äņןĻ┤ĆņÜ┤ļÅÖ ņ┤ēņ¦äņĀ£ļź╝ ļ│æĒĢ® Ēł¼ņŚ¼ĒĢśļ®┤ ņ£äļ░░ņČ£ ņ”ØĻ░Ćļ┐Éļ¦ī ņĢäļŗłļØ╝ ņ£äņé░ ļČäļ╣ä ņ¢ĄņĀ£ņŚÉļÅä ĒÜ©Ļ│╝ņĀüņØ╝ ņłś ņ׳ņØīņØä ļÆĘļ░øņ╣©ĒĢśļŖö Ļ▓āņØ┤ļŗż. ĻĘĖļ¤░ļŹ░ ļŗłņ×ÉĒŗ░ļöśņØĆ Ēīīļ¬©Ēŗ░ļöśņŚÉ ļ¬©ņé¼Ēöäļ”¼ļō£ļź╝ ļ│æĒĢ® Ēł¼ņŚ¼ĒĢśļŖö Ļ▓āĻ│╝ ļ╣äņŖĘĒĢ£ ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļé┤ ņ£äļ░░ņČ£ņØä ņ”ØĻ░Ćņŗ£Ēéżņ¦Ćļ¦ī ņ£äņé░ ļČäļ╣ä ņ¢ĄņĀ£ņØś ņĖĪļ®┤ņŚÉņä£ļŖö Ēīīļ¬©Ēŗ░ļöśņŚÉ ļ¬©ņé¼Ēöäļ”¼ļō£ļź╝ ļ│æĒĢ®ĒĢ£ Ļ▓āļ¦īĒü╝ ļŹö ņ£ĀņÜ®ĒĢ£ ĒÜ©Ļ│╝ļź╝ ļ│┤ņŚ¼ņŻ╝ņ¦Ć ļ¬╗Ē¢łļŗż. ņØ┤ļŖö ļŗłņ×ÉĒŗ░ļöśņØś ņ£äņןĻ┤ĆņÜ┤ļÅÖ ņ┤ēņ¦ä ĒÜ©Ļ│╝Ļ░Ć ļ¬©ņé¼Ēöäļ”¼ļō£ļ│┤ļŗżļŖö ļé«ĻĖ░ ļĢīļ¼Ėņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
ļŗłņ×ÉĒŗ░ļöśņØś ņ£äņןĻ┤Ć ņ┤ēņ¦ä ĒÜ©Ļ│╝ļŖö ņĢäņäĖĒŗĖņĮ£ļ”░ ļČäĒĢ┤ĒÜ©ņåīļź╝ ņ¢ĄņĀ£ĒĢśļŖö ĻĖ░ņĀäņØ┤ļ»ĆļĪ£ ļŗżļźĖ ĻĖ░ņĀäņØś ļ¬©ņé¼Ēöäļ”¼ļō£ļź╝ ļ│æĒĢ®ĒĢśļ®┤ ĻĘĖ ĒÜ©Ļ│╝Ļ░Ć ļŹö ļåÆņĢäņ¦ł ņłśļÅä ņ׳ļŗż. ņØ┤ļź╝ ĒÖĢņØĖĒĢśĻĖ░ ņ£äĒĢ┤ ļ│Ė ņŚ░ĻĄ¼ņŚÉņä£ļŖö ļŗłņ×ÉĒŗ░ļöśņŚÉ ļ¬©ņé¼Ēöäļ”¼ļō£ļź╝ ļ│æĒĢ® Ēł¼ņŚ¼ĒĢ┤ Ēīīļ¬©Ēŗ░ļöśņØ┤ļéś ļŗłņ×ÉĒŗ░ļöśņØä ļŗ©ļÅģņ£╝ļĪ£ Ēł¼ņŚ¼ĒĢ£ Ļ▓ĮņÜ░ņÖĆ ļ╣äĻĄÉĒĢśņśĆļŗż. ļŗłņ×ÉĒŗ░ļöśĻ│╝ ļ¬©ņé¼Ēöäļ”¼ļō£ ļ│æĒĢ® Ēł¼ņŚ¼ĻĄ░ņØĆ ņøÉņ£äļČĆ ņ▓┤ļČĆņŚÉņä£ Ēīīļ¬©Ēŗ░ļöś ļŗ©ļÅģ Ēł¼ņŚ¼ĻĄ░ļ│┤ļŗż ņ£äļé┤ pHĻ░Ć ņ£ĀņØśĒĢśĻ▓ī ļŹö ļåÆņĢäņ¦ĆļŖö Ļ▓āņØä ĒÖĢņØĖĒĢśņśĆņ£╝ļéś ļŗłņ×ÉĒŗ░ļöś ļŗ©ļÅģ Ēł¼ņŚ¼ĻĄ░Ļ│╝ļŖö ĒåĄĻ│äņĀü ņ░©ņØ┤ļź╝ ļ│┤ņØ┤ņ¦Ć ņĢŖņĢśļŗż. ļ░śļ®┤ ĻĘ╝ņ£äļČĆ ņ▓┤ļČĆņŚÉņä£ļŖö ļ│æĒĢ® Ēł¼ņŚ¼ĻĄ░ņØ┤ ļŗłņ×ÉĒŗ░ļöś ļŗ©ļÅģ Ēł¼ņŚ¼ĻĄ░ĒĢśĻ│Āļ¦ī ĒåĄĻ│äņĀüņ£╝ļĪ£ ņ£ĀņØśĒĢ£ ņ░©ņØ┤ļź╝ ļ│┤ņśĆļŗż. ņØ┤ņĀä ņŚ░ĻĄ¼ņŚÉņä£ pHĻ░Ć ļåÆņØĆ ĻĘ╝ņ£äļČĆ ņ▓┤ļČĆņŚÉņä£ļŖö ļ│æĒĢ® ņÜöļ▓ĢĻ│╝ ļŗ©ļÅģ ņÜöļ▓ĢņØś pH ņ░©ņØ┤ļź╝ ņØ╝Ļ┤ĆļÉśĻ▓ī Ļ┤Ćņ░░ĒĢĀ ņłś ņŚåņ¢┤ pHĻ░Ć ļé«ņØĆ ņøÉņ£äļČĆ ņ▓┤ļČĆ ņĖĪņĀĢĻ░ÆņØä ĻĖ░ņżĆņ£╝ļĪ£ ĒĢĀ Ļ▓āņØä ņĀ£ņĢłĒ¢łļŖöļŹ░ ļ│Ė ņŗżĒŚśņŚÉņä£ļÅä ņøÉņ£äļČĆņØś pHĻ░Ć ļŹö ļé«ņĢśļŗż. ņØ┤ļŖö ĻĘ╝ņ£äļČĆ ņ▓┤ļČĆņØś Ļ▓ĮņÜ░ ņ£äņé░ ļČäļ╣äĻ░Ć ņŚåļŖö nonglandular forestomachņÖĆ ņØĖņĀæĒĢ┤ ņØīņŗØļ¼╝Ļ│╝ ņä×ņØ┤ļ®┤ņä£ pHĻ░Ć ņāüņŖ╣ļÉśĻ│Ā ņĖĪņĀĢĻ░ÆņØś ļ│ĆļÅÖņØ┤ ņŗ¼ĒĢśĻĖ░ ļĢīļ¼Ėņ£╝ļĪ£ ņČöņĀĢļÉ£ļŗż. ļ¦īņĢĮ ļ│Ė ņŗżĒŚśņØś ņøÉņ£äļČĆņØś Ļ▓░Ļ│╝ļ¦ī Ļ│ĀļĀżĒĢ£ļŗżļ®┤ ļŗłņ×ÉĒŗ░ļöśņŚÉ ļ¬©ņé¼Ēöäļ”¼ļō£ļź╝ ļ│æĒĢ® Ēł¼ņŚ¼ĒĢśļŖö Ļ▓āņØĆ Ēīīļ¬©Ēŗ░ļöś ļŗ©ļÅģ Ēł¼ņŚ¼ņŚÉ ļ╣äĒĢ┤ņä£ļŖö pHļź╝ ņ£ĀņØśĒĢśĻ▓ī ļåÆņśĆņ¦Ćļ¦ī ļŗłņ×ÉĒŗ░ļöśļ¦ī ļŗ©ļÅģ Ēł¼ņŚ¼ĒĢ£ Ļ▓āĻ│╝ ļ╣äĻĄÉĒĢśļ®┤ ņČöĻ░ĆņĀüņØĖ pH ņāüņŖ╣ ĒÜ©Ļ│╝ļź╝ Ļ┤Ćņ░░ĒĢĀ ņłś ņŚåņŚłļŗż. ņØ┤Ļ▓āņØĆ ņØ┤ļ»Ė ļŗłņ×ÉĒŗ░ļöś ņ×Éņ▓┤ņØś ņ£äņןĻ┤ĆņÜ┤ļÅÖ ņ┤ēņ¦ä ņ×æņÜ®ņØ┤ ņ£äļ░░ņČ£ņØä ņ¢┤ļŖÉ ņĀĢļÅä ņ”ØĻ░Ćņŗ£ņ╝░ĻĖ░ ļĢīļ¼ĖņŚÉ ļ¬©ņé¼Ēöäļ”¼ļō£Ļ░Ć ņČöĻ░ĆņĀüņ£╝ļĪ£ ņ£äļ░░ņČ£ņØä ļŹö ņ”ØĻ░Ćņŗ£ņ╝░ļŗżĻ│Ā ĒĢ┤ļÅä ĻĘĖ ņ░©ņØ┤Ļ░Ć ņ£äņé░ ņ¢ĄņĀ£ ĒÜ©Ļ│╝ņŚÉ ņśüĒ¢źņØä ļ»Ėņ╣Ā ļ¦īĒü╝ Ēü¼ņ¦Ć ļ¬╗ĒĢ£ Ļ▓āņ£╝ļĪ£ ĒĢ┤ņäØĒĢĀ ņłś ņ׳ļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£ ļ│Ė ņŚ░ĻĄ¼ņØś Ļ▓░Ļ│╝ļź╝ ņóģĒĢ®ĒĢ┤ļ│┤ļ®┤, ļŗłņ×ÉĒŗ░ļöś Ēł¼ņŚ¼ļŖö Ēīīļ¬©Ēŗ░ļöś Ēł¼ņŚ¼ņÖĆ ļ╣äņŖĘĒĢ£ ņ£äņé░ ļČäļ╣ä ņ¢ĄņĀ£ ĒÜ©Ļ│╝ļź╝ ļéśĒāĆļé┤ļ®░ ļÅÖņŗ£ņŚÉ Ēīīļ¬©Ēŗ░ļöś Ēł¼ņŚ¼ņŚÉņä£ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņØĆ ņ£äļ░░ņČ£ ĒĢŁņ¦ä ĒÜ©Ļ│╝ļÅä ļéśĒāĆļéĖļŗż. ĻĘĖļ¤¼ļ»ĆļĪ£ ņŖżĒŖĖļĀłņŖżņÖĆ ņŚ░Ļ┤ĆļÉśņ¢┤ ņ£äļ░░ņČ£ļŖźņØ┤ Ļ░ÉņåīļÉ£ ĒÖśņ×ÉņØś ņåīĒÖöļČłļ¤ēņ”ØņØä ņ╣śļŻīĒĢĀ ļĢī ļŗłņ×ÉĒŗ░ļöśņØ┤ ļŗżļźĖ H2RAņŚÉ ļ╣äĒĢ┤ ļŹö ĒÜ©Ļ│╝ņĀüņØ╝ ņłś ņ׳Ļ│Ā, ĒŖ╣Ē׳ ļŗżņĢĮņĀ£ļź╝ ļ│ĄņÜ® ņżæņØĖ ĒÖśņ×ÉņŚÉņä£ ņĢĮņĀ£ Ļ░£ņłśļź╝ ņżäņØ┤ļŖö ĒÜ©Ļ│╝ļÅä ĻĖ░ļīĆĒĢĀ ņłś ņ׳ņ¢┤ ņ×äņāüņŚÉņä£ ņ£ĀņÜ®ĒĢśĻ▓ī ņé¼ņÜ®ļÉĀ Ļ▓āņ£╝ļĪ£ ņāØĻ░üļÉ£ļŗż.
Fig.┬Ā1.
Overview of the current experiment. (A) Protocol showing measurement of intragastric pH and the gastric emptying rate using a restraint stress rat model. (B) Image showing sites of measurement of intragastric pH in the rat stomach.
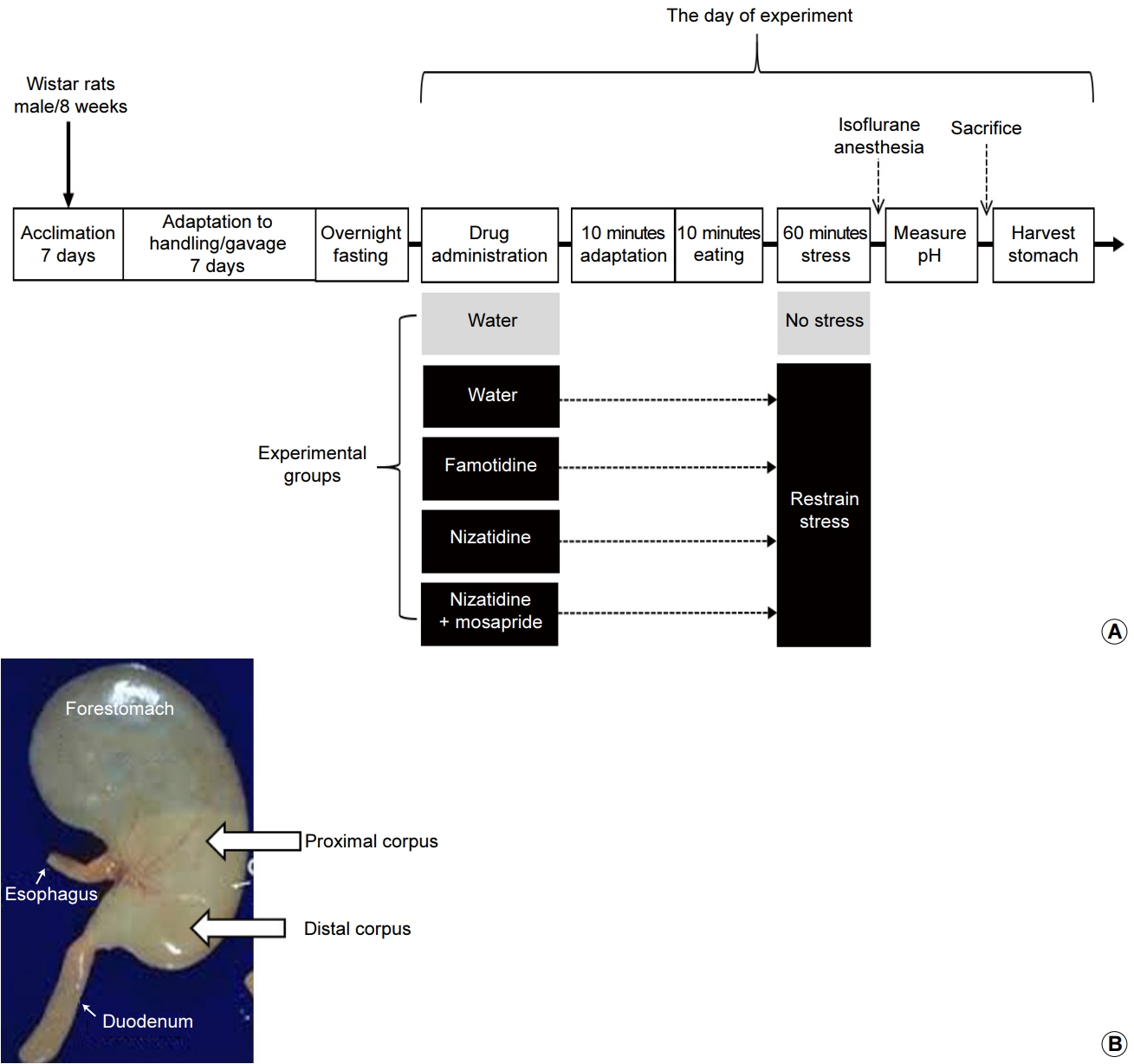
Fig.┬Ā2.
Comparison of the gastric emptying rate in the stress study. The gastric emptying rate is significantly lower in the stress-water and
stress-famotidine groups than in the nonstress-water group. However, no significant difference is observed between the nonstress-water group and
the stress-nizatidine or the stress-nizatidine with mosapride groups. Notably, the gastric emptying rate is significantly higher in the stress-nizatidine
with mosapride group than in the stress-famotidine group. N=6/group. Denotes the post hoc significance between groups (*P<0.05; **P<0.01).

Fig.┬Ā3.
Comparison of intragastric pH in the stress study. Measurement of intragastric pH in the proximal and distal gastric corpus 10 minutes after feeding. The pH is significantly higher in the drug-treated group than in the water-treated nonstress and stress groups. The pH is significantly higher in the stress-nizatidine with mosapride group than in the stress-famotidine group in the distal corpus. However, the pH is significantly higher in the stress-nizatidine with mosapride group than in the stress-nizatidine group in the proximal corpus. N=6/group. Data are expressed as mean┬▒standard error. Denotes the post-hoc analyses significance between the groups (*P<0.05; ***P<0.001). Statistical significance between the stress and non-stress control groups is not expressed in this graph.
REFERENCES
1. Stanghellini V, Chan FK, Hasler WL, et al. Gastroduodenal disorders. Gastroenterology 2016;150:1380-1392.


2. Ford AC, Mahadeva S, Carbone MF, Lacy BE, Talley NJ. Functional dyspepsia. Lancet 2020;396:1689-1702.


3. Samsom M, Verhagen MA, vanBerge Henegouwen GP, Smout AJ. Abnormal clearance of exogenous acid and increased acid sensitivity of the proximal duodenum in dyspeptic patients. Gastroenterology 1999;116:515-520.


4. Lee KJ, Tack J. Duodenal implications in the pathophysiology of functional dyspepsia. J Neurogastroenterol Motil 2010;16:251-257.



5. Oh JH, Kwon JG, Jung HK, et al. Clinical practice guidelines for functional dyspepsia in Korea. J Neurogastroenterol Motil 2020;26:29-50.



6. Wauters L, Ceulemans M, Frings D, et al. Proton pump inhibitors reduce duodenal eosinophilia, mast cells, and permeability in patients with functional dyspepsia. Gastroenterology 2021;160:1521-1531; e9.


7. Parkman HP, Urbain JL, Knight LC, et al. Effect of gastric acid suppressants on human gastric motility. Gut 1998;42:243-250.



8. Sanaka M, Yamamoto T, Kuyama Y. Effects of proton pump inhibitors on gastric emptying: a systematic review. Dig Dis Sci 2010;55:2431-2440.



9. Lim HC, Kim JH, Youn YH, Lee EH, Lee BK, Park H. Effects of the addition of mosapride to gastroesophageal reflux disease patients on proton pump inhibitor: a prospective randomized, double-blind study. J Neurogastroenterol Motil 2013;19:495-502.



10. Iida H, Inamori M, Fujii T, et al. Early effect of oral administration of omeprazole with mosapride as compared with those of omeprazole alone on the intragastric pH. BMC Gastroenterol 2012;12:25.




11. Iida H, Inamori M, Nozaki Y, et al. Early effects of oral administration of lafutidine with mosapride compared with lafutidine alone on intragastric pH values. BMC Gastroenterol 2009;9:52.




12. Choi HS, Kim EJ, Kim MS, et al. Effect of combination therapy of oral famotidine with mosapride on intragastric pH and gastric emptying in rats. Korean J Helicobacter Up Gastrointest Res 2021;21:220-225.


13. Song HY, Jung SW, Kim YS. Prokinetic agents. Korean J Helicobacter Up Gastrointest Res 2022;22:86-101.


14. Ueki S, Matsunaga Y, Yoneta T, Tamaki H, Itoh Z. Gastroprokinetic activity of nizatidine during the digestive state in the dog and rat. Arzneimittelforschung 1999;49:618-625.


15. Choi YJ. Can the combination of famotidine and prokinetics have additional effects on gastric acid suppression? Korean J Helicobacter Up Gastrointest Res 2021;21:171-172.


16. Nakade Y, Tsuchida D, Fukuda H, Iwa M, Pappas TN, Takahashi T. Restraint stress delays solid gastric emptying via a central CRF and peripheral sympathetic neuron in rats. Am J Physiol Regul Integr Comp Physiol 2005;288:R427-R432.


17. Labanski A, Langhorst J, Engler H, Elsenbruch S. Stress and the brain-gut axis in functional and chronic-inflammatory gastrointestinal diseases: a transdisciplinary challenge. Psychoneuroendocrinology 2020;111:104501.


18. Song CW, Chun HJ, Kim CD, Ryu HS, Choe JG, Hyun JH. Effects of levosulpiride in patients with functional dyspepsia accompanied by delayed gastric emptying. Korean J Intern Med 1998;13:15-21.



19. Mansi C, Savarino V, Vigneri S, et al. Effect of D2-dopamine receptor antagonist levosulpiride on diabetic cholecystoparesis: a double-blind crossover study. Aliment Pharmacol Ther 1995;9:185-189.


20. Melga P, Mansi C, Ciuchi E, Giusti R, Sciaba L, Prando R. Chronic administration of levosulpiride and glycemic control in IDDM patients with gastroparesis. Diabetes Care 1997;20:55-58.



21. Ueki S, Seiki M, Yoneta T, et al. Gastroprokinetic activity of nizatidine, a new H2-receptor antagonist, and its possible mechanism of action in dogs and rats. J Pharmacol Exp Ther 1993;264:152-157.

22. Kaneko H, Mitsuma T, Uchida K, Nagai H, Harada M, Kotera H. Nizatidine accelerates gastric emptying of a solid meal in rats. Dig Dis Sci 1995;40:2043-2051.



23. Kounenis G, Koutsoviti-Papadopoulou M, Elezoglou V. The excitatory effect of the new histamine H2-receptor antagonist nizatidine (LY 139037) on the guinea pig ileum. J Pharmacobiodyn 1987;10:669-672.

24. Futagami S, Shimpuku M, Song JM, et al. Nizatidine improves clinical symptoms and gastric emptying in patients with functional dyspepsia accompanied by impaired gastric emptying. Digestion 2012;86:114-121.



25. Futagami S, Yamawaki H, Izumi N, et al. Impact of sleep disorders in Japanese patients with functional dyspepsia (FD): nizatidine improves clinical symptoms, gastric emptying and sleep disorders in FD patients. J Gastroenterol Hepatol 2013;28:1314-1320.



-
METRICS

-
- 1 Crossref
- 1,504 View
- 46 Download
- Related articles in Korean J Helicobacter Up Gastrointest Res






