 |
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 22(1); 2022 > Article |
|
Abstract
A 22-year-old man presented with recurrent dizziness and melena. He had no remarkable medical history except for the reflux symptoms for which 18 months of proton pump inhibitor (PPI) intake was required. Gastroscopy revealed a 1-cm, blood-tinged polyp within the gastric rugae. A thickened gastric corpus was observed with a regular arrangement of collecting venules on its surface. Hyperplastic foveolar epithelium was observed in the biopsied specimens from the fundus and gastric rugae. The diagnosis after polypectomy was gastric hyperplastic polyp. Abdominal CT revealed hypertrophy only in the gastric corpus without antral involvement. Increased levels of serum pepsinogen I (>160 ng/mL), pepsinogen II (>50 ng/mL), chromogranin A (>1,800 ng/mL), and gastrin (534 pg/mL) were noted. Three months after PPI discontinuation, CT revealed improvement of the hypertrophic gastric corpus. Serum chromogranin A and gastrin levels decreased to 950.4 ng/mL and 517.0 pg/mL, respectively. Herein, we report a young, Helicobacter pylori-naive patient with prominent hyperplasia in the gastric corpus and a bleeding hyperplastic polyp after long-term PPI use.
ņ£äņé░ņ¢ĄņĀ£ņĀ£ļź╝ ņןĻĖ░Ļ░ä ļ│ĄņÜ®ĒĢśļŖö ĒÖśņ×ÉļōżņØ┤ ļ¦ÄņĢäņ¦Ćļ®┤ņä£ ļŗżņ¢æĒĢ£ ļČĆņ×æņÜ®ņØ┤ ļ│┤Ļ│ĀļÉśĻ│Ā ņ׳ļŗż[1]. ņ¢æņä▒ņ×ÉĒÄīĒöäņ¢ĄņĀ£ņĀ£(proton pump inhibitor, PPI)ļź╝ ļ│ĄņÜ®ĒĢśļ®┤ ņ£äņĀĆņäĀņØś ļ▓ĮņäĖĒż(parietal cell)ļŖö ņ¢ĄņĀ£ļÉśņ¦Ćļ¦ī ņןĒü¼ļĪ¼ņ╣£ĒÖöņ£Āņé¼(enterochromaffin-like) ņäĖĒż, ņŻ╝ņäĖĒż(chief cell), Ļ░ĆņŖżĒŖĖļ”░(gastrin) ņäĖĒżļŖö ņāüļīĆņĀüņ£╝ļĪ£ ĒÖ£ņä▒ĒÖöļÉśņ¢┤ chromogranin A, Ē׳ņŖżĒāĆļ»╝, ĒÄ®ņŗ£ļģĖĻ▓É(pepsinogen, PG), Ļ░ĆņŖżĒŖĖļ”░ ļČäļ╣äĻ░Ć ņ”ØĻ░ĆĒĢ£ļŗż[2]. ņØ┤ ņżæņŚÉņä£ Ļ│ĀĻ░ĆņŖżĒŖĖļ”░Ēśłņ”ØņØĆ ņäĀņÖĆņāüĒö╝ ņ”ØņŗØ(foveolar epithelial hyperplasia)Ļ│╝ ļ▓ĮņäĖĒżņØś ļÅīņČ£ņØä ņ£Āļ░£ĒĢśņŚ¼ ņ£äņäĀ ĒśæļČĆ(glandular isthmus)ļź╝ ļ¦ēņĢä ņ£äņĀĆņäĀņØś ļéŁņä▒ ĒÖĢņןņØä ņ£Āļ░£ĒĢ£ļŗż[3]. ĻĘĖļ”¼Ļ│Ā ņØ┤ļ¤¼ĒĢ£ ļ│ĆĒÖöĻ░Ć ņןĻĖ░Ļ░ä ļłäņĀüļÉśļ®┤ ņ£äņĀĆņäĀ ņÜ®ņóģņØ┤ļéś Ļ│╝ĒśĢņä▒ ņÜ®ņóģ, ļŗżļ░£ņä▒ ĒØ░ņāē ņ£ĄĻĖ░ĒśĢ ļ│æļ│Ć(multiple white elevated lesion)ņØ┤ļéś ņĪ░ņĢĮļÅī ļ¬©ņ¢æņØś ņĀÉļ¦ē(cobblestone-like mucosa)ņØ┤ ĒśĢņä▒ļÉ£ļŗż[4].
PPI ļ│ĄņÜ® ĒøäņŚÉ ņÜ®ņóģņØ┤ ļ░£ņāØĒĢśļŖöļŹ░ Ļ▒Ėļ”¼ļŖö ĒÅēĻĘĀ ĻĖ░Ļ░äņØĆ 32.5Ļ░£ņøöļĪ£[5], Ēśłņ▓Ł Ļ░ĆņŖżĒŖĖļ”░ ņłśņ╣śĻ░Ć 400 pg/mL ņØ┤ņāüņ£╝ļĪ£ ļåÆņ£╝ļ®┤ Ļ│╝ĒśĢņä▒ ņÜ®ņóģņØ┤ ļ░£ņāØĒĢśĻĖ░ ņēĮļŗż[6]. ņ£äņĀĆņäĀ ņÜ®ņóģņØĆ Helicobacter pylori (H. pylori) Ļ░ÉņŚ╝ņØ┤ ņŚåņØäņłśļĪØ ĒśĖļ░£ĒĢśļŖöļŹ░, PPIļź╝ 6Ļ░£ņøö ņØ┤ņāü ļ│ĄņÜ®ĒĢśļ®┤ ļ░£ņāØļźĀņØ┤ 4.71ļ░░ ļåÆņĢäņ¦ĆĻ│Ā 1ļģä ņØ┤ņāü ļ│ĄņÜ®ĒĢśļ®┤ 5.32ļ░░ ļåÆņĢäņ¦äļŗż[7]. PPIļĪ£ ņØĖĒĢ£ ņ£äņĀĆņäĀ ņÜ®ņóģņØĆ ļŗżļźĖ ņ£äņĀĆņäĀ ņÜ®ņóģņŚÉ ļ╣äĒĢ┤ ļéŁņä▒ ĒÖĢņןņØ┤ Ēü¼Ļ│Ā ļ¦Äņ£╝ļ®░, ņäĀņÖĆņāüĒö╝ ņ”ØņŗØĻ│╝ ļ▓ĮņäĖĒż ļÅīņČ£ņØ┤ ņĀĆļ¬ģĒĢśĻ│Ā, Ki-67Ļ│╝ MUC5AC ņŚ╝ņāēņŚÉ ņ¢æņä▒ ņåīĻ▓¼ņØä ļ│┤ņØ┤ļŖö ņäĖĒżņØś ļ╣äņ£©ņØ┤ ļåÆļŗż[8]. ņĢäņÜĖļ¤¼ ļ▓ĮņäĖĒżņŚÉņä£ ļ░£ĒśäļÉśļŖö aquaporin-4 water channelĻ│╝ KCNQ1 potassium channel ņŚ╝ņāēņŚÉ ņ¢æņä▒ ņåīĻ▓¼ņØä ļ│┤ņØ┤ļŖö Ļ▓ĮņÜ░Ļ░Ć ĒØöĒĢśĻ│Ā, ņÜ®ņóģņŚÉņä£ ņČ£ĒśłņØ┤ Ļ┤Ćņ░░ļÉśĻĖ░ļÅä ĒĢ£ļŗż[9]. ĒĢ£ĒÄĖ, Ļ│ĀļĀ╣ņØś ņŚ¼ņä▒ņŚÉņä£ļŖö ņ£äņĀĆņäĀņØś ļéŁņä▒ ĒÖĢņןĻ│╝ ļ▓ĮņäĖĒż Ļ│╝ĒśĢņä▒ņØ┤ ļŗżļ░£ņä▒ ĒØ░ņāē ņ£ĄĻĖ░ĒśĢ ļ│æļ│Ćņ£╝ļĪ£ Ļ┤Ćņ░░ļÉśĻĖ░ ņē¼ņÜ┤ ļ░śļ®┤[10], Ļ│ĀļĀ╣ņØś ļé©ņä▒ņŚÉņä£ļŖö ņĪ░ņĢĮļÅī ļ¬©ņ¢æņØś ņĀÉļ¦ēņ£╝ļĪ£ Ļ┤Ćņ░░ļÉśĻĖ░ ņēĮļŗż[11]. ņןņāüĒö╝ĒÖöņāØņØ┤ ņ׳ļŖö Ļ│ĀļĀ╣ņØś ļé©ņä▒ņØ╝ņłśļĪØ ņäĀņÖĆņāüĒö╝ ņ”ØņŗØĻ│╝ ļ▓ĮņäĖĒż ļÅīņČ£ņØ┤ ņĀ£ĒĢ£ļÉśņ¢┤ Ēü░ ņÜ®ņóģņØä ļ¦īļōżņ¦Ć ļ¬╗ĒĢśĻ│Ā ņåīĻ▓░ņĀłĒśĢ ņ£ĄĻĖ░ļ¦ī ĒśĢņä▒ĒĢśĻĖ░ ļĢīļ¼ĖņØ┤ļŗż[12].
ņØ┤ ņ”ØļĪĆļŖö H. pylori Ļ░ÉņŚ╝ļĀźņØ┤ ņŚåļŖö 22ņäĖ ļé©ņä▒ņØ┤ 18Ļ░£ņøöĻ░ä PPIļź╝ ļ│ĄņÜ®ĒĢśļŹś ņżæ ĒØæņāēļ│ĆņØ┤ ļ░£ņāØĒĢśņŚ¼ Ļ▓Ćņé¼ĒĢ£ Ļ▓░Ļ│╝, ņ£ä ņ▓┤ļČĆņØś ļ╣äĒøäņÖĆ ņČ£Ēśłņä▒ Ļ│╝ĒśĢņä▒ ņÜ®ņóģņØ┤ ņ¦äļŗ©ļÉ£ ņ”ØļĪĆņØ┤ļŗż. ņÜ®ņóģ ņĀłņĀ£ņłĀĻ│╝ PPI ļ│ĄņÜ®ņØä ņżæļŗ©ĒĢ£ ĒøäņŚÉ ļæÉĻ║╝ņøĀļŹś ņ£äļ▓ĮņØ┤ ĒśĖņĀäļÉśļŖö ĻĄÉĒøłņĀüņØĖ ņ”ØļĪĆļź╝ Ļ▓ĮĒŚśĒ¢łĻĖ░ņŚÉ ļ│┤Ļ│ĀĒĢ£ļŗż.
22ņäĖ ļé©ņ×ÉĻ░Ć 2~3ņŻ╝ Ļ░äĻ▓®ņ£╝ļĪ£ ĒØæņāēļ│ĆĻ│╝ ņ¢┤ņ¦Ćļ¤¼ņøĆņØ┤ ļ░śļ│ĄļÉśņ¢┤ ņÖöļŗż. 1ļģä ļ░ś ļÅÖņĢł ņåŹņō░ļ”╝Ļ│╝ ļ¬ģņ╣ś ĒåĄņ”ØņØ┤ ņ׳ņ¢┤ņä£ 1ļģäĻ░ä omeprazole 40 mgņØä ļ│ĄņÜ®ĒĢśļŗżĻ░Ć ņ”ØņāüņØ┤ ņŗ¼ĒĢ┤ņĀĖņä£ ļ░śļģä ņĀäļČĆĒä░ļŖö pantoprazole 40 mgņ£╝ļĪ£ ļ░öĻ┐öņä£ ļ│ĄņÜ®ĒĢśļŖö ņżæņØ┤ļØ╝Ļ│Ā Ē¢łļŗż. ĒĢśņ¦Ćļ¦ī ņ”ØņāüņØĆ ĒśĖņĀäļÉśņ¦Ć ņĢŖņĢśņ£╝ļ®░, ņłśĻ░£ņøö ņĀäļČĆĒä░ ņŗ¼ĒĢ£ ņ¢┤ņ¦Ćļ¤¼ņøĆņØ┤ 2~3ņŻ╝ Ļ░äĻ▓®ņ£╝ļĪ£ ļ░£ņāØĒ¢łļŗż. ņō░ļ¤¼ņ¦ł ņĀĢļÅäļĪ£ ņ¢┤ņ¦Ćļ¤¼ņÜ┤ ļÆżņŚÉļŖö ļ░śļō£ņŗ£ ļāäņāłĻ░Ć Ļ│ĀņĢĮĒĢ£ ĒØæņāēļ│ĆņØ┤ ļÆżļö░ļźĖļŗżĻ│Ā Ē¢łļŗż. ļ»ĖĻĄŁ ĻĄŁņĀüņØś ļ░▒ņØĖ ļé©ņä▒ņ£╝ļĪ£ ļŗżļźĖ ļ│æļĀźņØĆ ņŚåņŚłņ£╝ļ®░, ĒĢ©Ļ╗ś ļé┤ņøÉĒĢ£ ļ¬©ņ╣£ņØ┤ ņŗżļ”¼ņĢģļ│æ(celiac disease)ņØä ņ¦äļŗ©ļ░øņĢśņ£╝ļéś ņ╣śļŻī ņŚåņØ┤ Ļ┤Ćņ░░ ņżæņØ┤ņŚłļŗż. H. pylori Ļ░ÉņŚ╝ļĀźņØ┤ļéś ņ£äņןĻ┤Ć ņóģņ¢æņØś Ļ░ĆņĪ▒ļĀźņØĆ ņŚåņŚłļŗż. ļé┤ņøÉ ļŗ╣ņŗ£ņØś ĒéżļŖö 176.2 cm, ļ¬Ėļ¼┤Ļ▓īļŖö 79.6 kgņØ┤ņŚłļŗż.
ĒśłņĢĪĻ▓Ćņé¼ņŚÉņä£ ļ░▒ĒśłĻĄ¼ 6.82├Ś103/╬╝m (ņ░ĖĻ│Āņ╣ś 4~10├Ś103/╬╝m), ņĀüĒśłĻĄ¼ 4.66├Ś106/╬╝m (ņ░ĖĻ│Āņ╣ś 4.2~6.3├Ś106/╬╝m), ĒśłņåīĒīÉ 225├Ś103/╬╝m (ņ░ĖĻ│Āņ╣ś 140~400├Ś103/╬╝m), ĒŚżļ¬©ĻĖĆļĪ£ļ╣ł 13.6 g/dL (ņ░ĖĻ│Āņ╣ś 13~16.5 g/dL), Ēśłņāēņåī 38.8% (ņ░ĖĻ│Āņ╣ś 39~49%), mean corpuscular volume 83.4 fL (ņ░ĖĻ│Āņ╣ś 80~98 fL), mean corpuscular hemoglobin (MCH) 29.2 pg (ņ░ĖĻ│Āņ╣ś 27~33 pg), MCH concentration 35.1% (ņ░ĖĻ│Āņ╣ś 32~36%)ļĪ£ ļ│┤Ļ│ĀļÉśņŚłļŗż. Ļ▒┤Ļ░ĢĒĢ£ ļ░▒ņØĖ ļé©ņä▒ņØś ņĀĢņāü Ēśłņāēņåī ņłśņ╣śĻ░Ć 14.0 g/dL ņØ┤ņāüņØ┤ļØ╝ļŖö ņĀÉņØä Ļ░ÉņĢłĒĢĀ ļĢī[13], ĒśłņāēņåīņÖĆ ĒŚżļ¬©ĻĖĆļĪ£ļ╣ł ņłśņ╣śļŖö ļé«ņĢśņ£╝ļéś ļ╣łĒśłļĪ£ ņ¦äļŗ©ļ░øĻ▒░ļéś ņ╣śļŻīļ░øņØĆ ņĀüņØĆ ņŚåļŗżĻ│Ā Ē¢łļŗż. Ēśłņ▓Ł PG I ņłśņ╣śļŖö >160 ng/mL, PG II ņłśņ╣śļŖö >50 ng/mL, Ļ░ĆņŖżĒŖĖļ”░ ņłśņ╣śļŖö 534.0 pg/mL (ņ░ĖĻ│Āņ╣ś 13~115 pg/mL), chromogranin A ņłśņ╣śļŖö >1,800 ng/mL (ņ░ĖĻ│Āņ╣ś Ōēż108.0 ng/mL)ļĪ£ ļåÆņĢśļŗż. PPI ļ│ĄņÜ® ņØ┤ņÖĖņŚÉ Ļ│ĀĻ░ĆņŖżĒŖĖļ”░Ēśłņ”ØņØä ņ£Āļ░£ĒĢĀ ļ¦īĒĢ£ ļŗżļźĖ ņøÉņØĖņØ┤ļéś ņ¦łĒÖśņØĆ ņŚåņŚłļŗż.
ņ£äļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ņŚÉņä£ ņ▓┤ļČĆņÖĆ ĻĖ░ņĀĆļČĆļŖö ņĀÉļ¦ēņØś ļ╣äĒøäņÖĆ ņ£äņäĀ Ļ░£ĻĄ¼ļČĆ(opening of gastric pit)ņØś ĒÖĢņןņØä ļ│┤ņśĆņ£╝ļéś, ņĀäņĀĢļČĆņÖĆ ņ£äĻ░üņŚÉņä£ļŖö ņØ┤ņāüņØ┤ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż(Fig. 1). ņ£äņŻ╝ļ”ä ņé¼ņØ┤ņŚÉņä£ ļ░£Ļ▓¼ļÉ£ ņÜ®ņóģņŚÉņä£ ņČ£ĒśłņØ┤ Ļ┤Ćņ░░ļÉśņ¢┤ ņÜ®ņóģ ņĀłņĀ£ņłĀņØä ņŗ£Ē¢ēĒ¢łņ£╝ļ®░, Ļ│╝ĒśĢņä▒ ņÜ®ņóģņ£╝ļĪ£ ņ¦äļŗ©ļÉśņŚłļŗż(Fig. 2A, B). ĻĖ░ņĀĆļČĆņÖĆ ņ▓┤ļČĆņŚÉņä£ ņ▒äņĘ©ĒĢ£ ņĪ░ņ¦üņŚÉņä£ļŖö ņ£äņĀĆņäĀņØś ļéŁņä▒ ĒÖĢņןĻ│╝ ņäĀņÖĆņāüĒö╝ ņ”ØņŗØņØ┤ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļ®░, ļ”╝ĒöäĻĄ¼ņÖĆ ņä¼ņ£ĀņĢäņäĖĒż ņ╣©ņ£żņ£╝ļĪ£ ņØĖĒĢ£ ņĀÉļ¦ē ļ╣äĒøäļź╝ ļ│┤ņśĆļŗż(Fig. 2C, D). H. pylori Ļ░ÉņŚ╝ņØĆ ļ╣äņ╣©ņŖĄņĀüņØĖ Ēśłņ▓Ł ĒĢŁH. pylori immunoglobulin G IgG Ļ▓Ćņé¼ņÖĆ ņ╣©ņŖĄņĀüņØĖ Giemsa ņŚ╝ņāē ļ¬©ļæÉņŚÉņä£ ņ¦äļŗ©ļÉśņ¦Ć ņĢŖņĢśņ£╝ļ®░, ņןņāüĒö╝ĒÖöņāØņØ┤ļéś ņ£äņČĢļÅä Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. ņ£äĻ░üĻ│╝ ņ▓┤ļČĆņŚÉņä£ ĻĘ£ņ╣ÖņĀüņØĖ ĒśłĻ┤ĆņāüņØ┤ Ļ┤Ćņ░░ļÉśņŚłĻ│Ā, ĒśäĻ░ÉņŚ╝ņØ┤ļéś Ļ│╝Ļ▒░ Ļ░ÉņŚ╝ņØä ņØśņŗ¼ĒĢĀ ļ¦īĒĢ£ ņåīĻ▓¼ņØ┤ ņŚåņ¢┤ņä£ ņÜöņåīĒśĖĻĖ░ Ļ▓Ćņé¼ļŖö ņŗ£Ē¢ēĒĢśņ¦Ć ņĢŖņĢśļŗż. ĒĢ©Ļ╗ś ņŗ£Ē¢ēĒĢ£ ļīĆņןļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ņŚÉņä£ļŖö ņØ┤ņāüņØ┤ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. ņ£äņÜ®ņóģ ņĀłņĀ£ņłĀ ĒøäņŚÉļŖö PPI ļīĆņŗĀ Ē׳ņŖżĒāĆļ»╝ 2 ņ░©ļŗ©ņĀ£(histamine 2 receptor antagonist, H2-blocker)ņØĖ famotidine 20 mgņØä 4ņŻ╝Ļ░ä ĒĢśļŻ© 2ĒÜī ļ│ĄņÜ®ĒĢśļÅäļĪØ ĒĢśņśĆļŗż.
ļ│ĄļČĆ ņ╗┤Ēō©Ēä░ņ┤¼ņśü(CT) Ļ▓Ćņé¼ņŚÉņä£ ņ£äņ▓┤ļČĆņÖĆ ĻĖ░ņĀĆļČĆņØś ņ£äļ▓Į ļ╣äĒøäļź╝ ļ│┤ņśĆļŗż(Fig. 3A, B). ļ│┤ļ¦ī 4ĒśĢņØś ņ¦äĒ¢ēņä▒ ņ£äņĢöņØ┤ļéś ļ”╝ĒöäņóģņØä ņŗ£ņé¼ĒĢśļŖö ļČłĻĘ£ņ╣ÖĒĢ£ ņĪ░ņśüņ”ØĻ░ĢņØ┤ļéś ņŻ╝ļ│Ć ņĪ░ņ¦ü ņ╣©ļ▓ö, ļ”╝ĒöäņĀł ļ╣äļīĆ ļō▒ņØĆ Ļ┤Ćņ░░ļÉśņ¦Ć ņĢŖņĢśļŗż. ņ£äļé┤ņŗ£Ļ▓ĮĻ│╝ CT Ļ▓Ćņé¼ ņåīĻ▓¼ņ£╝ļĪ£ ļ│╝ ļĢī, ņ┤łņØīĒīī ļé┤ņŗ£Ļ▓Į Ļ▓Ćņé¼ļź╝ ņŗ£Ē¢ēĒĢśļŹöļØ╝ļÅä ņ╣śļŻīĻ│äĒÜŹ(PPI ņżæļŗ©Ļ│╝ ņ£äņÜ®ņóģ ņĀłņĀ£ņłĀ)ņØ┤ ļ░öļĆīņ¦Ć ņĢŖņØä Ļ▓āņ£╝ļĪ£ ņśłņāüļÉśņ¢┤ ņŗ£Ē¢ēĒĢśņ¦Ć ņĢŖņĢśļŗż. PPIļź╝ ņżæļŗ©ĒĢ£ 3Ļ░£ņøö ĒøäņØś CT ņČöņĀü Ļ▓Ćņé¼ņŚÉņä£ ĻĘ╝ņ£äļČĆņØś ņ£äļ▓Į ļ╣äĒøäļŖö ĒśĖņĀäļÉ£ ņåīĻ▓¼ņØä ļ│┤ņśĆļŗż(Fig. 3C, D). ņČöņĀüĒĢ£ Ēśłņ▓Ł Ļ░ĆņŖżĒŖĖļ”░ ņłśņ╣śļŖö 517.0 pg/mL, chromogranin A ņłśņ╣śļŖö 950.4 ng/mLļĪ£ Ļ░üĻ░ü Ļ░Éņåī ņżæņØ┤ņŚłļŗż. PPI ļ│ĄņÜ®ņØä ņżæļŗ©ĒĢ£ ņØ┤ĒøäņŚÉ ĒØæņāēļ│ĆņØĆ ņŚåņŚłņ£╝ļ®░, Ēśłņāēņåī ņłśņ╣śļŖö 15.7 g/dL ņØ┤ņāüņ£╝ļĪ£ ņĢłņĀĢņĀüņ£╝ļĪ£ ņ£Āņ¦ĆļÉśņŚłļŗż. ņ”ØņāüņØ┤ ņ×¼ļ░£ĒĢśļ®┤ H2-blockerļź╝ ĻČīĒĢśļĀżĻ│Ā Ē¢łņ£╝ļéś, ņØ┤ņĀäĻ│╝ Ļ░ÖņØĆ ņŗ¼ĒĢ£ ņ”ØņāüņØĆ ņŚåļŗżĻ│Ā ĒĢśņŚ¼ ņ╣śļŻī ņŚåņØ┤ Ļ┤Ćņ░░ ņżæņØ┤ļŗż.
ņØ┤ ņ”ØļĪĆļŖö H. pyloriņŚÉ Ļ░ÉņŚ╝ļÉ£ ņĀüņØ┤ ņŚåļŖö ņĀŖņØĆ ļ»ĖĻ░ÉņŚ╝ņ×ÉĻ░Ć PPIļź╝ ņןĻĖ░Ļ░ä ļ│ĄņÜ®ĒĢ£ ĒøäņŚÉ ņäĀņÖĆņāüĒö╝ ņ”ØņŗØĻ│╝ ņ£äņĀĆņäĀņØś ļéŁņä▒ ĒÖĢņןņØ┤ Ļ│╝ļÅäĒĢśĻ▓ī ļ░£ņāØĒĢśņŚ¼ ņāüļČĆņ£äņןĻ┤Ć ņČ£ĒśłĻ╣īņ¦Ć ņ£Āļ░£ĒĢ£ ļō£ļ¼Ė Ļ▓ĮņÜ░ņØ┤ļŗż. ņ¦äļŗ© ļŗ╣ņŗ£ņŚÉļŖö ņ£ä ĻĘ╝ņ£äļČĆņØś ļ╣äĒøäņÖĆ ĒĢ©Ļ╗ś Ēśłņ▓Ł Ļ░ĆņŖżĒŖĖļ”░Ļ│╝ chromogranin A ņłśņ╣śņØś ņāüņŖ╣ņØ┤ Ļ┤Ćņ░░ļÉśņŚłņ£╝ļéś, PPI ļ│ĄņÜ®ņØä 3Ļ░£ņøöĻ░ä ņżæļŗ©ĒĢ£ ĒøäņŚÉ ņ£äļ▓ĮņØś ļ╣äĒøäņÖĆ Ēśłņ▓Ł ņłśņ╣śĻ░Ć ĒśĖņĀäļÉśļŖö ņåīĻ▓¼ņØä ļ│┤ņśĆļŗż.
ņ£äņĀĆņäĀņØś ļ▓ĮņäĖĒżļź╝ ņ¢ĄņĀ£ĒĢśļŖö ņĢĮļ¼╝ ļ│ĄņÜ®ņ£╝ļĪ£ ņØĖĒĢ£ ņ£äņĀÉļ¦ēņØś ļ│ĆĒÖöļŖö ņŻ╝ļĪ£ Ļ│ĀĻ░ĆņŖżĒŖĖļ”░Ēśłņ”ØņŚÉ ņØśĒĢ┤ ļ░£ņāØĒĢ£ļŗż(Fig. 4). ņ£äņČĢņØ┤ļéś ņןņāüĒö╝ĒÖöņāØņØ┤ ņŚåļŖö ļ»ĖĻ░ÉņŚ╝ņ×ÉņØ╝ņłśļĪØ Ēü░ ņÜ®ņóģņØ┤ ļ░£ņāØĒĢśĻĖ░ ņē¼ņÜ░ļ®░(Fig. 5), ņ£äņĢöņØĆ ļō£ļ¼╝ļŗż[14]. Ļ│╝ĒśĢņä▒ ņÜ®ņóģņØ┤ ļ░£ņāØĒĢ£ Ļ▓ĮņÜ░ņŚÉļÅä ņśłĒøäļŖö ņ¢æĒśĖĒĢśņŚ¼ PPIļź╝ ņżæļŗ©ĒĢśļŖö Ļ▓āļ¦īņ£╝ļĪ£ļÅä 83%Ļ░Ć ņ×æņĢäņ¦ĆĻ▒░ļéś ņé¼ļØ╝ņ¦äļŗż[15]. ĻĘĖļ¤¼ļéś H. pylori Ļ░ÉņŚ╝ņ×ÉļØ╝ļ®┤ ņäĀņĢöņ£╝ļĪ£ ņ¦äĒ¢ēĒĢĀ ņłś ņ׳ņ£╝ļ»ĆļĪ£, PPI ņżæļŗ©Ļ│╝ ĒĢ©Ļ╗ś ņĀ£ĻĘĀ ņ╣śļŻīļź╝ ĒĢ┤ņĢ╝ ĒĢ£ļŗż[16]. Ē¢źĒøäņŚÉļÅä PPIļéś potassium-competitive acid blocker (P-CAB) ļ│ĄņÜ®ņØä Ēö╝ĒĢ┤ņĢ╝ ĒĢśļŖöļŹ░, P-CABļŖö PPIļ│┤ļŗż ņ£äņé░ ņ¢ĄņĀ£ ĒÜ©Ļ│╝Ļ░Ć ĒāüņøöĒĢ£ ļ¦īĒü╝ Ļ│ĀĻ░ĆņŖżĒŖĖļ”░Ēśłņ”ØņØś ļ░£ņāØļźĀļÅä ļåÆĻĖ░ ļĢīļ¼ĖņØ┤ļŗż[17]. P-CABļź╝ 1ļģä ņØ┤ņāü ļ│ĄņÜ®ĒĢśļ®┤ 8.8%ņŚÉņä£ ņ£äņĀĆņäĀ ņÜ®ņóģņØ┤ ļ░£ņāØĒĢśĻ│Ā 1.3%ņŚÉņä£ Ļ│╝ĒśĢņä▒ ņÜ®ņóģņØ┤ ļ░£ņāØĒĢ£ļŗżļŖö ļé┤ņÜ®ņØś ņ┤łļĪØņØ┤ 2018ļģä ņØ╝ļ│ĖņåīĒÖöĻĖ░ļé┤ņŗ£Ļ▓ĮĒĢÖĒÜīņŚÉņä£ ļ░£Ēæ£ļÉśņŚłņ£╝ļ®░(unpublished data), 3ļģäĻ░ä vonoprazan 10 mgņØä ļ│ĄņÜ®ĒĢ£ 51ņäĖ ļé©ņä▒ņŚÉņä£ ņäĀņÖĆĒśĢ ņ£äņäĀņĢö(foveolartype gastric adenocarcinoma)ņØ┤ ļ░£ņāØĒ¢łļŗżļŖö ņ”ØļĪĆļ│┤Ļ│ĀļÅä ņ׳ļŗż[18]. ļö░ļØ╝ņä£ ļ│ĄņÜ®ņØ┤ ļČłĻ░ĆĒö╝ĒĢ£ ņāüĒÖ®ņŚÉņä£ļŖö Ļ│ĀĻ░ĆņŖżĒŖĖļ”░Ēśłņ”ØņØä ņżäņØ┤ĻĖ░ ņ£äĒĢ┤ muscarinic receptor antagonistņØĖ pirenzepineņØä ļ│æņÜ®ĒĢśĻ▒░ļéś[19], H2-blockerņØä ĒĢ©Ļ╗ś Ēł¼ņŚ¼ĒĢ┤ ņÜ®ļ¤ēņØä ņżäņØ┤ļÅäļĪØ ĒĢ£ļŗż[20]. H2-blockerļŖö PPIļéś P-CABņÖĆ ļŗ¼ļ”¼ Ļ│ĀĻ░ĆņŖżĒŖĖļ”░Ēśłņ”ØņØ┤ļéś PG ņāüņŖ╣ ļ░Å ņ£äņĀĆņäĀ ņ”ØņŗØņØä ņ£Āļ░£ĒĢśņ¦Ć ņĢŖĻĖ░ ļĢīļ¼ĖņØ┤ļŗż[21]. ņĀ£ĻĘĀ ņ╣śļŻī ņŗ£ņŚÉļŖö PPIļź╝ 1~2ņŻ╝ļ¦ī Ēł¼ņŚ¼ĒĢśĻĖ░ ļĢīļ¼ĖņŚÉ ņØ┤ņĪ░ņ░© ĻĖłĻĖ░ĒĢ┤ņĢ╝ ĒĢ£ļŗżļŖö ņŚ░ĻĄ¼ļŖö ņŚåļŗż. ļŗżļ¦ī ņןĻĖ░Ļ░ä PPIļź╝ Ēł¼ņŚ¼ĒĢ┤ņś© Ļ░ÉņŚ╝ņ×ÉņØś ņ£ä ļé┤ pHļŖö ņØ┤ļ»Ė ņāüņŖ╣ļÉśņ¢┤ ļČłņČ®ļČäĒĢ£ ņ£äņé░ ņ¢ĄņĀ£ļĪ£ ņØĖĒĢ£ ņĀ£ĻĘĀ ņŗżĒī©ņØś Ļ░ĆļŖźņä▒ņØĆ ļé«ņØä Ļ▓āņØ┤ļ»ĆļĪ£ PPI ļīĆņŗĀ H2-blockerļź╝ Ļ│ĀļĀżĒĢ┤ļ│╝ ņłś ņ׳ņØä Ļ▓āņØ┤ļŗż.
Ļ│ĀĻ░ĆņŖżĒŖĖļ”░Ēśłņ”ØņØĆ PPIļéś P-CAB ļ│ĄņÜ® ņØ┤ņÖĖņŚÉļÅä ņŗØĒøä, ņŗĀļČĆņĀä, ņ×ÉĻ░Ćļ®┤ņŚŁņä▒ ņ£äņŚ╝, H. pylori Ļ░ÉņŚ╝ņŚÉ ņØśĒĢ£ ņ£äņČĢņä▒ ņ£äņŚ╝, Zollinger-ellison ņ”ØĒøäĻĄ░ņŚÉņä£ļÅä Ļ┤Ćņ░░ļÉśļŖö ņåīĻ▓¼ņ£╝ļĪ£, PPIļź╝ 5ļģäĻ░ä ļ│ĄņÜ®ĒĢśļ®┤ ņĀĢņāü ņłśņ╣śņØś 1.4ļ░░ņØĖ 200 pg/mL ņĀäĒøäļĪ£ ņāüņŖ╣ļÉśĻ│Ā ļ│ĄņÜ® ĻĖ░Ļ░äņØ┤ ĻĖĖņłśļĪØ ņłśņ╣śļÅä ņ”ØĻ░ĆĒĢ£ļŗż[22]. ļ¦īņĢĮ Ēśłņ▓Ł Ļ░ĆņŖżĒŖĖļ”░ ņłśņ╣śĻ░Ć 1,000 pg/mLļź╝ ņ┤łĻ│╝ĒĢśĻ│Ā ņ£ä ļé┤ pHĻ░Ć 2 ļ»Ėļ¦īņØ┤ļØ╝ļ®┤ Ļ░ĆņŖżĒŖĖļ”░ņóģņØä ņØśņŗ¼ĒĢ┤ņĢ╝ ĒĢ£ļŗż[23]. ļśÉĒĢ£ PPI ņןĻĖ░ ļ│ĄņÜ®ņ×ÉņŚÉņä£ Ļ░ĆņŖżĒŖĖļ”░ ņłśņ╣śĻ░Ć ļåÆļŗżļ®┤ ņ£ä ņŗĀĻ▓Įļé┤ļČäļ╣ä ņóģņ¢æņØä ņØśņŗ¼ĒĢ┤ņĢ╝ ĒĢ£ļŗż[24]. ņ£Āļ¤ĮņØś ļŗżĻĖ░Ļ┤Ć ņŚ░ĻĄ¼ņŚÉņä£ ļ░£Ēæ£ĒĢ£ ņ£ä ņŗĀĻ▓Įļé┤ļČäļ╣ä ņóģņ¢æ ĒÖśņ×ÉļōżņØś Ēśłņ▓Ł Ļ░ĆņŖżĒŖĖļ”░ ņłśņ╣śļŖö 964 (585~1,702) pg/mLņśĆņ£╝ļ®░[25], ņØ╝ļ│ĖņØś ļŗżĻĖ░Ļ┤Ć ņŚ░ĻĄ¼ņŚÉņä£ļŖö 2,305 (279~22,956) pg/mLņśĆļŗż[26]. ļö░ļØ╝ņä£ ņØ╝ļ│ĖņŚÉņä£ļŖö PPIļéś P-CAB ņןĻĖ░ ļ│ĄņÜ®ņ×ÉņŚÉņä£ Ēśłņ▓Ł Ļ░ĆņŖżĒŖĖļ”░ ņłśņ╣śĻ░Ć 700 ng/mL ņØ┤ņāüņ£╝ļĪ£ ļåÆĻ▓ī ļéśņśżļ®┤ ņŗĀĻ▓Įļé┤ļČäļ╣ä ņóģņ¢æņŚÉ ļīĆĒĢ┤ Ļ▓Ćņé¼ĒĢśļŖö ļČäņ£äĻĖ░Ļ░Ć ņĪ░ņä▒ļÉśņ¢┤ ņ׳ņ£╝ļéś, ņ”ØļĪĆĻ░Ć ļō£ļ¼╝ņ¢┤ņä£ ņĢäņ¦ü ņĀäņäĖĻ│äņĀüņ£╝ļĪ£ cutoff valueņŚÉ ļīĆĒĢ£ ņŚ░ĻĄ¼ļŖö ņŚåļŗż. ĒĢ£ĒÄĖ, Ēśłņ▓Ł chromogranin A ņłśņ╣śļŖö 1ĒśĢ ļŗ╣ļć©ļéś ņ×ÉĻ░Ćļ®┤ņŚŁņä▒ ņ¦łĒÖśņŚÉņä£ļÅä ņāüņŖ╣ļÉśļ»ĆļĪ£ Ēśłņ▓Ł Ļ░ĆņŖżĒŖĖļ”░ņŚÉ ļ╣äĒĢ┤ ņóģņ¢æņŚÉ ļīĆĒĢ£ ņ¦äļŗ©ņĀü Ļ░Ćņ╣śĻ░Ć ļé«ņĢäņä£ ņ╣śļŻī ĒÜ©Ļ│╝ ĒīÉņĀĢņØ┤ļéś ņ×¼ļ░£ ņśłņĖĪņÜ®ņ£╝ļĪ£ļ¦ī ņé¼ņÜ®ĒĢ£ļŗż[27].
ņØ┤ ĒÖśņ×ÉņØś Ļ▓ĮņÜ░, ĒØæņāēļ│ĆņØ┤ ļéśĒāĆļéśĻĖ░ 18Ļ░£ņøö ņĀäļČĆĒä░ PPIļź╝ ļ│ĄņÜ®Ē¢łņ£╝ļ®░(temporal relationship), PPI ņØ┤ņÖĖņŚÉ ļŗżļźĖ ņøÉņØĖņØä ņ░ŠņØä ņłś ņŚåņŚłļŗż(coherence). ļśÉĒĢ£, PPI ļ│ĄņÜ® ĒøäņŚÉ Ļ┤Ćņ░░ļÉ£ Ļ▓Ćņé¼ ņåīĻ▓¼ļōżņØ┤ ĻĖ░ņĪ┤ ļ│┤Ļ│ĀļōżĻ│╝ ņØ╝ņ╣śĒ¢łņ£╝ļ®░(consistency), ĒŖ╣ņØ┤ĒĢ£ ņåīĻ▓¼ļōż(specificity)ņØ┤ņŚłļŗż[1-3,5-8,12]. ļŗżļ¦ī, ņØ┤ ĒÖśņ×ÉĻ░Ć ņČ£ĒśłļĪ£ ņØĖĒĢ£ ņ”ØņāüņØä ļŖÉļéĆ Ļ▓āņØĆ ņ┤Ø 4~5ĒÜīļĪ£ ņłśĒśłņØä ņÜöĒĢĀ ņĀĢļÅäļĪ£ ļ¦ÄņØĆ ņ¢æņØĆ ņĢäļŗłņŚłĻĖ░ņŚÉ ĒŚżļ¬©ĻĖĆļĪ£ļ╣ł ņłśņ╣śļŖö 13.6 g/dL, Ēśłņāēņåī ņłśņ╣śļŖö 38.8%ļĪ£ Ļ▓Įļ»ĖĒĢ£ Ļ░Éņåīļ¦ī ļ│┤ņØĖ Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉ£ļŗż. ņĢäņÜĖļ¤¼ Ļ│ĀĻ░ĆņŖżĒŖĖļ”░Ēśłņ”ØņØ┤ ņŗ¼ĒĢĀņłśļĪØ ņ£äņĀĆņäĀ ņÜ®ņóģļ│┤ļŗż Ļ│╝ĒśĢņä▒ ņÜ®ņóģņØ┤ ļ░£ņāØĒĢśĻĖ░ ņē¼ņÜ┤ļŹ░[28], ņØ┤ ĒÖśņ×ÉņŚÉņä£ļÅä Ēśłņ▓Ł Ļ░ĆņŖżĒŖĖļ”░ ņłśņ╣śĻ░Ć ļåÆĻ▓ī ņĖĪņĀĢļÉśņ¢┤ Ļ│╝ĒśĢņä▒ ņÜ®ņóģĻ│╝ņØś ņŚ░Ļ┤Ćņä▒ņØä ņ░ŠņØä ņłś ņ׳ņŚłļŗż(strength). ļéśņĢäĻ░Ćņä£ PPIļź╝ ņżæļŗ©ĒĢ£ ņØ┤ĒøäņŚÉ ņ£äļ▓ĮņØś ļ╣äĒøäĻ░Ć 3Ļ░£ņøö ļ¦īņŚÉ ĒśĖņĀäļÉśņŚłĻ│Ā, Ēśłņ▓Ł Ļ░ĆņŖżĒŖĖļ”░Ļ│╝ chromogranin A ņłśņ╣śļÅä Ļ░ÉņåīĒĢśļŖö ņŚ░Ļ┤Ćņä▒ļÅä Ļ┤Ćņ░░ļÉśņŚłļŗż. ņØ┤ ņ”ØļĪĆņŚÉņä£ chromogranin A ņłśņ╣śĻ░Ć ņĄ£Ļ│Āņ╣śņØĖ >1,800 ng/mLņŚÉņä£ 950.4 ng/mLļĪ£ ļ╣Āļź┤Ļ▓ī Ļ░ÉņåīĒĢśļ®┤ņä£ ņ”ØņāüļÅä ĒśĖņĀäļÉ£ Ļ▓āņ£╝ļĪ£ ļ│╝ ļĢī, ĒÖśņ×ÉĻ░Ć ņ▓śņØīņŚÉļŖö ņ£äņé░Ļ│╝ļŗżļĪ£ ņØĖĒĢ┤ PPIļź╝ ļ│ĄņÜ®ĒĢśĻĖ░ ņŗ£ņ×æĒ¢łņ¦Ćļ¦ī ņØ┤ĒøäņŚÉļŖö PPI ļČĆņ×æņÜ®ņ£╝ļĪ£ ņØĖĒĢ┤ ņ£ä ĻĘ╝ņ£äļČĆĻ░Ć ĒīĮņ░ĮĒĢśļ®┤ņä£ ņ”ØņāüņØ┤ ļ░£ņāØĒĢ£ Ļ▓āņ£╝ļĪ£ ņČöņĀĢļÉ£ļŗż. ņ£ä 5Ļ░Ćņ¦Ć ĒŖ╣ņä▒ļōż(temporal relationship, coherence, consistency, specificity, strength)ņØä ņóģĒĢ®ĒĢĀ ļĢī, ņØ┤ ņ”ØļĪĆļŖö ņןĻĖ░Ļ░ä PPI ļ│ĄņÜ®ņ£╝ļĪ£ ņØĖĒĢ£ ņĢĮņĀ£ņä▒ ļ│æļ│Ćņ£╝ļĪ£ ĒĢ┤ņäØļÉ£ļŗż.
Ļ▓░ļĪĀņĀüņ£╝ļĪ£ ņØ┤ ņ”ØļĪĆļŖö ņĀŖņØĆ ļéśņØ┤ņØś ļ»ĖĻ░ÉņŚ╝ņ×ÉĻ░Ć 18Ļ░£ņøöĻ░ä PPIļź╝ ļ│ĄņÜ®ĒĢśļ®┤ņä£ ĻĖ░ņĀĆļČĆņÖĆ ņ▓┤ļČĆņØś ņ£äņĀÉļ¦ēņØ┤ Ļ│╝ļÅäĒĢśĻ▓ī ņ”ØņŗØĒ¢łĻ│Ā, ļÅÖļ░śļÉ£ Ļ│╝ĒśĢņä▒ ņÜ®ņóģņØ┤ ņČ£ĒśłļÉ£ Ļ▓ĮņÜ░ņØ┤ļŗż. ņČ£Ēśłņä▒ ņÜ®ņóģņŚÉ ļīĆĒĢ£ ļé┤ņŗ£Ļ▓Į ņĀłņĀ£ņłĀĻ│╝ PPIļ│ĄņÜ® ņżæļŗ© ņØ┤ĒøäņŚÉ ĒØæņāēļ│ĆņØĆ ņé¼ļØ╝ņĪīņ£╝ļ®░, CTņŚÉņä£ļŖö ņ£äļ▓ĮņØś ļČĆņóģņØ┤ ĒśĖņĀäļÉśņŚłĻ│Ā Ēśłņ▓Ł Ļ░ĆņŖżĒŖĖļ”░Ļ│╝ chromogranin Aņłśņ╣śļŖö Ļ░ÉņåīĒ¢łļŗż. ņ£äņČĢņØ┤ļéś ņןņāüĒö╝ĒÖöņāØņØ┤ ņŚåļŖö ļ»ĖĻ░ÉņŚ╝ņ×ÉĻ░Ć ņןĻĖ░Ļ░ä PPIļź╝ ļ│ĄņÜ®ĒĢ£ ņØ┤ĒøäņŚÉ ņ£äņןĻ┤Ć ņČ£ĒśłņØ┤ ļ░£ņāØĒĢĀ ņłś ņ׳ļŗżļŖö Ļ▓āņØä ņāüĻĖ░ņŗ£ņ╝£ņżĆ ņ”ØļĪĆņśĆļŗż. Ļ░łņłśļĪØ ĻĄŁļé┤ņŚÉņä£ļÅä ļ»ĖĻ░ÉņŚ╝ņ×ÉņØś ļ╣äņ£©ņØ┤ ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳Ļ│Ā, PPIļéś P-CABļź╝ ņןĻĖ░ ļ│ĄņÜ®ĒĢśļŖö ņé¼ļ×īļōżļÅä ņ”ØĻ░ĆĒĢśĻ│Ā ņ׳ņ£╝ļ»ĆļĪ£ ĒŖ╣ņ¦ĢņĀüņØĖ Ļ▓Ćņé¼ ņåīĻ▓¼ļōżņØä ņóģĒĢ®ĒĢ┤ņä£ ļ│┤Ļ│ĀĒĢśņśĆļŗż.
Fig.┬Ā1.
Initial gastroscopic findings. (A) Edematous mucosal change and wide opening of gastric pits are observed in the corpus. (B) On the greater curvature side of the upper body, a 1 cm-sized, semi-pedunticular polyp is observed. Minimal amount of fresh blood is observed on the polyp. (C) A regular arrangement of collecting venules (RAC) is observed on the surface of the gastric folds with edematous mucosal changes. (D) In the antrum and angle, RAC is observed without swelling.
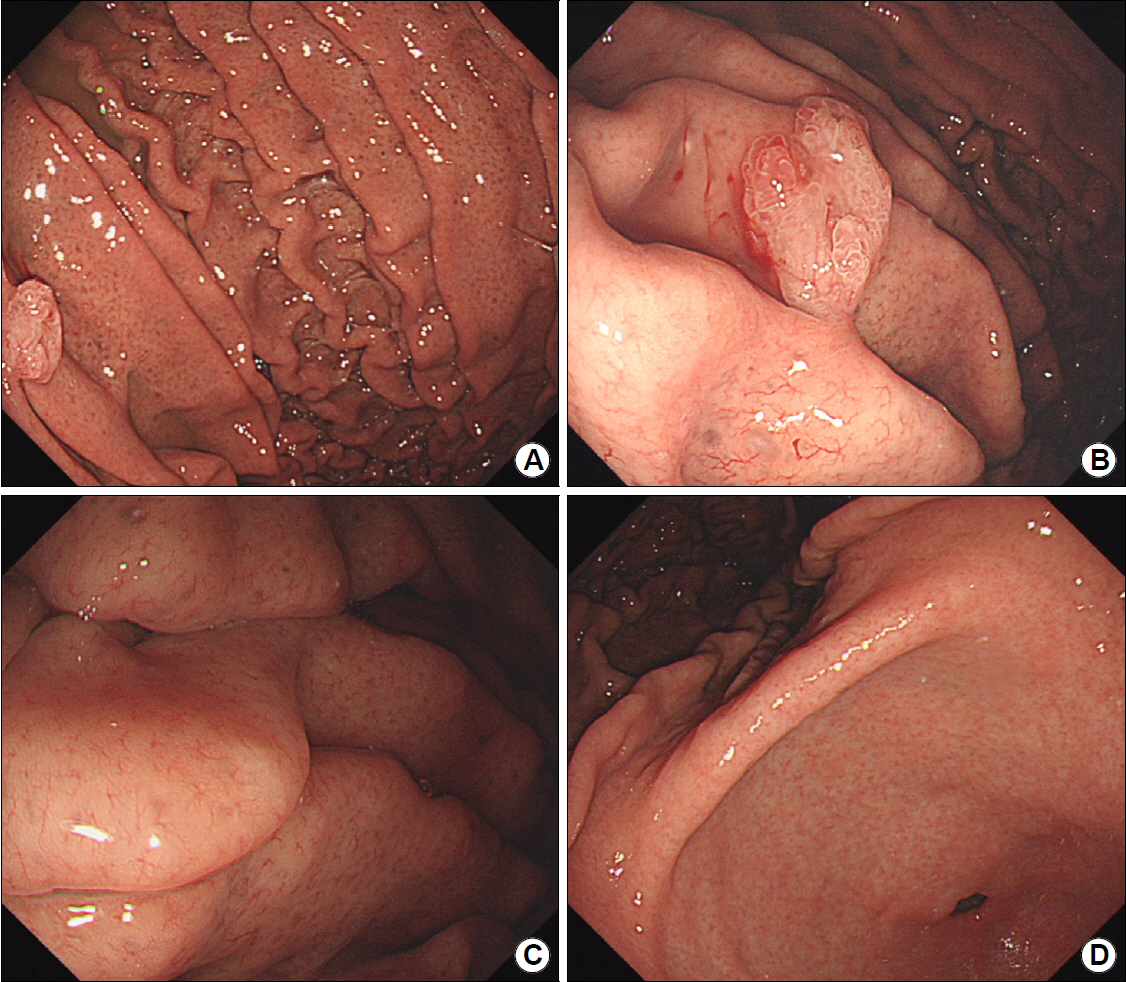
Fig.┬Ā2.
Microscopic findings after gastric polypectomy and endoscopic biopsy. (A) Cross-sectional view shows the serrated and star-like appearance of the mucosal pits (H&E stain, ├Ś40). These findings are consistent with those of a hyperplastic polyp. (B) The resected polyp showing the elongated and dilated foveolar epithelium with red blood cell aggregation (arrow) (H&E stain, ├Ś100). (C) The biopsied specimen of the fundus showing the inflammatory reaction of the stroma with an elongated and dilated foveolar epithelium. The lamina propria is infiltrated by lymphocytes and fibroblasts (H&E stain, ├Ś100). (D) The biopsied specimen of the gastric rugae showing the inflammatory reaction of the stroma without intestinal metaplasia or atrophy. Edematous stroma is visible with hyperplastic foveolar epithelium (H&E stain, ├Ś200).

Fig.┬Ā3.
Findings of abdominal contrastenhanced CT. (A) Axial view of the stomach showing gastric corpus hypertrophy (yellow arrow) from the initial visit. (B) Coronal view showing gastric wall thickening (yellow arrow) only in the corpus. No wall thickening is observed in the antrum. (C) Axial view at three months after the discontinuation of the proton pump inhibitor (PPI) treatment shows improvement of the hypertrophic gastric corpus. (D) Coronal view at three months after the discontinuation of PPI treatment shows a remarkable improvement in the gastric corpus.
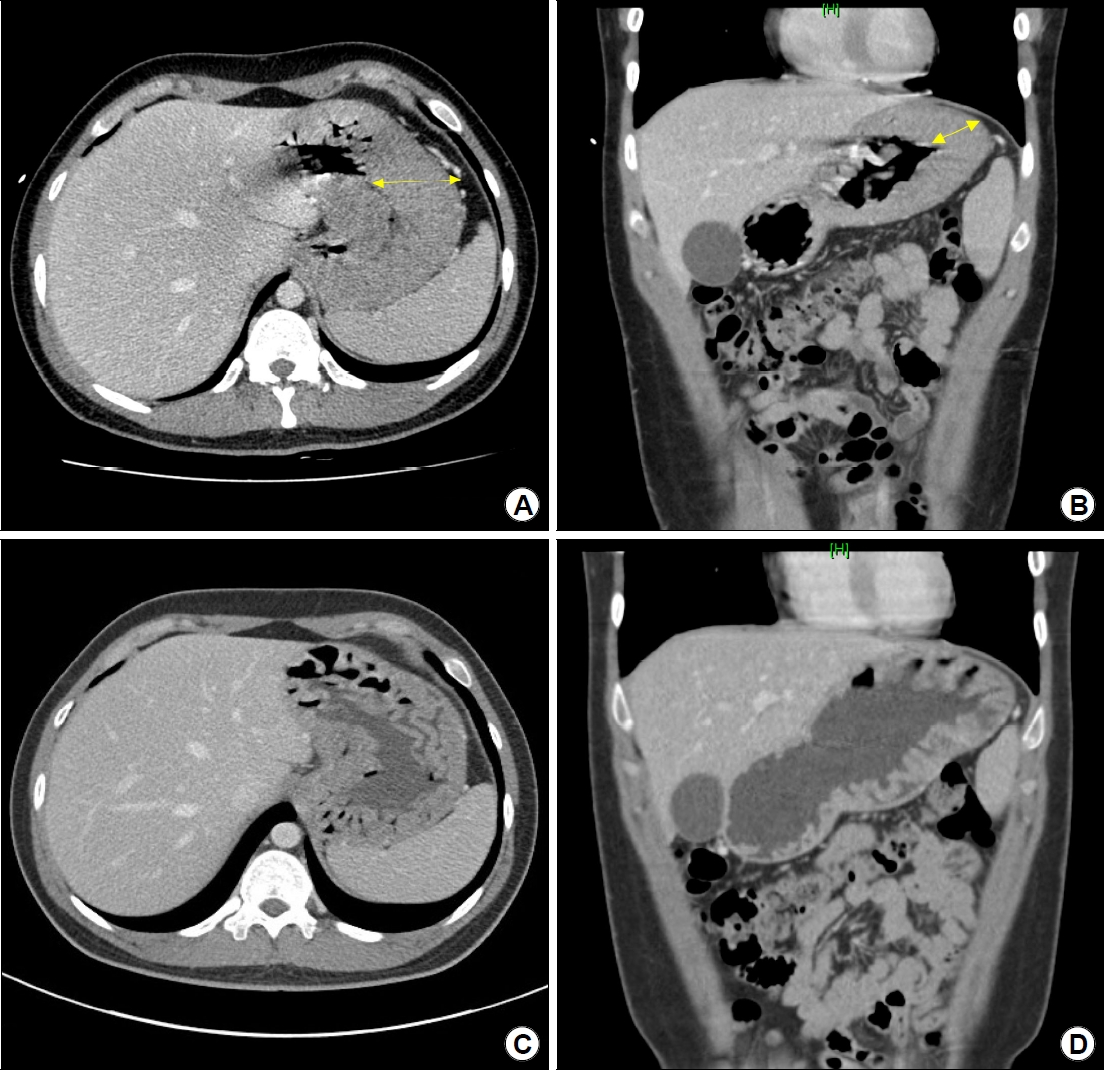
Fig.┬Ā4.
Changes induced by long-term use of acid suppressants acting on the parietal cells long-term inhibition of proton pumps in the parietal cells leads to hyperplasia of gastrin (G) cells, enterochromaffin-like (ECL) cells, and chief cells in the fundic gland. These changes induce the hypersecretion of gastrin from the G cells; chromogranin A and histamine from the ECL cells; and pepsinogen I from the chief cells. Hypergastrinemia induces foveolar epithelial hyperplasia, edematous stroma, fundic gland extension, and proliferation of parietal and chief cells in the corpus. On endoscopy, corpus mucosal hyperplasia is visible as multiple white elevated lesions, a cobblestone-like mucosa, fundic gland polyps, or a hyperplastic polyp. HCO3-, bicarbonate; M3, muscarinic acetylcholine type 3 receptor; H2, histamine type 2 receptor; ATPase, adenosine triphosphatase; CCK2, cholecystokinin type 2 receptor.

Fig.┬Ā5.
Representative cases of gastric mucosal lesions found in Koreans after long-term use of proton pump inhibitor. (A) A 38-year-old, H. pylori-naive woman presented with a large semi-pedunculated polyp in the cardia. A 3.5├Ś2.0├Ś1.6 cm hyperplastic polyp was diagnosed after gastric polypectomy. She was taking pantoprazole (40 mg) with prednisolone once a day since kidney transplantation in 2013. She had no history of H. pylori infection, and all previous H. pylori tests performed in 2013, 2020, and 2021 showed negative findings. (B) There is no notable finding in the antrum in this 38-year-old H. pylori-naive subject. (C) Cobblestone appearance is observed in the retroflexed view of the corpus in a 72-year-old man with a history of successful H. pylori eradication in 2010. He was taking 20 mg of rabeprazole every day for 7 years because of recurrent reflux symptoms. The serum anti-H. pylori IgG titer was 6.3 AU/mL (seronegative) and Giemsa staining findings were negative. The serum pepsinogen (PG) I level was >160 ng/mL, PG II level was 20.6 ng/mL, and PG I/II ratio was 11.3. (D) Metaplastic gastritis is observed in the antrum without a cobblestone appearance in a 72-year-old man with a history of infection. (E) Multiple white elevated lesions are observed in the fundus of a 57-year-old woman. She was taking 60 mg of dexlansoprazole daily for 2 years. She had undergone H. pylori eradication in 2005. On the day of endoscopy, serum anti-H. pylori IgG titer level was <5 AU/mL. The serum PG I level was 116.0 ng/mL, PG II level was 15.0 ng/mL, and PG I/II ratio was 7.7. Biopsied specimens taken from white elevated lesions near the cardia (yellow arrow) are consistent with fundic gland polyps. (F) An atrophic border is observed in the greater curvature side of the proximal antrum in a 57-year-old woman with a past infection. There are no white elevated lesions in the antrum. H. pylori, Helicobacter pylori.

REFERENCES
1. Malfertheiner P, Kandulski A, Venerito M. Proton-pump inhibitors: understanding the complications and risks. Nat Rev Gastroenterol Hepatol 2017;14:697ŌĆō710.



2. Lundell L, Vieth M, Gibson F, Nagy P, Kahrilas PJ. Systematic review: the effects of long-term proton pump inhibitor use on serum gastrin levels and gastric histology. Aliment Pharmacol Ther 2015;42:649ŌĆō663.


3. Zelter A, Fern├Īndez JL, Bilder C, et al. Fundic gland polyps and association with proton pump inhibitor intake: a prospective study in 1,780 endoscopies. Dig Dis Sci 2011;56:1743ŌĆō1748.



5. Choudhry U, Boyce HW Jr, Coppola D. Proton pump inhibitor-associated gastric polyps: a retrospective analysis of their frequency, and endoscopic, histologic, and ultrastructural characteristics. Am J Clin Pathol 1998;110:615ŌĆō621.



6. Hongo M, Fujimoto K.; Gastric Polyps Study Group. Incidence and risk factor of fundic gland polyp and hyperplastic polyp in long-term proton pump inhibitor therapy: a prospective study in Japan. J Gastroenterol 2010;45:618ŌĆō624.



7. Martin FC, Chenevix-Trench G, Yeomans ND. Systematic review with meta-analysis: fundic gland polyps and proton pump inhibitors. Aliment Pharmacol Ther 2016;44:915ŌĆō925.


8. Fukuda M, Ishigaki H, Sugimoto M, et al. Histological analysis of fundic gland polyps secondary to PPI therapy. Histopathology 2019;75:537ŌĆō545.


9. Takeda T, Asaoka D, Tajima Y, et al. Hemorrhagic polyps formed like fundic gland polyps during long-term proton pump inhibitor administration. Clin J Gastroenterol 2017;10:478ŌĆō484.




10. Hasegawa R, Yao K, Ihara S, et al. Magnified endoscopic findings of multiple white flat lesions: a new subtype of gastric hyperplastic polyps in the stomach. Clin Endosc 2018;51:558ŌĆō562.




11. Kiso M, Ito M, Boda T, et al. Endoscopic findings of the gastric mucosa during long-term use of proton pump inhibitor - a multicenter study. Scand J Gastroenterol 2017;52:828ŌĆō832.


12. Takahari K, Haruma K, Ohtani H, et al. Proton pump inhibitor induction of gastric cobblestone-like lesions in the stomach. Intern Med 2017;56:2699ŌĆō2703.



13. Fairbanks VF, Tefferi A. Normal ranges for packed cell volume and hemoglobin concentration in adults: relevance to 'apparent polycythemia'. Eur J Haematol 2000;65:285ŌĆō296.


14. Graham DY, Genta RM. Long-term proton pump inhibitor use and gastrointestinal cancer. Curr Gastroenterol Rep 2008;10:543ŌĆō547.




15. Nikaido M, Miyamoto S, Utsumi T, et al. Gastric hyperplastic polyps can shrink after discontinuation of proton pump inhibitors: a case series compared with continuation of proton pump inhibitors. J Clin Gastroenterol 2022;56:e216ŌĆōe221.


16. Anjiki H, Mukaisho KI, Kadomoto Y, et al. Adenocarcinoma arising in multiple hyperplastic polyps in a patient with Helicobacter pylori infection and hypergastrinemia during longterm proton pump inhibitor therapy. Clin J Gastroenterol 2017;10:128ŌĆō136.



17. Kojima Y, Takeuchi T, Sanomura M, et al. Does the novel potassium-competitive acid blocker Vonoprazan cause more hypergastrinemia than conventional proton pump inhibitors? A multicenter prospective cross-sectional study. Digestion 2018;97:70ŌĆō75.


18. Saito M, Koike T, Abe Y, et al. The development of foveolar-type gastric adenocarcinoma during maintenance therapy of vonoprazan for reflux esophagitis. Intern Med 2021;60:391ŌĆō396.


19. Suzuki T, Higuchi T, Kagami T, et al. Effects of pirenzepine on vonoprazan-induced gastric acid inhibition and hypergastrinemia. Eur J Clin Pharmacol 2021;77:971ŌĆō978.



20. Suzuki T, Kagami T, Uotani T, et al. Comparison of effect of an increased dosage of vonoprazan versus vonoprazan plus lafutidine on gastric acid inhibition and serum gastrin. Eur J Clin Pharmacol 2018;74:45ŌĆō52.



21. Agr├®us L, Storskrubb T, Aro P, Ronkainen J, Talley NJ, Sipponen P. Clinical use of proton-pump inhibitors but not H2-blockers or antacid/alginates raises the serum levels of amidated gastrin-17, pepsinogen I and pepsinogen II in a random adult population. Scand J Gastroenterol 2009;44:564ŌĆō570.


22. Brunner G, Athmann C, Schneider A. Long-term, open-label trial: safety and efficacy of continuous maintenance treatment with pantoprazole for up to 15 years in severe acid-peptic disease. Aliment Pharmacol Ther 2012;36:37ŌĆō47.


23. Rossi RE, Elvevi A, Citterio D, et al. Gastrinoma and zollinger ellison syndrome: a roadmap for the management between new and old therapies. World J Gastroenterol 2021;27:5890ŌĆō5907.



24. Rais R, Trikalinos NA, Liu J, Chatterjee D. Enterochromaffin-like cell hyperplasia-associated gastric neuroendocrine tumors may arise in the setting of proton pump inhibitor use: The need for a new clinicopathologic category. Arch Pathol Lab Med 2022;146:366ŌĆō371.



25. Campana D, Ravizza D, Ferolla P, et al. Clinical management of patients with gastric neuroendocrine neoplasms associated with chronic atrophic gastritis: a retrospective, multicentre study. Endocrine 2016;51:131ŌĆō139.



26. Sato Y, Imamura H, Kaizaki Y, et al. Management and clinical outcomes of type I gastric carcinoid patients: retrospective, multicenter study in Japan. Dig Endosc 2014;26:377ŌĆō384.


-
METRICS

-
- 1 Crossref
- 3,486 View
- 85 Download
- Related articles in Korean J Helicobacter Up Gastrointest Res






