 |
 |
- Search
| Korean J Helicobacter Up Gastrointest Res > Volume 19(4); 2019 > Article |
|
Abstract
Helicobacter pylori (H. pylori) infection can cause gastric dysplasia and cancer via chronic inflammatory changes in the gastric mucosa that may lead to gastric atrophy and intestinal metaplasia. Many epidemiologic studies have demonstrated the prophylactic effects of H. pylori eradication on gastric cancer, and H. pylori eradication after endoscopic resection of early gastric cancer may prevent the occurrence of metachronous gastric cancer or dysplasia. Despite insufficient data on the effect of H. pylori eradication on gastric dysplasia and cancer before endoscopic resection, some studies have shown that H. pylori eradication can induce the regression or slow the progression of some gastric dysplasia. Therefore, eradication therapy before endoscopic resection may be effective in selected cases of low-grade dysplasia. However, endoscopic resection should be considered as the first-line treatment in high-grade dysplasia or early gastric cancer owing to the potential morphologic changes to some dysplasia or cancer that can be incurred by the eradication process, which may make it difficult to perform a subsequent endoscopic procedure.
헬리코박터 파일로리(Helicobacter pylori)는 위암 발생의 가장 중요한 위험인자이며, 그 외에도 만성 위염 및 소화성 궤양 등의 발생과도 밀접한 연관이 있는 그람 음성 나선형 균으로, 전 세계인의 절반 정도가 감염되어 있다[1]. 세계보건기구(World Health Oranization) 산하의 국제암연구소(International Agency for Research on Cancer)에서는 1994년 이러한 헬리코박터 파일로리를 1급 발암 물질로 규정하고 발표하였다[2]. 최근에 시행한 대한상부위장관·헬리코박터학회의 전국 조사 결과에 따르면 국내 헬리코박터 파일로리의 유병률은 51.0%로, 특히 40세 이상에서는 50% 이상의 유병률을 보였다[3].
헬리코박터 파일로리 감염이 위암을 일으키는 기전은 Correa 가설에 의하여 다음의 과정으로 설명이 되고 있다. 헬리코박터 파일로리 감염 후 위점막에 염증 반응이 일어나 만성 위축성 위염이 발생하고, 이후 장상피화생, 이형성증 그리고 위선암을 일으키는 순차적인 과정이 진행된다[4]. 지금까지의 여러 연구들에서 헬리코박터 파일로리를 제거하는 것이 위암 예방에 효과적임이 증명되고 있고, 여러 가이드라인들에서는 위암 예방을 위하여 헬리코박터 파일로리를 제거하는 것을 권유하고 있다[5-8].
조기 위암 환자에서 내시경 절제 후에 헬리코박터 파일로리 제균 치료가 이시성 위암을 예방하는지에 관한 연구들을 메타 분석한 결과에서 제균 치료를 하는 경우에 이시성 위암의 발생 위험이 유의하게 감소하는 것이 보고되었고[9], 실제 임상에서도 조기 위암이나 위선종으로 내시경 절제술 시행 후 헬리코박터 파일로리 감염이 있는 경우 많은 병원에서 제균 치료를 시행하고 있다. 그렇다면 조기 위암이나 위선종에서 내시경을 시행하기 전 헬리코박터 파일로리 제균 치료를 시행하는 것은 어떠한 영향이 있을까? 이에 대해서는 아직까지 많은 연구가 진행되어 있지 않고, 효과에 대한 의견이 분분하다. 본 원고에서는 조기 위암이나 위선종이 진단된 환자들에서 헬리코박터 파일로리 감염이 확인된 경우, 내시경 절제술 등의 치료 전 헬리코박터 파일로리 제균 치료를 시행한 경우, 임상적으로 경험할 수 있는 득과 실에 대하여 이전에 보고된 연구들을 바탕으로 알아보고자 한다.
헬리코박터 파일로리가 위점막에서 위암을 일으키는 기전은 세균 독성인자, 숙주인자, 환경인자 등이 복합적으로 작용을 하는 것으로 알려져 있다[10]. 헬리코박터 파일로리의 감염 시 방출되는 다양한 독성인자들은 숙주세포 내의 신호 기전을 방해하고 종양으로의 형질 전환에 대한 역치를 낮추게 된다. 이 중에서 특히 cytotoxin-associated gene A와 vaculoating cytotoxin A는 주된 독성인자들로, 위암의 전구 병변인 위축성 위염과 장상피화생을 일으키는 것으로 알려져 있다[11-13]. 이 외에도 헬리코박터 파일로리 감염에 대한 개개인의 염증 반응은 유전적 차이 등으로 인하여 다른 양상으로 나타날 수 있고, 고염식, 흡연 등의 환경적 요인도 헬리코박터 파일로리와 관련된 위암의 발암 현상을 일으킬 수 있다.
헬리코박터 파일로리 감염을 동반한 위축성 위염에서 제균 치료 후 위점막의 위축도가 호전되었고, 장상피화생으로의 진행을 예방할 수 있었으며, 무작위 대조군 연구에서 위암 발생을 감소시킬 수 있었다는 연구 결과들을 바탕으로 일본의 헬리코박터 파일로리 진료지침과 Maastricht 지침에서는 헬리코박터 파일로리 감염 시에 제균 치료 시행을 권고하고 있다[14]. 많은 연구들에서 이른바 ‘point of no return’ 시점이 지난 장상피화생이 있는 위점막의 경우에는 제균 치료 후 위점막의 조직학적인 호전이 드물다고 보고되고 있다[15,16]. 따라서 헬리코박터 파일로리 제균 치료는 위암을 예방할 수 있는 효과적인 방법 중 하나이지만, 이미 장상피화생이 진행된 경우에는 위암 예방의 효과가 적을 것으로 판단된다. 중국에서 진행되었던 무작위 전향 연구에서도 헬리코박터 파일로리 제균 치료는 장상피화생이 진행되지 않은 경우 위암의 예방 효과가 있었으나, 장상피화생이 진행된 위점막이 있는 군에서는 위암 예방 효과가 없었다[17]. 하지만 실제 내시경 검사에서 초기 장상피화생의 경우 관찰 및 진단이 쉽지 않기 때문에 위축성 위염과 장상피화생을 각각 구분하여 진행한 이전 연구들에서는 선택 편향(selection bias)의 가능성을 고려해야 한다.
최근에 발표된 국립암센터의 연구에서는 194명의 헬리코박터 파일로리 제균 치료군과 202명의 위약군을 장기간(중앙값 5.9년) 위약 대조군 전향적 무작위 배정을 하여 관찰하였다[8]. 이 연구의 결과에서 헬리코박터 파일로리 제균 치료 후 제균이 된 경우 이시성 위암의 발생이 hazard ratio (HR) 0.032 (95% CI: 0.15~0.66)로 나와 이시성 위암을 약 70% 감소시켰다는 결과를 보고하였다. 또한, 위체부의 위축성 위염은 치료 후 3년 정도 관찰한 결과 헬리코박터 파일로리 제균 치료를 한 군에서 대조군에 비하여 약 3배 정도 호전되는 비율이 높음을 보고하였다[8].
조기 위암에서 내시경 절제술을 시행한 후에도 많은 수의 환자에서 위축성 위염과 장상피화생 같은 비정상적인 위점막 조직은 여전히 남아 있기 때문에 이시성 위암의 발생 가능성은 항상 존재한다. 헬리코박터 파일로리 제균 치료가 이러한 이시성 위암의 발생을 줄일 수 있는지에 대한 이전의 연구들에서 내시경 절제술 후 예방적인 헬리코박터 파일로리 제균 치료가 이시성 위암의 발생을 줄인다는 결과들을 보고하였고[18,19], 최근의 메타분석들에서도 헬리코박터 파일로리 제균 치료를 하는 경우에 이시성 위암의 발생 위험에 대한 relative risk가 0.467 (95% CI: 0.362~0.602, P<0.001), odds ratio가 0.46 (95% CI: 0.39~0.55)으로 유의하게 감소한다고 보고하였다[9,20].
저도 선종의 10~30%, 고도 선종의 80% 이상에서 위선암으로 진행하는 것으로 알려져 있다[21-24]. 위암의 전구 병변인 위선종이나 조기 위암에서 내시경 절제술 등의 치료 전에 제균 치료를 시행하고 이에 대한 변화를 관찰한 몇몇 연구들이 일본에서 보고되었다.
1999년 연구에서는 헬리코박터 파일로리 제균 치료에 성공한 30개의 위선종을 중앙값 21개월간 경과 관찰하였을 때, 23%인 7개 병변은 크기가 줄고, 10%인 3개 병변에서는 내시경 소견상 관해가 관찰되었으나 조직학적으로는 남아 있었다[25]. 이 연구에서는 위선종을 제균 치료 후 경과 관찰 시, 약 1/3에서 크기가 줄거나 내시경 검사 시 보이지는 않지만 조직학적으로는 선종이 남아 있었다. 결국 헬리코박터 파일로리 제균 치료를 하였을 때, 선종은 완전 관해가 되어 없어지기보다는 점막의 변화로 인한 내시경에서 위음성 소견을 보일 수 있음을 보고하였다.
64명의 위선종을 대상으로 한 연구에서는 헬리코박터 파일로리 제균 치료에 성공한 32개의 위선종을 2년 동안 경과 관찰 하였을 때 위암으로의 진행은 없었고, 제균 치료를 하지 않은 환자들에서는 12.5%에 위암이 발생하였다는 결과를 보여주었다[26]. 이 연구에서 헬리코박터 파일로리 제균 치료가 위선종의 진행을 억제하는 기전에 대한 가설로는 제균 치료 시 암으로의 진행에 관여하는 점막 사이토카인들의 생성이 감소하여 위선종에서 위암으로의 진행을 억제하는 것으로 판단하였다.
2005년 보고된 또 다른 연구에서는 조기 위암이나 위선종으로 진단된 후 헬리코박터 파일로리 제균 치료를 성공한 29명의 환자들을 대상으로 제균 치료 후 약 한 달 뒤, 내시경 절제술 시행 전 추적 내시경을 하여 육안적, 조직학적 변화를 관찰하였다[27]. 29명 33개의 병변 중 11개의 병변(33%)에서 제균 치료 성공 후 병변이 편평해지고 희미해졌으며, 이 중 8개의 병변에서는 내시경 절제술 후 조직검사 결과 종양을 덮고 있는 원주 상피조직이 정상 모양으로 관찰되었다(Fig. 1). 저자들은 이러한 변화가 위 상피세포의 분화에 영향을 미치는 헬리코박터 파일로리가 제균되면서 위 상피세포가 정상 모양으로 돌아오는 것으로 판단하였고, 특히 융기된 병변의 모양은 편평해지지만 함몰된 병변에서는 변화가 없음을 관찰하였다. 이러한 결과를 토대로 헬리코박터 파일로리는 위선종의 위쪽으로의 성장에 관여할 것이라는 가설과 제균 치료 후 위축성 위염이 호전되면서 위산 분비가 정상적으로 증가하면서 세포가 정상화된다는 가설을 제시하였다[28]. 또한 헬리코박터 파일로리가 없으면 위암 세포에서 분비되는 Ki-67이 줄어들어 제균 치료 시 위암의 성장을 늦출 수 있다는 가설을 세웠다[29]. 이러한 결과들로 인하여, 헬리코박터 파일로리 제균 치료를 시행한 환자들에서는 종양의 모양이 내시경적으로 발견하기 어렵게 변하고, 결국 내시경적 진단률을 저하시키는 경향이 있다.
가장 최근 Helicobacter지에 발표된 연구에서는 위선종으로 진단 후 헬리코박터 파일로리 제균 치료에 성공한 27명의 환자를 장기 추적 관찰하였을 때, 12명(44.4%)에서 선종의 육안적 퇴행이 관찰되었으며, 그중 7명(25.9%)은 평균 19.9개월에 선종이 육안적, 조직학적으로 완전히 퇴행되었다[30]. 제균 치료된 환자의 위선종 중 22.2%는 선종이 점차 진행을 하였으며, 그중 6개의 선종은 제균 치료에도 불구하고 악성 변화가 일어났으나 이는 처음 진단에서 평균 82.7개월 후에 발생하였다. 이러한 결과들은 제균 치료가 위점막의 헬리코박터 파일로리 감염에 의한 염증 반응을 감소시키며, 위산을 포함하는 위장관 호르몬의 분비를 정상적으로 유도하고, 위 세포의 활발한 증식을 지연시켜 선종의 퇴행을 일으키거나 천천히 진행을 일으키는 것으로 설명하였다. 이 연구에서 저자들은 위선종에서 헬리코박터 파일로리 제균 치료에 성공한 경우 약 1/4에서는 완전 관해가 되고, 관해가 되지 않고 진행을 하는 경우에도 진행 속도가 느리기 때문에 추적 관찰 중 발견되면 내시경 절제술이 가능하므로 일부 위선종에서는 헬리코박터 파일로리 제균 치료 후 경과 관찰하는 것이 도움이 된다고 주장하였다.
지금까지 연구들의 결과에서 헬리코박터 파일로리 제균 치료시 약 20개월 후 일부 선종은 완전 퇴행을 보였으며, 비록 선종의 완전 퇴행이 이루어지지 않았다 하더라도 제균 치료가 선종의 악성화 진행을 억제하여 진행 속도의 감소를 일으킴(약 2~7년 후 악성화)을 보여주었다(Table 1). 이러한 결과들을 바탕으로 크기가 작은 저도 선종, 고령의 환자, 내시경 절제술의 위험군 등 일부의 선종 환자들에서 헬리코박터 파일로리 제균 치료를 내시경 절제술 전 시행하고, 최소 2년 간격으로 내시경적 추적관찰을 하여 내시경 치료 여부를 선택하는 것이 치료법 중 하나가 될 수 있을 것으로 생각된다. 하지만 3/4 이상의 위선종들은 제균 치료에도 불구하고 결국 진행을 하기 때문에 추적 관 찰이 힘든 경우나 크기가 큰 선종 등에서는 내시경 절제술을 먼저 고려하는 것이 바람직할 것이다. 고도 선종이나 조기 위암에서는 헬리코박터 파일로리 제균 치료 후 경과 관찰을 하는 것에 대한 연구들이 매우 적고, 헬리코박터 파일로리 제균 치료 후 오히려 병변의 경계를 불명확하게 할 수 있기 때문에 가능하면 제균 치료 전에 내시경 절제술을 시행하고, 내시경 절제술 후 제균 치료를 시행하는 것이 좋을 것으로 생각된다. 추후 고도 선종이나 조기 위암 환자들 중 출혈 위험성, 기저 질환 등으로 내시경 또는 수술적 절제술이 어려운 경우 헬리코박터 파일로리 제균 치료가 얼마나 도움이 될 수 있는지에 대한 연구들이 진행된다면 환자들에게 더 많은 도움을 줄 수 있을 것으로 판단된다.
Fig. 1.
Endoscopic features of the gastric adenoma at pre- (A~D) and post-eradication therapy (E~H). Tumor has become flattened and indistinct after eradication therapy. Adapted from the article of Ito et al. Aliment Pharmacol Ther 2005;21:559-566, with permission [27].
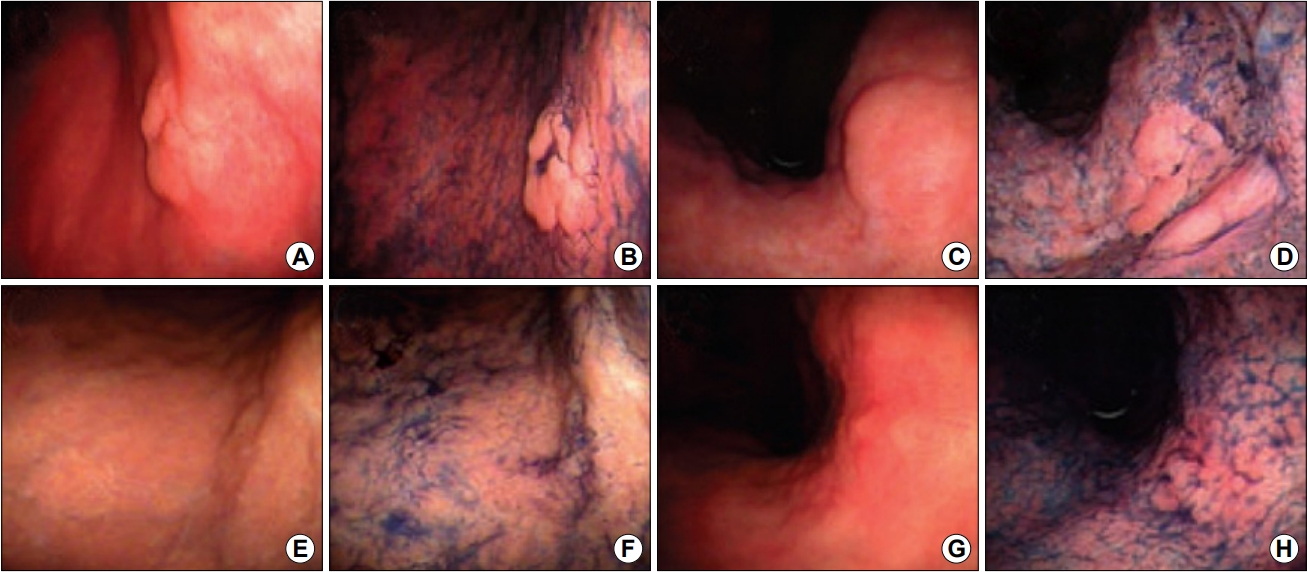
Table 1.
Summary of the Previous Studies Published on the Effectiveness of Helicobacter pylori Eradication before Treatments
| Author | Year | Number of eradicated lesions | Mean age (years) | Sex ratio (M/F) | Histologic grade (adenoma/carcinoma) | Endoscopically decreased or regression | Complete regression | Follow-up period |
|---|---|---|---|---|---|---|---|---|
| Gotoda et al. [25] | 1999 | 30 | 64.9 | 20/10 | 30/0 | 7/30 (23.3%) | 0% | 14 months |
| Ito et al. [27] | 2005 | 33 | 69.8 | 19/10a | 12/21 | 11/33 (33%) | - | 33.9 days |
| Suzuki et al. [30] | 2015 | 27 | 63.7 | 16/11 | 27/0 | 12/27 (44.4%) | 25.9% | 91.9 months |
REFERENCES
2. Schistosomes, liver flukes and Helicobacter pylori. IARC working group on the evaluation of carcinogenic risks to humans. Lyon, 7-14 June 1994. IARC Monogr Eval Carcinog Risks Hum 1994;61:1–241.


3. Lee JH, Choi KD, Jung HY, et al. Seroprevalence of Helicobacter pylori in Korea: a multicenter, nationwide study conducted in 2015 and 2016. Helicobacter 2018;23:e12463.



5. Fuccio L, Zagari RM, Eusebi LH, et al. Meta-analysis: can Helicobacter pylori eradication treatment reduce the risk for gastric cancer? Ann Intern Med 2009;151:121–128.


6. Malfertheiner P, Megraud F, O'Morain CA, et al. Management of Helicobacter pylori infection--the IV/Florence consensus report. Gut 2012;61:646–664.


7. Rokkas T, Pistiolas D, Sechopoulos P, Robotis I, Margantinis G. The long-term impact of Helicobacter pylori eradication on gastric histology: a systematic review and meta-analysis. Helicobacter 2007;12 Suppl 2:32–38.


8. Choi IJ, Kook MC, Kim YI, et al. Helicobacter pylori therapy for the prevention of metachronous gastric cancer. N Engl J Med 2018;378:1085–1095.


9. Bang CS, Baik GH, Shin IS, et al. Helicobacter pylori eradication for prevention of metachronous recurrence after endoscopic resection of early gastric cancer. J Korean Med Sci 2015;30:749–756.



10. Huang JQ, Zheng GF, Sumanac K, Irvine EJ, Hunt RH. Meta-analysis of the relationship between cagA seropositivity and gastric cancer. Gastroenterology 2003;125:1636–1644.


11. Kim N, Park YS, Cho SI, et al. Prevalence and risk factors of atrophic gastritis and intestinal metaplasia in a Korean population without significant gastroduodenal disease. Helicobacter 2008;13:245–255.


12. Kuipers EJ, Pérez-Pérez GI, Meuwissen SG, Blaser MJ. Helicobacter pylori and atrophic gastritis: importance of the cagA status. J Natl Cancer Inst 1995;87:1777–1780.



13. Atherton JC. The clinical relevance of strain types of Helicobacter pylori. Gut 1997;40:701–703.



14. Asaka M, Kato M, Takahashi S, et al. Guidelines for the management of Helicobacter pylori infection in Japan: 2009 revised edition. Helicobacter 2010;15:1–20.

15. Salih BA, Abasiyanik MF, Saribasak H, Huten O, Sander E. A follow-up study on the effect of Helicobacter pylori eradication on the severity of gastric histology. Dig Dis Sci 2005;50:1517–1522.



16. Satoh K, Kimura K, Takimoto T, Kihira K. A follow-up study of atrophic gastritis and intestinal metaplasia after eradication of Helicobacter pylori. Helicobacter 1998;3:236–240.

17. Wong BC, Lam SK, Wong WM, et al. Helicobacter pylori eradication to prevent gastric cancer in a high-risk region of China: a randomized controlled trial. JAMA 2004;291:187–194.


18. Fukase K, Kato M, Kikuchi S, et al. Effect of eradication of Helicobacter pylori on incidence of metachronous gastric carcinoma after endoscopic resection of early gastric cancer: an open-label, randomised controlled trial. Lancet 2008;372:392–397.


19. Bae SE, Jung HY, Kang J, et al. Effect of Helicobacter pylori eradication on metachronous recurrence after endoscopic resection of gastric neoplasm. Am J Gastroenterol 2014;109:60–67.



20. Sugano K. Effect of Helicobacter pylori eradication on the incidence of gastric cancer: a systematic review and meta-analysis. Gastric Cancer 2019;22:435–445.



21. Rugge M, Correa P, Dixon MF, et al. Gastric dysplasia: the Padova international classification. Am J Surg Pathol 2000;24:167–176.


24. Choi SI, Park JC. The natural history and treatment strategy of gastric adenoma as a pre-cancerous lesion. Korean J Helicobacter Up Gastrointest Res 2018;18:103–109.

25. Gotoda T, Saito D, Kondo H, et al. Endoscopic and histological reversibility of gastric adenoma after eradication of Helicobacter pylori. J Gastroenterol 1999;34 Suppl 11:91–96.

26. Saito K, Arai K, Mori M, Kobayashi R, Ohki I. Effect of Helicobacter pylori eradication on malignant transformation of gastric adenoma. Gastrointest Endosc 2000;52:27–32.


27. Ito M, Tanaka S, Takata S, et al. Morphological changes in human gastric tumours after eradication therapy of Helicobacter pylori in a short-term follow-up. Aliment Pharmacol Ther 2005;21:559–566.


28. Haruma K, Mihara M, Okamoto E, et al. Eradication of Helicobacter pylori increases gastric acidity in patients with atrophic gastritis of the corpus-evaluation of 24-h pH monitoring. Aliment Pharmacol Ther 1999;13:155–162.


-
METRICS

-
- 1 Crossref
- 4,252 View
- 105 Download
- Related articles in Korean J Helicobacter Up Gastrointest Res
-
The Recurrence of Helicobacter pylori Infection: Recrudescence Versus Reinfection2023 December;23(4)






